3种蓑藓属(Macromitrium)植物DNA C-值测定
解梦 印丽萍 娄玉霞 郭水良

摘 要: 分别以小立碗藓(Physcomitrella patens)和水稻(日本晴亚种)(Oryza sativa spp.japonica)为标样,用流式细胞术分别测定了中华蓑藓(Macromirium cavaleriei)、钝叶蓑藓(M.japonicum)和缺齿蓑藓(M.gymnostomum)3种藓类植物的DNA C-值,由此建立了应用流式细胞术测定蓑藓属植物DNA C-值的方法,讨论了影响藓类植物DNA C-值测定结果的因素.最后讨论了苔藓植物DNA C-值变异式样、系统发育和分类学意义,以及今后有关藓类植物DNA C-值研究中值得关注的几个方向.
关键词: 蓑藓; 流式细胞术; DNA C-值; 藓类植物
中图分类号: Q 949.1文献标志码: A文章编号: 1000-5137(2019)02-0188-09
0 引 言
DNA C-值指一个物种配子核中没有复制时的DNA含量(单位:pg).与DNA C-值密切相关的概念是基因组的大小,后者指配子中单组染色体的DNA含量[1].
真核生物细胞核的DNA由编码DNA和非编码DNA两部分组成,后者占核DNA总量的绝大部分,是细胞染色体构架的主体[2-3].真核生物不仅通过细胞核中编码DNA的表达,也通过核DNA 本身质量及体积的物理作用来影响表型.因此,物种的核DNA含量有重要的生物和生态学意义[4].
被子植物DNA C-值的研究已经取得了一系列成果,发现其在不同种类间存在巨大的差异[5],并具有进化和系统发育上的意义[6].DNA C-值能够用于杂交种识别和一些疑难种分类处理[7-8].KRAAIJEVELD [9]发现DNA C-值与被子植物某些分类群的物种多样性有关.随着DNA C-值变大,物种灭绝的风险会增加[10].在被子植物的有些类群中存在 DNA C-值的种下变异,这可能与它们对生境的适应有关[11].人们已经在部分被子植物中发现DNA C-值与海拔高度、纬度、经度、气温、雨量之间呈现出相关性[12-13],因而具有生态适应意义.目前已测定了约7542种被子植物的DNA C-值[14],约占被子植物种数的3%.
RESKI等[15]运用流式细胞术测定了小立碗藓(Physcomitrella patens (Hedw.) B.S.G.)野生型和突变株的核DNA含量,这是最早有关苔藓植物DNA C-值的报道.TEMSCH等[16]用碗豆(Pisum sativum)为内标,运用福尔根染色法测定了奥地利30种泥炭藓属(Sphagnum L.)植物的DNA C-值,发现其中26种为单倍体,4种为二倍体,单倍体种的DNA 1C-值为0.392~0.506 pg;二倍体种的DNA 1C-值(没有复制时的配子中的DNA含量)为0.814~0.952 pg;并发现组内的DNA 1C-值变异大于组间.RENZAGLIA等[17]应用福尔根显微分光光度计法测定了17种苔藓植物精子的DNA 含量,发现短角苔(Notothylas orbicularis)和黄角苔(Phaeoceros laevis)的DNA 1C-值最低,分别是0.17 pg和0.26 pg;在苔类中DNA 1C-值从Blasia pusilla的0.49 pg到Pellia epiphylla的4.05 pg,發现在测定的苔藓植物中,DNA C-值大小与染色体数目没有相关性,但是与精子的体积呈正相关.VOGLMAYR[18]测定了138种藓类植物的DNA C-值,发现DNA C-值最小的是苞领藓属(Holomitrium)的H.arboreum,DNA C-值为0.17 pg,最大的是小萼苔属(Mylia Gray)的M.taylorii,为7.97 pg.到目前为止,有7篇论文共报道了232种苔藓植物的DNA C-值[19],约占苔藓植物种数的1%.
苔藓植物中配子体占优势,又有原丝体、双鞭毛精子、无维管束等有别于被子植物的性状,在生态分布、繁育和传播方式、生活型等方面也与被子植物不同.因此,苔藓植物中DNA C-值的变异式样,及其生态适应、地理分布、分类学和进化学上的意义肯定也有别于被子植物,要阐明这些问题,需要在更多的苔藓植物类群中测定DNA C-值.
本文作者以3种蓑藓属植物为对象,分别应用日本晴(Oryza sativa ssp.japonica,DNA 1C-值约为0.4 pg)和小立碗藓(Physcomitrella patens,DNA 1C-值约为0.5 pg)为外标,应用流式细胞术测定了它们的DNA C-值,旨在阐明两种不同测定方法的结果差异,建立苔藓植物DNA C-值测定的方法.
1 蓑藓属3种植物的DNA C-值测定
1.1 实验材料
中华蓑藓(M.cavaleriei Card.& Thér.)、缺齿蓑藓(M.gymnostomum Sull.& Lesq.)、钝叶蓑藓(M.japonicum Dozy & Molk.)是中国东部地区常见的3种蓑藓属植物,分别采自福建永安天宝岩保护区、浙江嵊山福善寺旁公路边、浙江台州九峰公园.凭证标本存放于上海师范大学苔藓植物标本室.
实验采用两种标样作对比,其中小立碗藓采自云南昆明宜良县,日本晴由上海市出入境检验检疫局提供.
1.2 实验方法
1.2.1 细胞核分离缓冲液
应用流式细胞术测定DNA C-值时主要使用以下几种核分离缓冲液:
LB01缓冲液:15 mmol·L-1 Tris,2 mmol·L-1乙二胺四乙酸二钠(Na2EDTA),0.5 mmol·L-1 spermine (精胺).4HCl,80 mmol·L-1 KCl,20 mmol·L-1NaCl,15 mmol·L-1 β-mercaptoethanol(β-巯基乙醇),0.1% (体积分数) TritonX-100,去离子水定容至200 mL,pH=7.5[20].
Arumuganathan & Earle 缓冲液:9.53 mmol·L-1MgSO4·7H2O,47.67 mmol·L-1 HEPES,6.48 mmol·L-1二硫苏糖醇(DTT),25 g·mL-1 (质量浓度) Triton X-100,去离子水定容至200 mL,pH=8.0[21].
Marie′s nuclear isolation 缓冲液:50 mmol·L-1葡萄糖,15 mmol·L-1 NaCl,5 mmol·L-1 Na2EDTA,50 mmol·L-1柠檬酸钠,0.5% (体积分数) Tween20,50 mmol·L-1HEPES,0.5%(体积分数)β-巯基乙醇,去离子水定容至200 mL,pH=7.2[22].
Otto 缓冲液:100 mmol·L-1柠檬酸,0.5% (体积分数)Tween20,去离子水定容至200 mL,pH≈2.3[23].
Galbraith 缓冲液:45 mmol·L-1 MgCl2,30 mmol·L-1柠檬酸钠,20 mmol·L-1 MOPS(4-丙磺酸基吗啉)和1 g·mL-1 (质量浓度) Triton X-100,去离子水定容至 200 mL,pH=7.0[24].
其中 LB01缓冲液、Arumuganathan & Earle 缓冲液和 Marie′s nuclear isolation缓冲液的制备步骤较多,且含有对人体有害成分,故选用Otto缓冲液和Galbraith缓冲液,置于4 ℃冰箱保存备用[25].
1.2.2 操作步骤
取样品和标样叶片约50 mg,置于塑料平皿中,分别加入1 mL缓冲液,平皿置于冰上.使用锋利剃须刀片快速将叶片切碎,用孔径为30 μm的无菌滤网过滤后,滤液置于容积为2 mL的离心管中,离心(1600 r·min-1,5 min),弃上清.直接加200 μL荧光染料PI-Rnase(基因公司 550825),置于4 ℃避光染色20 min.将制备好的经染色的细胞核悬液转入标准上样管中,上机测定[26].同时准备一只装有2~3 mL次氯酸钠溶液(有效氯体积分数为0.5%)的上样管,用以消毒.每根上样管结束测试后都需要用消毒液冲洗.每个实验都进行3次重复.
1.2.3 待测样品上机分析测定
测定仪器为美国BD公司生产的FACSCalibur流式细胞仪.经PI-Rnase染色的样品通过流式细胞仪,从附带软件CellQuestTM Pro获取数据的散点图和直方图,通过ModFit LT软件显示直方图,分析得到样品的二倍体阶段(DIP)G0/G1(DNA静止期/DNA合成前期)荧光值峰值和G0/G1荧光值峰的变异系数[27].该系数值小于3%,表示结果准确;小于5%,表示基本正确;大于8%,表示结果不准确[26].峰值及变异系数均能从ModFit LT软件上直接读出.最后通过比较样品与标样的G0/G1荧光值峰值来计算核DNA C-值.
计算测试样品的DNA 2C-值Q(体细胞中的DNA含量,单位:pg):
其中,R为标样核DNA 2C-值,E为待测样品的G0/G1荧光值峰值,S为标样的G0/G1荧光值峰值[28].
1.2.4 实验方法对蓑藓属样品DNA C-值测定结果的影响
分別以小立碗藓为标样(采用Galbraith 缓冲液),和以日本晴为标样(采用Otto缓冲液)测定了蓑藓属植物的DNA C-值.由于实验材料的缘故,以日本晴为标样的方法测定了3种蓑藓属的DNA C-值,以小立碗藓为标样的方法测定了钝叶蓑藓和缺齿蓑藓的DNA C-值.
1.2.5 实验结果
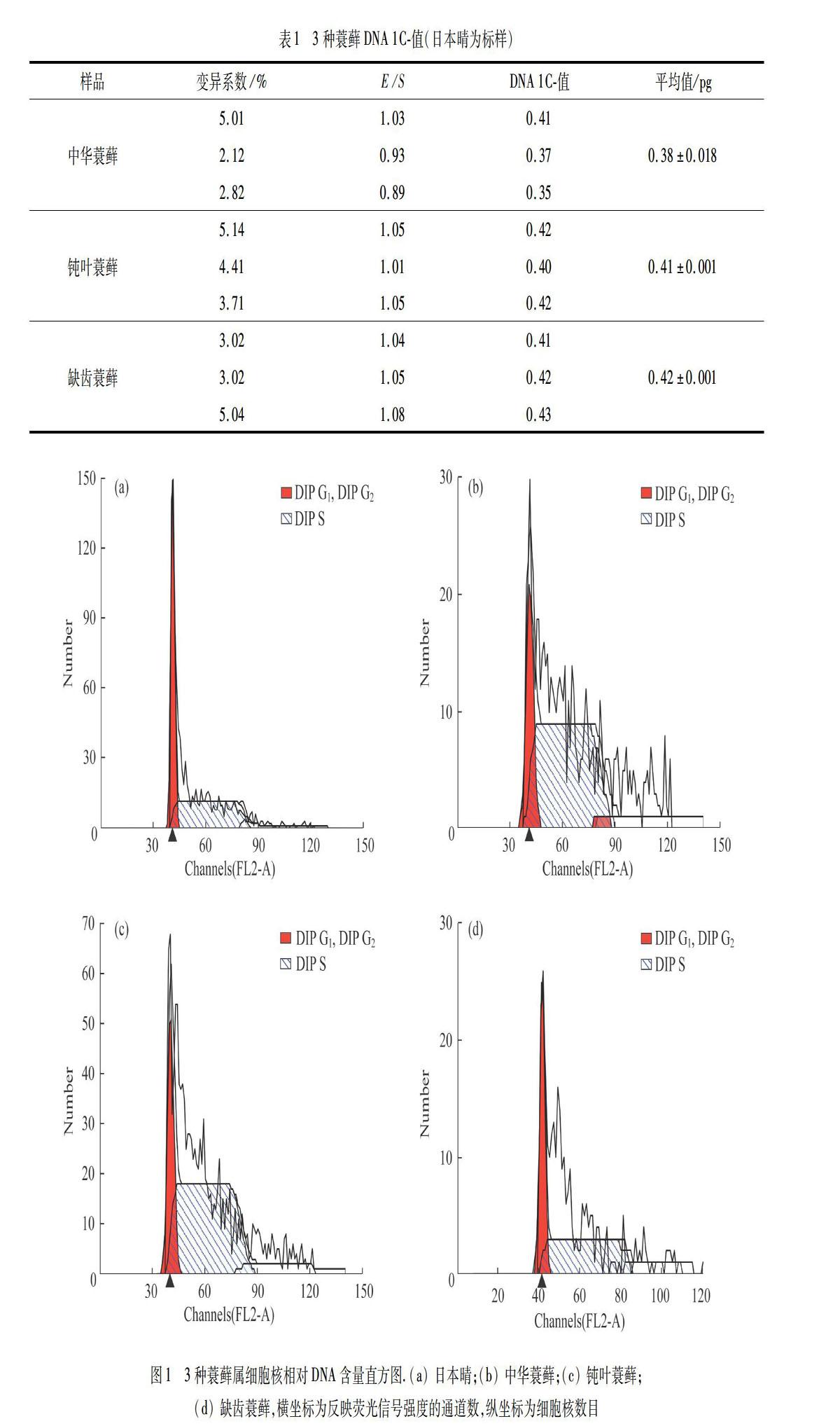
用日本晴为标样和Otto缓冲液,对3种蓑藓DNA C-值测定结果如表1所示,细胞核相对DNA含量直方图如图1所示.图1中,DIP G1,DIP DNA合成后期G2和合成期S对应荧光信号强度在x轴上用通道数(channel)表示,反映了样品细胞的 DNA 相对含量,y轴对应通道内出现具有相同光信号特征性细胞核的数量.
用小立碗藓为标样和Galbraith 缓冲液对钝叶蓑藓、缺齿蓑藓DNA C-值测定结果见表2,细胞核相对DNA含量直方图见图2.
2 讨 论
2.1 影响DNA C-值测定结果的因素分析
DNA C-值的检测方法主要有化学分析法、Feulgen染色法[29]、复性动力学法[30],和近几年兴起的流式细胞术等4种方法.化学分析法在20世纪60年代之后就很少使用了;复性动力学法在20世纪70年代之后几乎不再使用了[31];福尔根染色法目前比较常用,但是该方法实验操作复杂,结果不够稳定[32];流式细胞术是近年来受到重视的测定植物DNA C-值的方法.该方法应用了流式细胞仪,综合性高,涉及激光技术、计算机技术、流体力学、细胞化学、图像技术等多个领域的知识[33],具有测量速度快、测量参数多的优点,可以在1 s内测定数万个细胞,能够对同一个细胞做有关物理、化学特性的多参数测量,获得的数据能够进行统计检验.流式细胞术既能够进行细胞分析,也能够进行细胞的分选.用流式细胞仪检测每个细胞核的荧光信号强度,并经仪器自动分析,DNA含量与荧光信号成正比关系.但是,流式细胞仪不同的生产厂家、不同的型号、不同的细胞核悬液,甚至样品不同的生长时期都可能会影响植物DNA C-值的测定结果[34].
BAINARD等[35]以苔藓植物为材料开展流式细胞术测定方法对DNA C-值检测结果的影响,发现缓冲液、荧光染色时间、染色液浓度对测定结果具有明显影响.其中,以缓冲液类型和碘化丙啶染色液浓度的影响最大,分别会造成8%和14%的偏差.
方其等[36]以油菜(Brassica campestris)为材料,从标样、细胞核悬液、样品生长时期等方面研究了影响DNA C-值检测的实验因素.发现标样种类和样品的生长时期对实验结果没有明显影响,与Galbraith 缓冲液和Otto缓冲液相比,应用Tris-MgCl2细胞核悬液能够得到稳定的实验结果.本研究结果证实这两种缓冲液也能够获得比较稳定的结果.
在GREILLHUBER等[19]報道的232种藓类植物DNA C-值为0.17~7.97 pg,平均值为0.66 pg,其中有135种(约占测定种数的58%)藓类植物的DNA C-值为0.3~0.5 pg.本实验测定的3种蓑藓的DNA C-值在0.38~0.42 pg之间,而且数据的重复性好,标准误差大小在0.001~0.020之间.用日本晴和小立碗藓实验的结果基本一致,说明两种方法均可行.
2.2 藓类植物DNA C-值研究的意义和展望
现有研究表明:藓类植物的DNA C-值平均值在0.17~4.05 pg之间,明显低于被子植物(平均为5.98 pg)[37];藓类群之间DNA C-值变异幅度低于被子植物.RENZAGLIA等[17]认为藓类植物的核DNA 含量在进化上受制于其双鞭毛精子,因为核DNA 含量越大,精子体积越大,其运动能力越弱,越不利于受精作用,被子植物则不受这一因素影响.
苔藓植物配子体占优势,又有原丝体、双鞭毛精子、无维管束等有别于被子植物的性状,在生态分布、繁育和传播方式、生活型等方面也与被子植物不同.因此,苔藓植物中DNA C-值的变异式样,及其生态适应、地理分布、分类学和进化学上的意义肯定有别于被子植物,要阐明这些问题,需要开展以下几个方面工作.
1) 苔藓植物约有2万种,是种数上仅次于被子植物的高等植物,但是关于苔藓植物DNA C-值的研究才刚刚起步,世界范围内仅232种苔藓植物有DNA C-值的数据资料[19],例如木灵藓科(Orthotrichaceae)、棉藓科(Plagiotheciaceae)、锦藓科(Sematophyllaceae)、塔藓科(Hylocomiaceae)、缩叶藓科(Ptychomitriaceae)等近半数科的藓类植物还没有任何DNA C-值数据,而蔓藓科(Meteoriaceae)、丛藓科(Pottiaceae)、真藓科(Bryaceae)等世界性大科仅测定了个别或极少数种类[17].其次,测定过DNA C-值的种类中,有的采用了结果不太可靠的Feulgen染色法等.除了葫芦藓(Funaria hygrometrica Hedw.)等少数世界广布种外,中国苔藓植物的绝大部分种类没有DNA C-值的数据资料.国内也没有任何有关苔藓植物DNA C-值研究的报道.DNA C-值在苔藓植物的变异式样如何,是否具有进化和系统发育上的指示价值,要阐明这些问题,需要系统地测定苔藓植物的DNA C-值.
2) 杂交、染色体多倍化、渐变群现象在苔藓植物中比较普遍,造成了苔藓植物的许多分类学问题[38].但是,苔藓植物个体细小,又不像被子植物有非常活跃的根尖和茎尖分生组织,加上苔藓植物染色体小,因此,影响了苔藓植物的染色体研究和数据积累[39].应用流式细胞术对被子植物部分类群DNA C-值进行测定和倍性分析,成功地处理了多倍体、杂交种的识别和疑难种的分类问题.但是,还没有在苔藓植物学领域开展相应的工作,这方面的工作有可能为苔藓植物系统分类提供新的技术方法和分类学性状.
3) 在被子植物中,DNA C-值在部分类群中有生物地理学和生态适应上的意义.但是,有关苔藓植物DNA C-值数据非常缺乏,已有的百余种苔藓植物的DNA C-值数据,也由于前人测定方法的差异,样品采集没有考虑生境类型、繁育特点和地理分布等因素[18],使一些结果缺乏可比性,无法进行DNA C-值和生态、地理分布的相关分析.因此,需要通过对不同生态系统和地理区域的藓类植物进行DNA C-值的测定,解析苔藓植物DNA C-值的生态适应和生物地理学意义,探讨应用DNA C-值评估苔藓植物地理分布和生态适应特点的价值.
4) 苔藓植物的DNA C-值明显小于被子植物,RENZAGLIA将进化上的选择因素归于苔藓植物的双鞭毛精子.但是,有相当一部分苔藓植物既有有性繁殖又有无性繁殖,而且有部分苔藓植物类群不需要双鞭毛精子,只通过无性繁殖来繁衍其种群[40].因此,有必要通过研究来探讨繁殖方式对DNA C-值的影响,以期检验RENZAGLIA观点的正确性.
5) 内多倍化(endopolyploidy)指细胞中的DNA进行了复制,但是没有伴随着核的有丝分裂,结果形成了植物体组织或器官中细胞的不同倍性水平.BAINARD等[41]测定了46种苔藓植物的核DNA含量,发现其中40种藓类植物普遍存在着不同程度的内多倍化现象,而其余6种苔类植物中几乎没有出现内多倍化现象.本文作者发现小立碗藓中存在明显的出现内多倍化现象,但是3种蓑藓中却没有一种有内多倍化现象.小立碗藓是一种重要的分子生物学模式植物,先前报道该种只有2种倍性现象,但是本文作者测定发现存在明显的单倍体、二倍体和四倍体现象.本实验所采用的小立碗藓标样采自云南昆明宜良县,是否反映了该种是小立碗藓的一个特殊种群,值得进一步研究.
参考文献:
[1] SOLTIS D E,SOLTIS P S,BENNETT M D.Evolution of genome size in the angiosperms [J].American Journal of Botany,2003,90(11):1596-1603.
[2] FLAVELL R B.The molecular characterization and organization of plant chromosomal DNA sequences [J].Annual Review of Plant Physiology,1980,31:569-596.
[3] CAVALIER-SMITH T.Eukaryote gene numbers,non-coding DNA and genome size [M]//The Evolution of Genome Size.Chichester,Britain:John Wiley & Sons,1985:69-103.

