芍药苷调控MLH1和MSH2蛋白增强黑色素瘤细胞对放疗的敏感性①
岳运霞 刘文彬 王松琪 闫海山 姬颖华
(鹤壁市人民医院放疗科,鹤壁458030)
黑色素瘤是目前恶性程度较高的一类皮肤肿瘤,常称恶性黑色素瘤(Malignant melanoma,MM),它在全球范围内发病率一直较高,类型多见于皮肤肿瘤,也见于软脑膜和脉络膜,大约占所有皮肤肿瘤的12%,但是黑色素瘤确诊后的死亡率高达85%,且近年来发病率有不断上升的趋势[1,2]。黑素瘤患者的预后较差的原因主要是由于早期诊断困难,晚期治疗效果不佳,对多种化疗药物反应不佳[3]。黑色素瘤的主要治疗方式包括手术和放化疗,但是手术针对局部黑色素瘤的治疗效果较好,而多部位黑色素瘤的治疗主要依靠放疗[4,5]。目前随着研究不断进展,关于黑色素瘤的生物治疗,免疫治疗和分子治疗不断发展成熟,但是探讨黑色素瘤细胞的放疗敏感性仍然是目前研究的热门方向。
芍药苷(Paeoniflorin,PF)是中药芍药的主要有效成分,是一类单萜类糖苷化合物[6]。近年来研究发现芍药苷具有一定的抗自由基损伤和抗神经毒性等活性,体内实验表明其有扩张血管、改善微循环、抗氧化等多种生物学效应,并且对身体的毒副作用小[7]。
在此研究基础上,本实验检测中药芍药苷对黑色素瘤细胞中MSH2和MLH1表达水平的调控,以及适宜浓度的芍药苷对黑色素瘤细胞放疗敏感性的影响,为黑色素瘤的放射治疗方案提供新的改良策略以改善黑色素瘤患者的治疗效果。
1 材料与方法
1.1细胞株和实验试剂 人黑色素瘤细胞株M14由复旦大学附属肿瘤医院获得。RPIM1640培养基购于美国赛默飞公司,胎牛血清购于杭州四季青生物工程材料有限公司。MLH1和MH2抗体均购自美国abcam公司(ab92312,ab52266)。脂质体Lipofectamine 2000、miR-214-mimic、miR-NC购自(Gnenpharma Co,Shanghai,China),CCK-8试剂购自美国Sigma公司,Trizol购自Ambion(Ambion Inc,Austin,TX,USA),逆转录试剂盒(FSQ-101)购自日本TOYOBO公司(TOYOBO,FSQ-101,Japan),PCR试剂盒购于美国Sigma公司(KapaBiosystems Inc,Boston,US)。
1.2方法
1.2.1实验分组 本实验分为两组,阴性对照组(NC组)和实验组(芍药苷组)。阴性对照组使用PBS处理,实验组使用250 μg/ml浓度的芍药苷进行处理细胞。
1.2.2MTT细胞增殖测定 细胞增殖实验检测不同浓度的芍药苷对黑色素瘤细胞活力的抑制作用。通过MTT测定。M14细胞以初始密度为3×104个细胞/孔接种到96孔板中。 24 h后,用不同浓度的(25、50、100、250、500 μg/ml)芍药苷处理细胞,24 h或48 h后,孵育4 h,然后离心。除去上清液,然后加入二甲基亚砜(DMSO)(150 μl)。在37℃测量每个孔的吸光度(Abs)。使用CompuSyn软件计算组合指数(CI)计算MTT值。
1.2.3Western blot检测MLH1和MSH2蛋白的表达 M14-RR细胞使用合适浓度的芍药苷处理48 h后提取总蛋白,用BCA蛋白测定试剂盒测定蛋白浓度,上样60 μg总蛋白,在4%~12% 的SDS聚丙烯酰胺凝胶中电泳,用湿转的方式将蛋白转到膜上,5%脱脂奶粉室温封闭1 h,一抗(MLH1 1∶1 000,MSH2 1∶2 000)4℃摇床孵育过夜,使用TBST洗膜3次,每次10 min,二抗室温孵育2 h,使用TBST洗膜3次,每次10 min,使用超敏ECL化学发光试剂盒显影,使用GAPDH作为内参蛋白。
1.2.4γ-H2AX 免疫荧光染色实验 芍药苷处理过的M14-RR细胞,铺板于直径为35 mm的细胞爬片的培养皿中,培养24 h后接受10 Gy的放射线照射,照射后均再培养2 h,使用预冷的4%的多聚甲醛在4℃冰箱中固定20 min,使用0.2%的TritonX-100破膜20 min,使用2%BSA 室温封闭1 h,加入50 μl的2%BSA稀释的抗γ-H2AX小鼠单克隆抗体后,放置于4℃冰箱过夜,加入50 μl羊抗鼠FITC二抗,室温孵育1 h。载玻片上加30 μl含DAPI的染色液的抗荧光淬灭封片液,室温避光30 min。然后通过荧光正置显微镜下观测每个细胞核内DNA双链断裂形成的荧光焦点数量,计算每组细胞中的平均荧光焦点数进行统计分析。实验重复3次。
1.2.5流式细胞法检测细胞凋亡及周期分布 将黑色素瘤细胞接种于6 孔板内,2 ml/孔,实验分为对照组和芍药苷组,每组均设3个复孔,药物作用48 h后消化细胞,装于1.5 ml EP管内,在4℃以2 000 r/min 转速离心15 min,弃去上清液,使用PBS轻柔混匀后等速离心,重复洗涤3次。检测细胞周期时予每管加细胞固定液(含70%预冷乙醇,5%FBS,25%PBS)200 μl固定1 h后等速离心,弃去上清液,继用PBS 洗涤2次,方法同前,弃上清,避光条件下,每管加100 μl PI,静置30 min,加300 μl PBS混匀,上流式细胞仪检测。检测细胞凋亡则用400 μl Bidding Buffer 悬浮细胞,加入5 μl Annexin V-FITC轻轻混匀后于2~8℃避光条件下孵育15 min,后加入10 μl PI同等条件下孵育5 min,1 h 内上流式细胞仪检测。
1.3统计学处理 所有的统计分析均采用SPSS 16.0软件包(SPSS,Chicago,IL)进行。组间比较采用方差分析;应用GraphPad Prism5软件进行统计图形制作。P<0.05为差异具有统计学意义。
2 结果
2.1人黑色素瘤M14放疗抵抗细胞株的建立 体外培养人黑色素瘤细胞株M14,待细胞融合度为60%~70%,且细胞处于对数生长期时分别给予2、4、6、8、10 Gy的X-ray照射2次,照射后继续于细胞培养箱中培养,密切观察细胞状态。待细胞状态恢复良好后,再进行下一次的照射,重复以上步骤,并逐渐加大每次照射的剂量,直到建立具有稳定耐受放疗能力的黑色素瘤细胞株M14,此时我们命名筛选出的细胞为M14-RR(M14 radiation resistance),后续实验使用5~10代之间的细胞。
2.2Western blot检测M14和M14-RR细胞中蛋白的表达水平 Western blot检测M14和M14-RR两组细胞中MLH1和MSH2蛋白的表达情况。如图1所示,在M14-RR组细胞中MLH1和MSH2的表达水平比M14组细胞的明显升高[(88.02±9.21) vs (37.15±5.62),P<0.05;(73.25±5.81) vs (28.61±3.07),P<0.05],两组蛋白差异有统计学意义。结果表明在放疗抵抗性细胞株中,MLH1和MSH2蛋白表达水平相应上调,所以,MLH1和MSH2的表达可能对M14黑色素瘤细胞株的放疗敏感性有一定的抵抗作用。
2.3不同浓度的芍药苷对黑色素瘤细胞抑制情况 通过MTT检测不同浓度的芍药苷对黑色素瘤M14细胞的抑制情况,确定芍药苷最适的药物作用浓度。实验结果显示:M14细胞生长呈不同程度的抑制,抑制率随芍药苷浓度的增加而增高,并在一定范围内呈浓度依赖性(表1),芍药苷药物对M14细胞最佳抑制率为(63.61±3.65)%,故以250 μg/ml浓度的芍药苷药物作为最适浓度。
2.4Western blot检测芍药苷对黑色素瘤细胞中MLH1和MSH2蛋白水平的影响 Western blot检测芍药苷对黑色素瘤细胞中MLH1和MSH2蛋白的表达情况。如图2所示,在芍药苷组黑色素瘤细胞中MLH1和MSH2的表达水平比对照组细胞的明显降低[(38.26±3.16)vs(85.31±5.16),P<0.05;(29.62±3.57)vs(74.15±6.08),P<0.05],两组蛋白差异有统计学意义。结果表明芍药苷处理过后,黑色素瘤细胞MLH1和MSH2蛋白表达水平相应下调,芍药苷在一定程度上可以增强黑色素瘤细胞的放疗敏感性。

图1 Western blot检测MLH1和MSH2蛋白在黑色素瘤细胞株中的表达情况Fig.1 Western blot detection of MLH1 and MSH2 protein expression in melanoma cell linesNote: *.P<0.05 vs the M14-RR group.
2.5芍药苷处理后黑色素瘤细胞对放疗敏感性的变化 为进一步观察在电离辐射处理后细胞变化,通过免疫荧光检测γ-H2AX聚集点不同处理的M14-RR细胞株中的表达水平。实验结果显示,γ-H2AX在对照组中的表达较弱,在芍药苷组中的表达明显增强,电离辐射明显促进了γ-H2AX聚集点的形成,在芍药苷处理过后,γ-H2AX聚集点的表达明显增多,DNA损伤较多(图3)。
2.6放疗强度处理后不同组黑色素瘤细胞凋亡率的变化 通过CCK-8细胞实验检测不同组的黑色素瘤细胞在接受放疗前后细胞活力的情况(表2)。结果显示,未接受放疗时,相比对照组,芍药苷组细胞活力变化轻度降低,差异具有统计学意义(P<0.05)。在接受10 Gy放射线之后,芍药苷组的细胞活力相比NC组降低升高,差异具有统计学意义(P<0.05)。表明芍药苷处理后可以有效增加细胞凋亡,对放射损伤有一定的增敏性。
表1 不同浓度的芍药苷对黑色素瘤细胞抑制率比较
Tab.1 Comparison of different concentrations of paeoniflorin on inhibition of melanoma cells

Paeoniflorin mass concentration(μg/ml) Cell inhibition rate(%)2511.62±1.385019.15±2.8610034.07±4.8525063.61±3.6550038.69±2.18
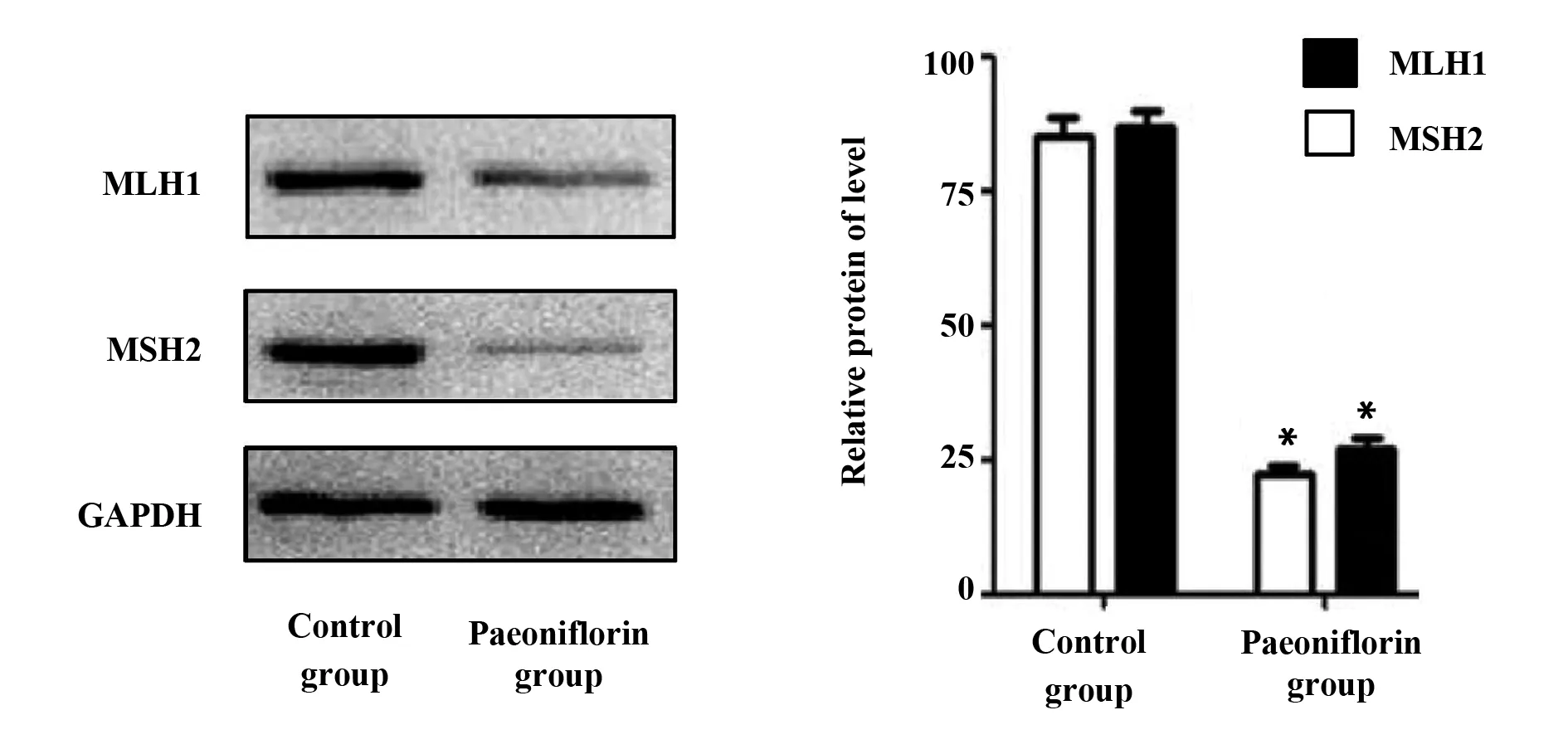
图2 Western blot检测芍药苷对黑色素瘤细胞MLH1和MSH2蛋白的表达Fig.2 Western blot detection of paeoniflorin on melanoma cells MLH1 and MSH2 protein expressionNote: *.P<0.05 vs the control group.
表3 放射线照射对各组黑色素瘤细胞周期的影响
Tab.3 Effect of radiation on cell cycle of melanoma in each group

GroupsG2/M phaseBefore radiationAfter radiationG1/G0 phaseBefore radiationAfter radiationS phaseBefore radiationAfter radiationControl group3.94±2.508.62±3.5683.25±5.8365.24±2.2613.74±2.7625.61±3.26Paeoniflorin group6.39±1.1017.62±2.5077.62±8.1548.36±1.9616.52±3.0537.61±5.56P value0.0290.0190.043

图3 免疫荧光技术检测γ-H2AX聚焦点在电离辐射之后的变化情况Fig.3 Immunofluorescence technique to detect changes in gamma-H2AX focal point after ionizing radiation
表2 放射线照射对各组黑色素瘤细胞凋亡率的影响
Tab.2 Effect of radiation exposure on apoptotic rate of melanoma cells in each group
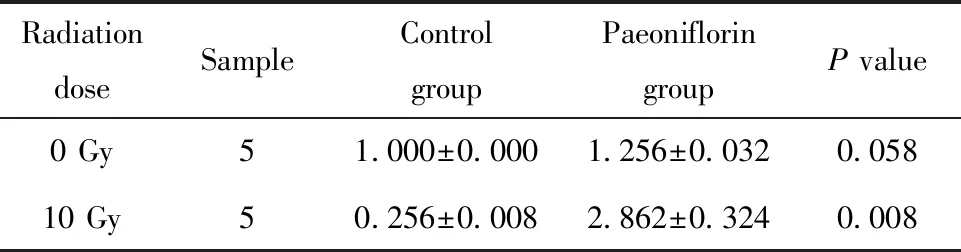
RadiationdoseSampleControlgroupPaeonifloringroupP value0 Gy51.000±0.0001.256±0.0320.05810 Gy50.256±0.0082.862±0.3240.008
2.7放疗强度处理后不同组黑色素瘤细胞周期的变化 通过流式细胞术检测放射线照射前后的细胞周期情况(表3)。对照组和芍药苷组黑色素瘤细胞照射后,G2/M期和S期细胞均比照射前增加;而G1/G0期黑色素瘤细胞则比照射前减少;相比对照组,芍药苷组细胞的差异更明显,差异有统计学意义(P<0.05);表明芍药苷处理过后,在一定程度上可以提高黑色素瘤细胞在G1、S期的分布率,干扰细胞增殖的进程。
3 讨论
黑色素瘤是一类皮肤恶性肿瘤,其主要特征是对放疗和化疗效果较差,预后效果较差[8],虽然目前放射治疗被广泛应用于黑色素瘤患者的治疗方案中,但是放射治疗的有效性取决于许多因素,包括临床患者的肿瘤类型,肿瘤细胞内的氧化水平和体内微环境[9]。最近有研究显示,很多体内生物因子影响癌细胞的放疗敏感性,如细胞凋亡因子,细胞增殖因子[10]。Ma等[11]学者研究指出,c-myc是一类广泛的致癌基因,在肿瘤细胞的增殖、分化和凋亡过程中扮演调控角色。特别是c-myc癌蛋白对人黑色素瘤的药物及放疗敏感性有不同的干扰作用,包括与各类化疗药物的联合应用都有一定的调控影响[12]。
放射治疗是黑色素瘤最常用的治疗方法,常规放射治疗理论是通过肿瘤细胞重新氧合、细胞周期重新分布、照射后期细胞再增殖贯穿于放射治疗的全过程,再放射治疗的过程中部分肿瘤细胞具备一定的放疗抵抗性,继续进一步克隆增殖后产生放疗耐受细胞[13,14]。在本研究中,我们研究了c-myc中MLH1和MSH2蛋白的表达对人恶性黑色素瘤细胞放疗敏感性的研究。先构建黑色素瘤M14的放疗敏感细胞株,然后用芍药苷处理,研究芍药苷对黑色素瘤M14放疗敏感性的影响。研究结果显示了MLH1和MSH2蛋白水平降低使黑色素瘤细胞对放射治疗的敏感性更强,芍药苷处理后可以有效增强黑色素瘤细胞对放疗的敏感性。
最近有关于c-myc蛋白的研究表明,增加c-myc基因表达后可以干扰黑色素瘤细胞的转移潜能并影响免疫缺陷小鼠肿瘤转移[15]。此外,Shain等[16]学者研究显示c-myc的表达与黑色素瘤患者的临床预后有相关关系。这些预后研究表明c-myc在黑色素瘤发病中起关键作用。而c-myc蛋白与错配修复蛋白MLH1和MSH2之间有直接调控关系[17]。有研究指出MSH2和MLH1在纠正DNA错配中起核心作用,可以干扰肿瘤细胞的DNA复制过程,对基因组的完整性进行保护[18]。此外,MSH2和MLH1的表达失活也参与了遗传性非息肉性结肠肿瘤的发生过程[19]。曾有研究支持c-myc蛋白可以提高人黑色素瘤细胞的应急敏感性,包括放射治疗的敏感性,为发展新型的治疗方式提供有效干预措施[20]。
Harkness等[21]学者报道指出,MLH1和MSH2蛋白的表达上调可以影响乳腺MCF-7细胞对放疗疗效的敏感性。根据之前的研究结果,MLH1和MSH2蛋白表达可以影响细胞周期的循环,在低辐射剂量的射线刺激下,G2/S细胞周期相对缩短,阻碍细胞周期的进展,且此过程不可被逆转,加速细胞的凋亡[22]。所以调控MLH1和MSH2蛋白的表达在一定程度上可以干扰细胞的有丝分裂和细胞周期进展。本实验利用中药提取物芍药苷刺激MLH1和MSH2蛋白在细胞G2期激活DNA损伤诱导的细胞凋亡,进而影响黑色素瘤细胞对放射治疗的敏感性。之前关于大鼠骨髓细胞的其他研究系显示MLH1和MSH2表达本身没有调控作用,但是在接受放射治疗之后显示,MLH1和MSH2表达水平的降低可以增强骨髓瘤细胞对顺铂药物治疗的敏感性[23]。
本实验首先构建了黑色素瘤细胞的放疗抗性细胞株M14-RR,然后检测M14-RR细胞株中的MLH1和MSH2蛋白的表达水平,然后检测中药提取物芍药苷对黑色素瘤细胞的抑制情况及对MLH1和MSH2蛋白表达的影响。实验研究分析显示,使用适宜浓度的芍药苷处理黑色素瘤细胞后,γ-H2AX的聚集点显著增多,表明DNA损伤相对增多,芍药苷处理过后可以一定程度上产生放疗增敏作用,增加黑色素瘤细胞株的放疗敏感性。本实验又通过细胞凋亡实验检测芍药苷对黑色素瘤细胞的凋亡情况及细胞周期的影响,结果显示,芍药苷处理过后,在一定程度上可以提高黑色素瘤细胞在G1、S期的分布率,干扰细胞增殖的进程。而目前广泛的研究证实,中药提取物可以通过电离辐射和部分药物诱导激活一系列的信号分子和通路,诸如细胞周期蛋白、DNA损伤与修复、细胞凋亡、细胞代谢等等,可以导致肿瘤细胞黏附性及肿瘤血管生成减少,一定程度上抑制肿瘤的侵袭和转移,提高肿瘤细胞的放疗敏感性[24,25]。
综上所述,本研究通过研究适宜浓度的芍药苷对黑色素瘤细胞中MLH1和MSH2蛋白表达水平的影响,探讨芍药苷对黑色素瘤细胞放疗敏感性的调控情况,通过调控MLH1和MSH2蛋白的表达使其放疗后发生细胞周期的阻滞抑制细胞的增殖,具有一定的辐射增敏作用,为黑色素瘤的放疗效果预测或放疗增敏提供了新的思路。

