胡萝卜黑斑病抗性的动态遗传分析
欧承刚曹琼文赵志伟任怀富李成江*庄飞云,3*
(1中国农业科学院蔬菜花卉研究所,农业农村部园艺作物生物学与种质创制重点实验室,北京100081;2宿州市农业科学院,安徽宿州 234000;3西宁市蔬菜研究所,青海西宁 810016)
胡萝卜黑斑病(Alternaria leaf blight)是由半知菌亚门链格孢属胡萝卜链格孢菌(Alternaria dauci)引起的,是全球胡萝卜生产中危害最为普遍的病害之一,发病重者可直接导致胡萝卜减产40%~60%(Vintal et al.,1999;欧承刚 等,2009),而且可以危害其他伞形花科作物,甚至十字花科的萝卜等(Boedo et al.,2012)。据调查,黑斑病在河北、内蒙古、安徽、山东及河南等胡萝卜主要种植基地时有发生,特别是在高温多雨季节。化学防治在一定程度上能减缓黑斑病的危害,但只有通过遗传改良,提高品种抗性,才能确保胡萝卜产业的可持续发展。
国内胡萝卜黑斑病抗性资源评价鉴定、遗传研究及品种选育的相关研究较为薄弱(方智远,2017)。国外对于胡萝卜黑斑病抗性种质的研究报道较早,筛选出胡萝卜黑斑病不同抗性水平的种质,但没有免疫的种质(Strandberg et al.,1972;Pryor et al.,2002;Pawelec et al.,2006;Boedo et al.,2010)。利用半同胞家系群体估算出黑斑病抗性的狭义遗传率为40.3%,广义遗传率为45.6%~81.9%,抗性遗传存在显著的加性效应,受多基因控制(Vieira et al.,1991;Boiteux et al.,1993;Simon & Strandberg,1998)。le Clerc等(2015)检测到11个与黑斑病抗性相关的QTL,表型贡献率为4.8%~43.8%,其中9个QTL来自抗病亲本,2个QTL来自感病亲本;两个供试群体的抗性遗传率分别为75%和78%,说明其遗传特性受环境影响较小;但是受制于标记类型和数量,其QTL显著性区间范围较大(3.6~50.5 cM),难以用于抗性基因的克隆以及抗性种质的分子标记辅助选择。
植物抗病性是一个复杂性状,是宿主与病原菌互作的综合表现,受1个或多个抗病基因的控制,抗病基因的表达具有时空特异性(Neik et al.,2017;Wang et al.,2017;Li et al.,2018),所以抗病性的表现也呈动态变化过程。具有时空秩序性表达的基因,其调控机制在不同发育阶段会发生显著变化,因此深入探讨目标性状的动态变化的遗传规律,对提高育种的预见性和选择效率具有重要的理论意义和实用价值(陈幼玉 等,2005)。本试验利用加性-显性遗传模型(朱军,1997)分析不同基因型胡萝卜自交系及其杂交组合的黑斑病抗性动态遗传规律,估算控制抗性遗传的遗传效应,分析黑斑病抗性遗传研究的适宜时期,为筛选抗性材料及黑斑病抗性基因的挖掘提供依据。
1 材料与方法
1.1 试验材料
选取中国农业科学院蔬菜花卉研究所多代纯化育成的18份橘色胡萝卜自交系和1份地方品种为试材,分别为KNP11(P1,长圆柱形)、KN001(P2,圆柱形)、KN015(P3,圆柱形)、KN024(P4,圆柱形)、KN035(P5,圆柱形)、N078(P6,圆柱形)、KN094(P7,圆柱形)、KN104(P8,圆柱形)、N111(P9,圆柱形)、KN120(P10,圆柱形)、KN122(P11,圆柱形)、KN133(P12,长圆柱形)、KN144(P13,长圆柱形)、K162(P14,短圆锥形)、K169(P15,长圆锥形)、N217(P16,长圆柱形)、N220(P17,长圆柱形)、N243(P18,细短圆柱形)和潜山胡萝卜(P19,长圆柱形)。其中P6、P9、P16~P19为南特类型,P14和P15为黑田类型,其余为黑田与南特杂合型。
2016年7月中下旬在中国农业科学院北京昌平综合试验基地露地播种,11月中旬采收肉质根贮藏于地窖。2017年3月进行种根定植,5月初进入始花期,采用人工去雄授粉和不完全双列杂 交的方法配制63个杂交组合F1(表1)。2017年8月初将上述亲本材料及组合种子播种于安徽省萧县胡萝卜多年连作基地,采用完全随机区组设计,2次重复,株距5 cm,行距20 cm,每小区种植50~60株,常规管理。
1.2 调查方法
采用田间自然发病,以中抗品种Bolero(Corbaz &Perko,1995;le Clerc et al.,2009)为参照,分别于2017年10月13日(发病早期)、11月2日(发病中期)和11月22日(发病晚期,肉质根收获),根据小区的发病程度调查亲本及F1的病级指数,调查方法及分级标准参照曹琼文等(2018)的方法。
1.3 统计分析
参照朱军(1997)提出的基于混合线性模型的加性-显性遗传模型,利用QGAStation 2.0分析软件(Chen et al.,2012)进行数据分析。估算病级指数的各项非条件方差分量(加性方差VA、显性方差VD和表型方差Vp)和遗传率,采用Jackknife数值抽样方法,估算各项遗传参数的标准误,并检验各遗传参数的显著性;参照Zhu(1995)的条件分析方法,估算病级指数在生育期t-1阶段到t阶段的条件方差分量〔VA(t|t-1)和VD(t|t-1)〕。采用SPSS v15.0软件进行亲本和F1各时期病级指数的方差分析及相关性分析。
2 结果与分析
2.1 亲本及F1的黑斑病病级指数分布
图1显示随着发病时期的延长,亲本和F1的平均病级指数显著增加,变异幅度也增大。早期亲本和F1的平均病级指数分别为0.78和0.48,中期的平均病级指数分别为1.93和1.37,晚期的平均病级指数分别达到2.79和1.93。各亲本和组合在3个时期分别表现不同程度的抗病性,其中早期P10、早期和中期P19的病级指数最低,为0;晚期P2的病级指数最高,为4.25;早期有11个F1的病级指数为0,晚期有2个F1的病级指数最高,为4.00(表1)。对照品种Bolero在中期和晚期的病级指数(1.50和3.25)与亲本病级指数的中位数一致(图1),与前人研究结果相似(le Clerc et al.,2009)。亲本的病级指数在3个时期之间呈极显著正相关,早期与中期、中期与晚期之间的相关性系数r分别是0.781和0.879。F1的病级指数在3个时期之间也呈极显著正相关,早期与中期、中期与晚期之间的相关性系数r分别是0.816和0.895。
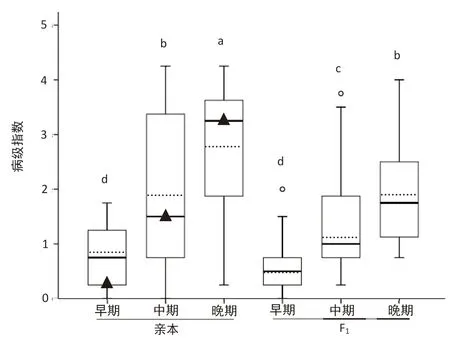
图1 亲本、F1以及对照Bolero的病级指数分布

表1 供试亲本及F1的病级指数
2.2 黑斑病病级指数的遗传效应分析
非条件遗传方差分析结果表明,黑斑病病级指数的遗传效应以加性方差VA为主(表2),发病中期和晚期均达到显著水平,分别为0.656和0.551,分别占表型方差VP的57.4%和55.2%。显性方差VD在晚期达到显著水平,为0.311,占表型方差VP的31.2%。
条件遗传方差可以显示不同发病时期控制黑斑病病级指数的净遗传效应。由表2可知,中期的加性方差〔VA(t|t-1)〕达到显著水平,占表型方差的41.2%,而晚期的显性方差〔VD(t|t-1)〕达到极显著水平,占表型方差的56.7%。
2.3 亲本黑斑病病级指数的加性效应分析
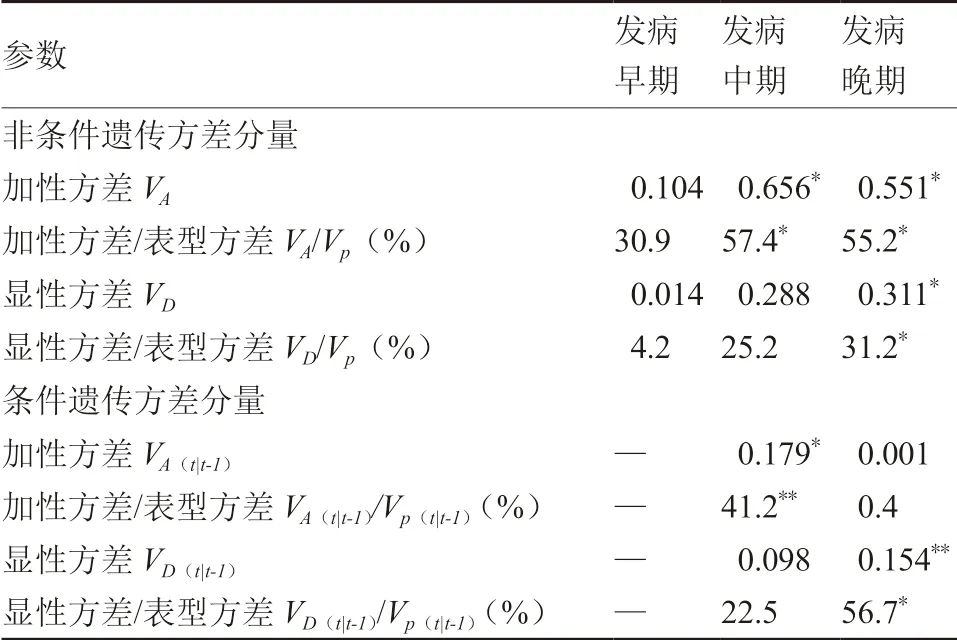
表2 不同发病时期黑斑病病级指数的方差分量估计值
各亲本在不同发病时期表现的加性效应不同(图2),早期和中期均有9个亲本表现为正向效应,10个为负向效应,其中P1、P14和P16在早期的加性效应达到显著水平,而P1、P2、P12和P15在中期达到显著水平。发病晚期有10个亲本表现为正向效应,9个为负向效应,其中P4、P6、P17和P18的加性效应达到显著水平。
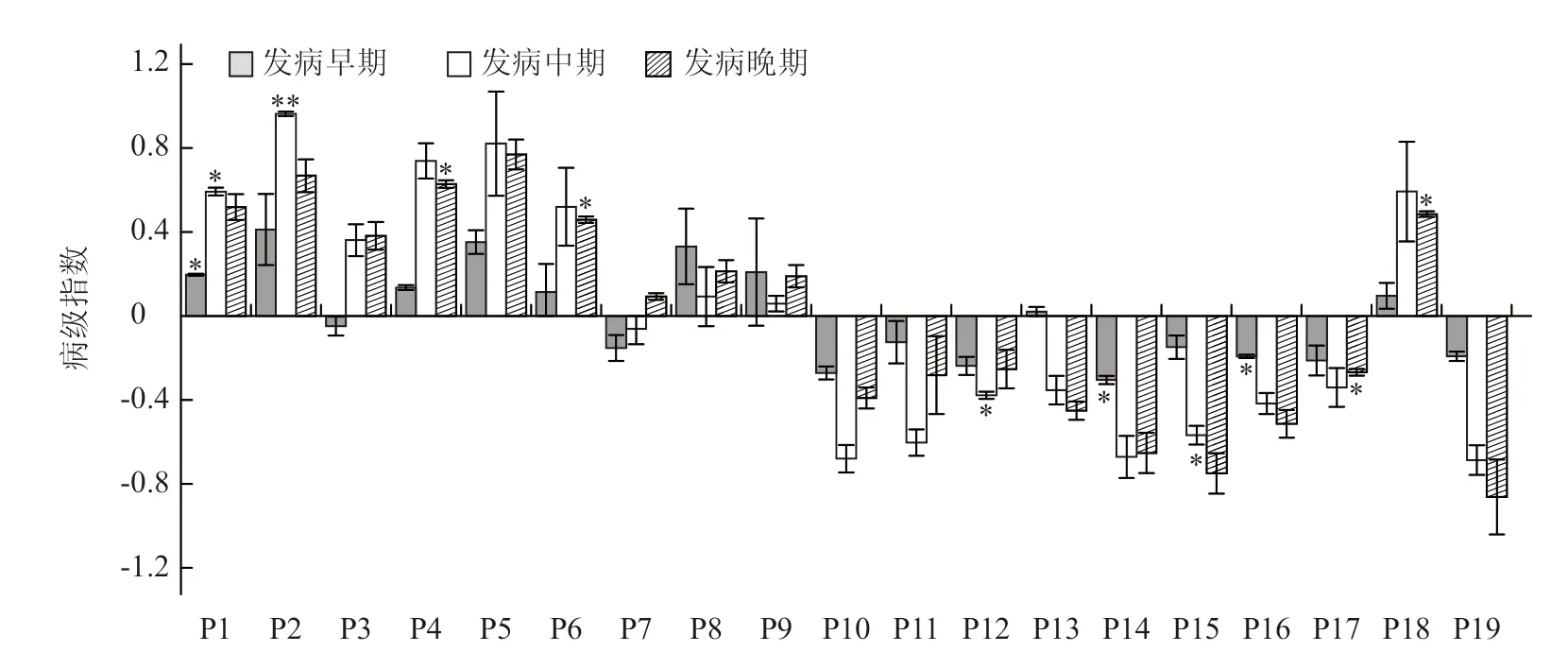
图2 亲本黑斑病病级指数的加性效应
2.4 黑斑病病级指数的遗传率
黑斑病病级指数的狭义遗传率在中期和晚期达到显著水平(表3),分别为0.574和0.552。广义遗传率仅在中期达到显著水平,为0.827,说明遗传变异在后代表型变异中占主要成分。

表3 黑斑病病级指数的遗传率
3 结论与讨论
抗病遗传研究是挖掘抗性基因、开展抗病育种的重要基础(方智 ,2017)。现有研究表明胡萝卜黑斑病抗性为数量性状,受多基因调控,尚未获得相关抗性基因Vieira et al.,1991;Boiteux et al.,1993;Simon & Strandberg,1998;le Clerc et al.,2009,2015)。本试验基于混合线性模型的加性-显性遗传模型 朱军,1997),以非等试验设计获得的非平衡数 (左清凡 等,2000),分析不同发病时期胡萝卜黑斑病病级指数的非条件和条件遗传效应。非条件分析结果显示黑斑病病级指数的加性遗传效应在发病中期和晚期达到显著水平,最高占表型遗传的57.4%(表2),说明后代的抗性水平主要受亲本的加性效应影响,通过亲本的选择有助于提高后代的抗性;显著的显性遗传效应说明在晚期抗性遗传存在杂种优势效应,利用杂种优势可以提高杂交后代的抗性水平,这与亲本和F1的病级指数分布一致(图1);由于加性效应高于显性效应,也表明选择抗性亲本的效果优于杂种优势的利用。
非条件遗传分析方法反映的是全部遗传效应的累加效应,而条件遗传分析方法是对特定时期(t|t-1)抗病基因表达的净遗传效应进行分析,可以有效排除前期已表达基因所产生的遗传效应,获得该时期的动态遗传表达规律,分析不同时期遗传表达效应的异同(Zhu,1995;石春海 等,2002;Xu et al.,2011)。条件遗传分析显示,本试验在发病中期加性效应显著增加〔VA(t|t-1)= 0.179,表2〕,说明黑斑病抗性基因的表达存在时序性,发病中期是基因表达最活跃的时期,所以导致累积的非条件加性效应值在中期(VA= 0.656)最高,晚期反而下降,因此,该时期也是抗病基因挖掘、基因表达规律分析等研究的适宜时期;显性效应在晚期显著增加〔VD(t|t-1)= 0.154〕,导致累积的非条件显性效应值在晚期(VD= 0.311)最高,说明这个时期黑斑病抗性的杂种优势效应最显著。
显著的狭义遗传率和广义遗传率最高为0.574和0.827,这与Vieira等(1991)和Boiteux等(1993)的结果(40.3%~81.9%)相近,说明通过遗传改良的方法可以显著提高后代抗性(le Clerc et al.,2009)。本试验有5个亲本(P1、P2、P4、P6和P18)分别在不同发病时期表现为显著的正向加性效应(图2),说明这5个亲本的选择、纯化会提高后代病级指数,即降低后代抗病性;有5个亲本(P12、P14、P15、P16、P17)分别在不同发病时期表现为显著的负向加性效应,说明这5个亲本的选择、纯化可以减小后代病级指数,即增加后代抗病性。P1的遗传效应表现较为稳定,在早期和中期都具有显著的正向加性效应;P3、P7和P13的遗传效应则不稳定,早期的加性效应为负值(或正值),到中、晚期为正值(或负值)。供试亲本中,有11个黑田与南特杂合型亲本,其中有3个亲本(P1、P2和P4)显著降低后代抗性,仅有1个亲本(P12)显著增加后代抗性;有6个南特类型亲本,其中2个亲本(P6和P18)显著降低后代抗性,2个亲本(P16和P17)显著增加后代抗性;2个黑田类型亲本(P14和P15)均显著增加后代抗性,但根据笔者在我国主要胡萝卜种植区域多年、多点调查发现,黑田类型品种的黑斑病抗性水平也存在差异。在Pawelec等(2006)和le Clerc等(2009)的研究中也显示高感品种Presto和中抗品种Bolero均为南特类型。由此说明,亲本类型与黑斑病抗性并不具有一致性,但通过遗传分析可以从不同类型的材料中筛选出能够提高后代抗性的亲本。此外,亲本间遗传效应的差异以及亲本自身不同时期遗传效应的变异,表明不同亲本中抗病基因的表达及其遗传调控模式可能不尽相同。上述研究结果为抗病种质的筛选、遗传机制的研究以及抗病基因的遗传定位分析提供了理论依据。

