牛蒡子提取物长期毒性试验研究
何斌,张海静,杨文海,邵志勇,吴利军,陈夏冰,陈洁,金尔光,操继跃
(1. 武汉市农业科学院畜牧兽医研究所,武汉 430208;2. 华中农业大学,武汉 430070;3.天津市宝坻区畜牧水产业发展服务中心,天津 301800)
牛蒡子是一种常用中药,具有疏散风热、宣肺透疹功效,临床上用于治疗外感风热、咳嗽气喘、咽喉肿痛等症[1]。牛蒡苷元为牛蒡子和牛蒡子提取物的直接有效成分[2],具有抗炎、抗病毒、抗肿瘤、抗糖尿病等众多药理作用[3-4],具有良好的研发和应用前景;根据兽药长期毒性试验指导原则的方法要求[5],研究了牛蒡子水提物在Wister大鼠体内经口给药后的30 d长期毒性,确定牛蒡子提取物对大鼠的毒性作用性质和靶器官,评价其亚慢性摄入的危险性,为临床试验剂量设计及观察指标的选择提供参考,为新兽药的研发和临床用药提供理论资料,为中兽药现代化进行有意义的探索。
1 材 料
1.1 仪器设备 注射器、烧杯、小鼠灌胃针;小鼠独立送风(IVC)系统;手术剪、镊子,JY2002型电子天平、岛津AUY2002型分析天平,日立7020型全自动生化分析仪,迈瑞BC-2600全自动血液分析仪。
1.2 药品与试剂 牛蒡子提取物粉:含牛蒡苷元3.03%,由实验室自制,使用时,用0.5%羧甲基纤维素钠(CMC-Na)溶液配制成混悬液;
羧甲基纤维素钠:由国药集团化学试剂有限公司生产,使用时,用蒸馏水配制成0.5%的水溶液,放置于4 ℃冰箱内,限7 d内使用;
甲醛:由国药集团化学试剂有限公司生产,使用时用蒸馏水配制成10%的福尔马林溶液,用于固定组织。
对照品的配制:0.5%羧甲基纤维素钠,准确称取0.5 g羧甲基纤维素钠,溶解于100 mL蒸馏水中,作为对照品,保存于4 ℃冰箱内,限7 d内使用。
供试品的配制:准确称取牛蒡子粉3.75、7.5、15.0 g,溶解于50 mL的0.5%羧甲基纤维素钠溶液中,配成均匀混悬液,浓度分别为0.075、0.15、0.3 g/mL,对应的剂量分别为1.5、3、6 g/kg.bw,现配现用,灌胃前充分摇匀。
1.3 试验动物 SPF级Wistar大鼠,80只,雌雄各半,4~6周龄,体重80~100 g,差异不超过平均体重的20%。大鼠由华中科技大学实验动物中心提供,实验动物生产许可证号:SCXK(鄂)2010-0009。大鼠购买后在实验室动物房内预饲养一周,饲喂不含任何药物的全价营养颗粒饲料。实验动物使用许可证号:SYXK(鄂)2014-0081。实验动物的饲养与管理严格按照《实验动物饲养与使用原则》的要求进行,整个试验过程中保持室内清洁卫生,空气流通。
2 方 法
2.1 动物分组 将80只Wistar大鼠随机分为4组,即空白对照组和牛蒡子粉低、中、高三个剂量组,每组20只,雌雄各半。大鼠每笼2只,雌雄分开,饲养在不锈钢笼中,自由饮水和采食。室温控制在20~25 ℃,相对湿度40%~70%,照明采用人工昼夜,12 h照明(早7点~晚7点),12 h黑暗(晚7点~早7点),每日更换新鲜自来水,每周更换2次垫料。
2.2 剂量设计 根据《兽药研究技术指导原则》,对于求不出LD50且靶动物可能摄入量较大,剂量设计无法达到靶动物可能摄入量100倍的药物,高剂量组可以按最大耐受量设计。基于此,由于牛蒡子粉最大溶解浓度及大鼠灌胃体积的限制,将高剂量组设计为6 g/kg.bw(牛蒡子粉的最大可溶解浓度0.3 g/mL,大鼠灌胃体积2 mL/100g.bw)。根据低剂量组应高于药效学有效剂量,结合《中华人民共和国兽药典》和药效学资料,设计低剂量组剂量为1.5 g/kg.bw。在高、低剂量组之间按剂量比设计中剂量组剂量为3 g/kg.bw。
2.3 给药方法及时间 灌胃给药,各剂量组采取等体积不等浓度的给药方式,给药过程中始终进行搅拌以保证药液均匀。对照组给予等体积的0.5%羧甲基纤维素钠。每周给药7 d,每天给药1次,每周根据体重变化调整1次给药量,给药期限为30 d。
2.4 观察指标
2.4.1 一般临床症状 每天观察各组大鼠的一般生理指标,主要包括外观体征和行为活动,如精神状态、采食量和饮水量、体重变化、粪便颜色与性状、腺体分泌、呼吸状况、中毒症状和死亡情况等。如果发现异常,如过度兴奋、躁动、惊跳、肌肉麻痹或震颤、精神萎靡、蜷缩不动、步态异常、皮毛污秽或死亡等情况,均应进行详细记录并处理。若在试验过程中发现濒死或死亡大鼠,详细记录大鼠死亡前的异常表现及死亡时间,并分析死亡原因是否为药物引起[6-7]。
2.4.2 体重和进食量 每周日记录大鼠体重,并根据体重调整大鼠给药量,每周一开始按调整后的剂量给药。
每周日称量动物的给料量和剩余量,计算动物的进食量及饲料利用率。在实验过程中,除每周日外,其余时间若发现饲料不够,可随时添加饲料,并如实记录。
2.4.3 血液学检查 试验结束时进行血液学检查。采血前对各剂量组大鼠禁食16 h,3%戊巴比妥钠溶液(80 mg/kg.bw)麻醉,腹主动脉采血2 mL。采集的血样于血细胞分析仪上检测红细胞(RBC)、白细胞(WBC)、血红蛋白(HGB)、血小板(PLT)、淋巴细胞(LY)、单核细胞(MO)等血液学指标[8]。
2.4.4 血液生化检查 试验结束时测定血液生化指标。3%戊巴比妥钠溶液(80 mg/kg.bw)麻醉,腹主动脉采血2 mL,将采集血液呈45~60度角于4 ℃冰箱放置1 h,3000 r/min离心5 min分离血清,于生化自动分析仪上测定血清中的谷丙转氨酶(ALT)、谷草转氨酶(AST)、血清白蛋白(ALB)、总蛋白(TP)、尿素氮(BUN)、肌酐(Cr)、血糖(Glu)、总胆固醇(TCH)和甘油三酯(TG)等指标[9]。
2.4.5 脏器重量和脏/体比值 采血后处死动物,解剖,肉眼观察每只动物心、肝、脾、肺、肾、胃肠等胸腹腔内器官有无颜色改变以及渗出、水肿、增生、萎缩等病变,做好记录。用眼科镊和眼科剪分离心、肝、脾、肺、肾、胃肠、睾丸(雄性)子宫(雌性)、卵巢(雌性)等脏器,清除干净各脏器周围结缔组织和脂肪组织,用电子天平逐一称重(胃肠除外),计算脏/体比值,再用10%福尔马林溶液立即固定[10]。
2.4.6 病理组织学检查 病理切片检查:若大体解剖肉眼未见异常,选取高剂量组和阴性对照组作病理切片。选取高剂量组和阴性对照组各20只动物(雌雄各半)的部分脏器(肝脏 、脾脏、肾脏、胃肠、卵巢和睾丸),取材后,常规脱水、透明、浸蜡、制片及HE染色,在光学显微镜下由低倍至高倍观察各组织的形态学变化,并详细记录描述所观察到的形态学变化[11]。
病理结果评价标准:与阴性对照组比较,以镜下形态学变化进行描述判断。
病理组织学观察:依各脏器形态学结构各异,但主要是以细胞变性作为观察指标,并根据病理改变程度“-”、“+”“++”、“+++”量化,本试验所获数据采用非参数统计法(Nonparametric statistic)进行病理改变的评价。细胞变性及细胞坏死评价分级如表1、表2所示。

表1 细胞变性评价表Tab 1 Evaluation table of cell degeneration

表2 细胞坏死评价表Tab 2 Evaluation sheet for cell necrosis
2.5 统计分析 实验数据采用Microsoft Excel软件建立数据库,对大鼠的体重、采食量、各项血液学指标及脏/体比值进行统计处理,并列表说明。各项数据以“平均数±标准差”表示,计量资料采用方差检验,计数资料采用非参数检验,并按动物性别分别统计。
3 结果与分析
3.1 一般观察 试验期间每天观察大鼠的行为活动,各剂量组大鼠均无死亡现象,精神状态良好,活动正常,未出现过度兴奋、躁动、精神萎靡、步态异常或腺体分泌异常等现象,被毛整洁有光泽,无脱毛现象,粪便颜色、硬度均正常。
3.2 对大鼠体重、进食量及饲料利用率的影响 在试验观察期内,高剂量组的每周体重及进食量与中、低剂量组及空白对照组相差异不显著(P>0.05)。各剂量组雌鼠与雄鼠饲料利用率随着时间的增长而逐渐降低,开始阶段雌鼠与雄鼠体重相差不大,饲料利用率比较接近,后来由于雄鼠进食量大、体重增长快,饲料利用率高于雌鼠,但雌雄各剂量组大鼠饲料利用率与空白对照组相比差异不显著(P>0.05),见表3、表 4、表 5。
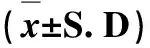
表3 牛蒡子粉对大鼠体重的影响Tab 3 The impact of arctii fructus powder on body weight of
各剂量组与空白对照组比较,P>0.05
each dose group compared with the control group,P>0.05
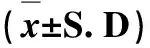
表4 牛蒡子粉对大鼠进食量的影响Tab 4 The impact of arctii fructus powder on intake of
各剂量组与空白对照组比较,P>0.05
each dose group compared with the control group,P>0.05
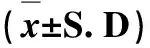
表5 牛蒡子粉对大鼠饲料利用率的影响Tab 5 The impact of arctii fructus powder on food utilization of
各剂量组与空白对照组比较,P>0.05
each dose group compared with the control group,P>0.05
3.3 对大鼠增重、总进食量、总饲料利用率的影响
在试验观察期内,中、高剂量组大鼠体重总增重与总进食量略低于低剂量组与空白对照组,但差异不显著(P>0.05)。雌、雄大鼠各剂量组总饲料利用率与空白对照组比较差异不显著(P>0.05),见表6。
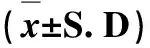
表6 牛蒡子粉对大鼠增重与总饲料利用率的影响Tab 6 The impact of arctii fructus powder on weight gain and feed utilization rate of
各剂量组与空白对照组比较,P>0.05
each dose group compared with the control group,P>0.05
3.4 血液学检查结果 在试验结束时对各剂量组大鼠进行血液学检查,检查结果表明雌、雄大鼠各剂量组血常规、血生化各项指标与空白对照组相比差异均不显著(P>0.05),且均在正常值范围之内,见表7、表8、表9。
3.5 对大鼠脏器重量与脏/体比值的影响 试验结束时对大鼠各主要脏器进行称重并计算脏/体比值,结果表明雌、雄大鼠高、中、低剂量组与空白对照组比较脏器重量、脏/体比值差异均不显著(P>0.05),且均在正常值范围之内,见表10。
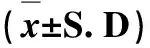
表7 牛蒡子粉对大鼠血常规检查结果的影响Tab 7 The impact of arctii fructus powder on blood routine examination results of
各剂量组与空白对照组比较,P>0.05
each dose group compared with the control group,P>0.05
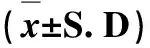
表8 牛蒡子粉对大鼠白细胞分类的影响Tab 8 The impact of arctii fructus powder on classification of leukocytes in
各剂量组与空白对照组比较,P>0.05
each dose group compared with the control group,P>0.05
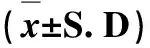
表9 牛蒡子粉对大鼠血液生化的影响Tab 9 The impact of arctii fructus powder on blood biochemistry of
各剂量组与空白对照组比较,P>0.05
each dose group compared with the control group,P>0.05
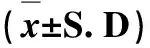
续表9 牛蒡子粉对大鼠血液生化的影响Tab 9 The impact of arctii fructus powder on blood biochemistry of
各剂量组与空白对照组比较,P>0.05
each dose group compared with the control group,P>0.05
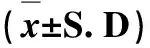
表10 牛蒡子粉对大鼠脏器重量和脏/体比值的影响Tab 10 The impact of arctii fructus powder on organ weight and organ/body ratio of
各剂量组与空白对照组比较,P>0.05
each dose group compared with the control group,P>0.05
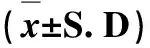
续表10 牛蒡子粉对大鼠脏器重量和脏/体比值的影响Tab 10 The impact of arctii fructus powder on organ weight and organ/body ratio of
各剂量组与空白对照组比较,P>0.05
each dose group compared with the control group,P>0.05
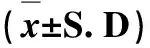
续表10 牛蒡子粉对大鼠脏器重量和脏/体比值的影响Tab 10 The impact of arctii fructus powder on organ weight and organ/body ratio of rats
各剂量组与空白对照组比较,P>0.05
each dose group compared with the control group,P>0.05
3.6 病理组织检查 试验结束时对大鼠进行大体解剖,肉眼观察各剂量组及空白对照组大鼠的心、肝、脾、肺、肾及胃肠等胸腹腔主要脏器有无病变,发现各脏器的大小、形态及外观颜色均正常,无充血、淤血现象,脏器表面无出血点及坏死灶,亦无明显萎缩、增生、渗出、水肿及溃烂等病变(图1)。
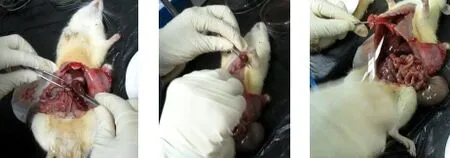
图1 部分大体解剖图片Fig 1 Partial gross anatomy
大体解剖未见肉眼可见病变,故对高剂量组及对照组大鼠做组织切片进行镜下观察,每组20只,雌雄各半。若高剂量组组织切片可见明显病变,再对中、低剂量组进行组织切片观察。
镜下所见:见表11-表14,图2-图5。
组织切片观察没有发现明显中毒性病理变化。部分大鼠肝脏切片可见肝细胞轻微脂肪变性、点状坏死及肝窦内炎性细胞浸润,个别肝脏出现肝细胞凝固性坏死;部分大鼠存在肾小球球系膜增生,间质内少量炎性细胞浸润;个别大鼠脾脏存在炎性细胞浸润;胃肠、卵巢、睾丸等均未出现病变。
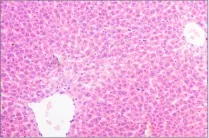
图2 (♂高7): 肝细胞轻度脂肪变性Fig 2 (♂High 7)liver cells have slight steatosis
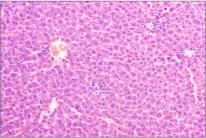
图3 (♀高6):肝细胞点状坏死,炎性细胞浸润Fig 3 (♂High 6)Note the spotty necrosis of hepatocytes with inflammatory cell infiltration

图4 (♀高3):肝细胞脂肪变性,肝窦扩张Fig 4 (♂High 3)Hepatocyte steatosis and hepatic sinus dilation

图5 (♀高6):肾小球球系膜增生,少量炎性细胞浸润Fig 5 (♀High 6)Glomerular mesangial hyperplasia with a small amount of inflammatory cell infiltration
4 讨论与结论
4.1 剂量设计 本试验采用SPF级Wister大鼠进行牛蒡子粉经口给药30 d长期毒性研究,以2 mL/100 g.bw等体积不等浓度灌胃给药,每天1次,连续30 d。由于药物急性毒性试验无法求出LD50,以及药物最大溶解度的限制,高剂量组无法达到靶动物可能摄入量的100倍,根据《兽药研究技术指导原则》,高剂量组以最大耐受量设计,故将高剂量组设计为6 g/kg.bw(牛蒡子粉的最大浓度0.3 g/mL,大鼠灌胃体积2 mL/100g.bw),低剂量组应高于药效学有效剂量,结合兽药典及药效学资料,将低剂量组灌胃剂量设计为1.5 g/kg.bw,在高、低剂量组之间按剂量比设计中剂量组为3 g/kg.bw(兽药研究技术指导原则汇编2012)。

表11 牛蒡子粉对大鼠肝脏病理组织学检查结果(n=10)Tab 11 The impact of arctii fructus powder on liver histopathological examination results
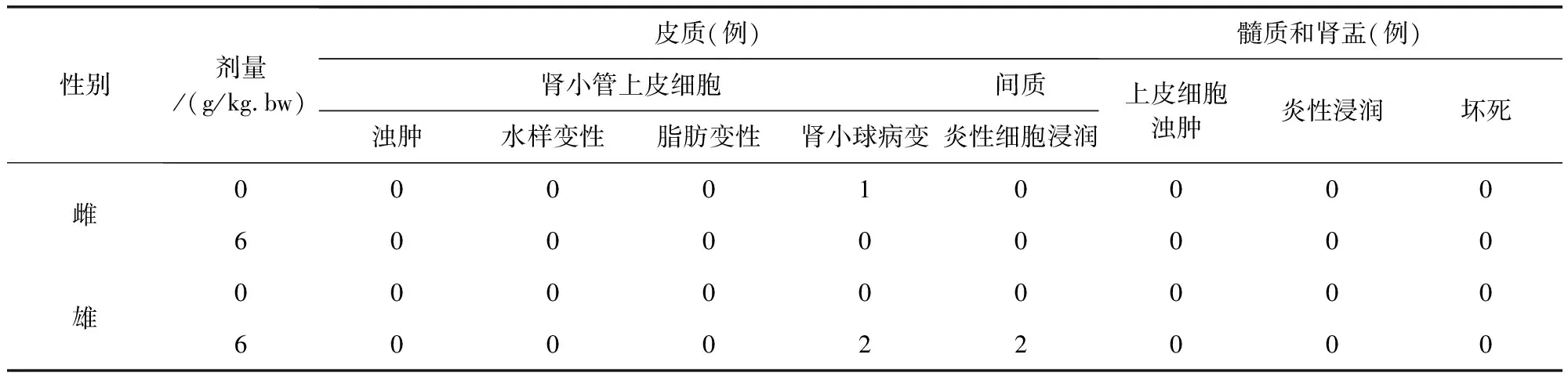
表12 牛蒡子粉对大鼠肾脏病理组织学检查结果(n=10)Tab 12 The impact of arctii fructus powder on kidney histopathological examination results
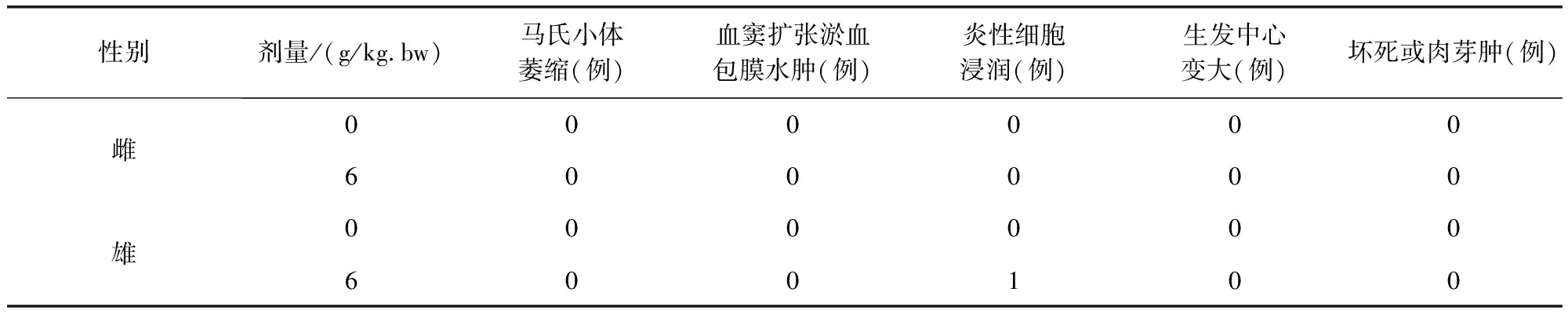
表13 牛蒡子粉对大鼠脾脏病理组织学检查结果(n=10)Tab 13 The impact of arctii fructus powder on spleen histopathological examination results
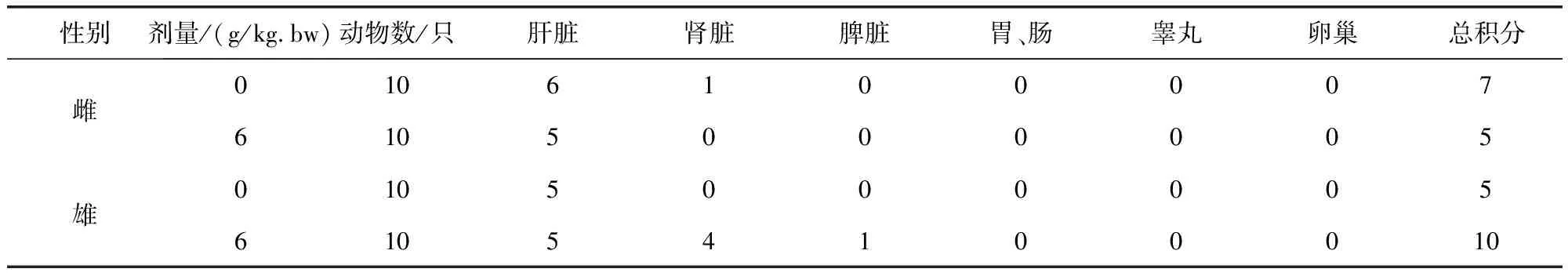
表14 牛蒡子粉对大鼠各脏器病理组织学检查积分表Tab 14 The impact of arctii fructus powder on integral histopathological examination results
4.2 对体重和进食量的影响 试验期间各剂量组大鼠的采食、饮水、活动均正常,未出现异常症状和死亡现象,进食量和体重均正常增长,雄鼠体重增长速度明显高于雌鼠,符合大鼠生长规律。中、高剂量组大鼠体重总增重与总进食量略低于低剂量组与空白对照组,可能是由于药物浓度过高,制成的混悬液过于黏稠,不容易消化,给胃造成机械负担导致吸收障碍,从而影响大鼠进食与增重,但与对照组相比差异不显著(P>0.05)。结合体重与进食量计算出大鼠饲料利用率,给药组与对照组相比差异也不显著(P>0.05),说明牛蒡子粉对消化系统影响不大,不会对大鼠的正常生长产生影响。
4.3 对血常规的影响 血常规检验有助于在早期对全身性疾病进行诊断,主要包括红细胞、血红蛋白、网织红细胞、白细胞、血小板及白细胞分类等项目。在研究牛蒡子粉的毒性时对血常规进行检测有助于对药物进行毒理学评价[12]。在本试验对大鼠进行血常规的检测结果中,给药组与空白组各项指标值相比差异均不显著(P>0.05),且数值均在大鼠正常生理值范围内,说明牛蒡子粉对大鼠血液学指标无影响。
4.4 对血液生化指标的影响 本试验主要对大鼠肝功能、肾功能、血糖、血脂等指标进行了检测。肝功能检测的指标包括血浆总蛋白(TP)、白蛋白(ALB)、白蛋白/球蛋白(ALB/GIO)、丙氨酸氨基转移酶(ALT)与天冬氨酸氨基转移酶(AST)。血浆中白蛋白和大部分球蛋白是由肝脏合成的,二者的浓度变化可以反映肝功能状况[13]。动物肝脏含有多种酶,当肝脏受损时,会导致血清中酶含量发生改变,临床中通过对血清中ALT和AST的检测判断肝脏功能[14]。肾功能检测的指标包括肌酐(Cr)和尿素氮(BUN)[15]。在本试验对大鼠的肝、肾功能及血糖血脂的检测结果中,给药组与空白组相比各项指标均无显著性差异(P>0.05),且均在正常生理值范围内,说明牛蒡子粉对大鼠的血液生化指标无影响。
4.5 对主要脏器的影响 本试验对大鼠进行大体解剖,仔细观察给药组与对照组大鼠主要脏器的大小、颜色、质地,未发现萎缩、肿胀、充血、淤血、坏死等异常变化,对心脏、肝脏、脾脏、肺脏、肾脏、子宫、睾丸、卵巢等进行称重,并计算脏/体比值,给药组与空白组比较无显著性差异,说明牛蒡子粉对大鼠脏器大体方面无影响。大体解剖未见肉眼可见病变,对高剂量组与空白组部分脏器进行病理组织学检查,分别对肝、肾、脾、胃肠、睾丸、卵巢等脏器进行HE染色及镜下观察,发现高剂量组与空白组均有个别大鼠存在部分脏器的轻微病变,但零星分布无规律性,两组比较差异不显著,说明牛蒡子粉对大鼠脏器无病理损害作用。
4.6 结论 牛蒡子粉30 d长期毒性试验结果表明:对SPF级Wister大鼠以1.5、3及6 g/kg.bw的剂量灌胃给予牛蒡子粉,连续给药30 d,各剂量组均无明显中毒反应及死亡情况;实验组体增重、进食量及饲料利用率与空白组相比差异不显著(P>0.05);实验组血常规及血液生化指标、主要脏器脏/体比值与空白组比较差异均不显著(P>0.05);对高剂量组与空白对照组进行组织病理学检查,两组均有个别大鼠部分脏器出现轻微病变,且零星散在分布,无规律性,各组之间差异不显著,故认为与药物无关。综上所述,未发现牛蒡子粉有明显毒性作用。

