石柱参人参皂苷合成酶基因的克隆及表达量测定
王丹丹,冷春玲
(辽东学院 农学院,辽宁丹东 118003)
石柱参植物分类学上隶属于五加科(Araliaceae)人参属(Panax)植物人参(PanaxginsengC.A.Mey.),以其干燥的根或根茎入药;原产于辽宁省丹东市宽甸县振江乡石柱子村,以其芦长、体灵、皮老纹深、须长须清、须有珍珠疙瘩、药效高及形状类似野山参等优点而在国际中药市场享有较高名誉[1]。
人参皂苷是石柱参的主要药效成分,属于三萜皂苷[2-6],具有抗衰老、抗癌、抗炎症、抗疲劳、治疗心肌损伤、降血糖等作用。人参皂苷质量分数和组成是评价人参药材质量的重要指标,但其在石柱参中质量分数较低,且人工合成尚未实现[7-11]。近年来,生物学专家对人参皂苷的体内生物合成途径进行了大量研究,其中人参皂苷代谢途径的分子机制研究进展卓著,但对道地产区石柱参人参皂苷合成的分子机制研究还较少[12]。为探究石柱参人参皂苷质量分数低的原因,本研究分别以5a生石柱参根、茎、叶组织为材料,测定石柱参6种人参皂苷(Rb1、Rb2、Rc、Re 、Rg1、Rg2)的质量分数,及整个生长时期中人参皂苷合成酶基因鲨烯合成酶(SS)、细胞色素P450酶—CYP82D47、CYP716A42的表达量,并对人参皂苷合成酶基因(CYP82D47)进行克隆,测序及生物信息学分析,为进一步分析人参皂苷合成酶基因表达量的动态变化与人参皂苷质量分数的关系,明确石柱参人参皂苷生物合成的分子生理机制,以期为石柱参栽培和人参药材质量的提高奠定理论基础。
1 材料与方法
1.1 试验材料
分别以5 a生人参(对照组)、石柱参的根、茎、叶组织为试验材料,2种试验材料均于2017年5-9月采于丹东市宽甸满族自治县振江镇大青村,每个生长时期均采集固定田垄的人参、石柱参各15株,采集后筛选出无病虫害、个体差异小且生长势良好的5株样本进行后续试验(表1),样本液氮冷冻于-80 ℃,待用。
1.2 试验方法
1.2.1 人参皂苷质量分数测定 称取0.5 g 已干燥至恒质量的各样品粉末,过24目筛,加入250 mL甲醇,于55 ℃水浴恒温回流提取1 h,过滤提取液,滤渣重复提取3次,用适量体积溶液洗涤残渣,合并滤液,60 ℃减压浓缩,定容至5 mL,用0.45 μm滤膜过滤,取滤液为供试品;采用Agilent 1200 Series高效液相色谱仪对人参、石柱参不同部位的6种人参皂苷(Rb1、Rb2、Rc、Re、Rg1、Rg2)的质量分数进行测定[13],色谱柱为德国Agilent Eclipse XDB-C18(4.6 mm×250 mm, 5 μm);乙腈-水溶液为流动相,梯度洗脱,流速1.5 mL/min;A为水,B为乙腈;梯度洗脱程序: 0~16 min,56%B;16~20 min,56%→100% B; 20~40 min,100% B;40 min~47 min,56% B; 47~60 min,56% B;各组分均在70 min内出完,柱温 35 ℃,检测波长203 nm;各样本人参皂苷质量分数的测定重复4次,取平均值。
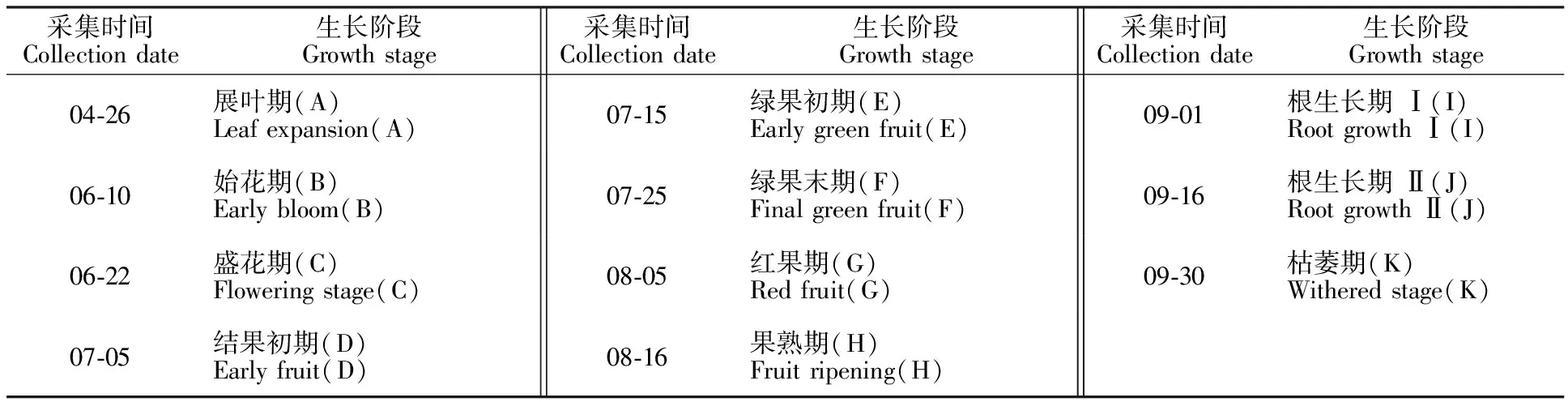
表1 石柱参样品采集信息Table 1 Collection information of Shizhu ginseng samples
注:为方便后续试验记录,生长时期顺序依次以字母A~K记录。
Note:Each growth period was recorded as the alphabet A-K,just in order to facilitate follow-up test records.
1.2.2 总RNA提取 分别取人参与石柱参根、茎、叶组织于液氮中单独研磨,按照Takara公司总RNA提取试剂盒操作步骤提取总RNA,并检测RNA完整性。并采用M-MuLV第1链cDNA合成试剂盒,以总RNA为模板,Oligo-dT为引物,逆转录合成cDNA[14-18],-20 ℃保存, 备用。
1.2.3 引物设计 根据GenBank上已报道的鲨烯合成酶(SS)、人参细胞色素P450的CYP82D47、CYP716A42基因序列为参考,采用DANMAN、ClustalW、Blast等软件找出高度保守区设计特异性克隆引物和荧光定量PCR特异性引物(表2)。
1.2.4 人参皂苷合成酶基因表达量测定 以5 a生石柱参11个生长时期(表1,A~K时期)根、茎、叶组织的cDNA为模板,分别对石柱参SS、细胞色素酶P450的CYP82D47、CYP716A42基因进行qPCR扩增,每个反应体系重复3次。qPCR在ABI Biosystems的荧光定量PCR仪7500上完成的,RT-PCR体系用2xSG Fast QPCR Master Mix试剂盒,采用PrimerExpress软件设计实时荧光定量PCR引物,同时以人参亲环蛋白基因CCYP为qPCR内参基因(表2)。不同生长期的表达量以4月26日石柱参根组织表达量为对照[19-20]。qPCR扩增体系为20 μL:SYBR Premix ExTaq10 μL,Forward Primer 0.5 μL,Reverse Primer 0.5 μL,ROX Reference Dye 0.5 μL,cDNA模板 2 μL,ddH2O 6.5 μL;荧光定量qPCR反应程序:94 ℃预变性1 min; 94 ℃变性5 s, 55 ℃退火30 s,72 ℃延伸30 s,40个循环。

表2 引物信息Table 2 The information of primers
1.2.5 重复性试验 从“1.2.4”中5 a生石柱参不同生长时期根、茎、叶组织的相同部位分别取3份样品,分别在同等条件下进行扩增,每份样品平均做3个平行试验,作为生物学重复,分析其组内及组间差异,以检测该荧光定量PCR方法的重复性及稳定性。
1.2.6 石柱参CYP82D47基因扩增 分别以石柱参绿果期根、茎、叶为材料,以逆转录的cDNA为模板进行PCR反应,克隆CYP82D47基因。反应体系[12]为20 μL:ddH2O 7.8 μL,Mix 10 μL,Forward Primer 0.6 BμL,Reverse Primer 0.6 μL,DNA模板 1 μL; PCR反应程序:94 ℃预变性8 min;94 ℃变性30 s, 55 ℃退火30 s, 72 ℃延伸3 min,35个循环;72 ℃延伸10 min,产物4 ℃保存。
1.2.7 PCR产物回收、连接、转化与测序 采用SanPrep柱式DNA胶回收试剂盒对PCR产物进行回收、纯化,采用Takara公司Pmd20-T试剂盒,将得到的较高纯度DNA连接到pMD20-T载体上,后将连接产物转化到Top10 DH5α大肠杆菌感受态细胞中,以菌液为模板进行PCR扩增[22],最终将阳性克隆的菌液送至上海生工生物工程有限公司进行测序。
1.2.8 系统进化树构建 将核苷酸序列在Blast在线数据库进行同源性比对,以此检测克隆结果是否正确;并在NCBI核苷酸数据库和氨基酸数据库中搜索近缘种的细胞色素P450基因序列信息,采用DNAMAN软件分析序列的开放阅读框、起始密码子和终止密码子,并翻译出氨基酸序列,最后通过MEGA 5.0构建Neighbor-joining系统进化树。
1.3 数据处理
采用MxPro与SPSS 19.0对试验数据进行方差分析和线性回归分析,以P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 石柱参根、茎、叶组织总RNA提取质量检测
石柱参3个组织的总RNA电泳图谱如图1,28S rRNA和18S rRNA的条带完整且清晰,二者亮度与宽度比值均接近2∶1,表明提取的总RNA完整性较好;经检测OD260/OD280为1.9~2.1,表明总RNA质量较高,无污染,可用于后续试验。
M.2 kb plus DNA ladder;1~3.石柱参根、茎、叶 Root,stem and leaves of Shizhu ginseng;4~6.人参根、茎、叶 Root,stem and leaves of ginseng
图1 石柱参总RNA的提取
Fig.1 Total RNA extraction from shizhu ginseng
2.2 人参与石柱参中人参皂苷的质量分数及线性关系
采用高效液相色谱法测定人参、石柱参绿果期不同部位人参皂苷,试验重复测定4次,取平均值(表3)。可见,人参不同部位根、茎、叶人参皂苷总和的质量分数分别为1.174 4%、7.623 7%、8.933 5%,均明显高于石柱参根茎叶中人参皂苷的质量分数0.584 4%、1.895 2%、3.307 0%,可能是由于人参皂苷合成途径中某种人参皂苷合成酶基因的表达量过低造成的;此外,人参、石柱参茎、叶中人参皂苷质量分数相对较高,尤其是人参中Re达到4.013 8%(P<0.05)。分别取配好的人参皂苷标准品储备液稀释得到一系列不同质量浓度混合标准操作液,以质量浓度(mg/mL)为横坐标x,峰面积为纵坐标y,获得6种人参皂苷线性回归方程,由表4可见,人参皂苷Rb1、Rb2、Rc、Re 、Rg1、Rg2在标准液质量浓度为0.016~ 3.500 mg/mL呈良好的线性关系。
2.3 石柱参人参皂苷合成酶基因的表达量
采用实时荧光定量PCR技术,以人参Cyclophilin作为内参基因,检测5 a生石柱参11个生长时期(A~K)根、茎、叶组织中人参皂苷合成酶基因(SS、CYP82D47、CYP716A42)的表达量。
SS基因在5 a生石柱参根、茎、叶中不同生长时期的表达量见图2。可见,石柱参根组织SS基因表达量从展叶期到红果期无明显变化,随后至果熟期降为最低值,而在根生长期表达量有回升,但不高;茎组织SS基因表达量从展叶期到果熟期逐渐降低,尤其在根生长期几乎不表达,而在枯萎期有少量回升;SS基因在叶组织展叶期表达量较高,从始花期至绿果初期表达量稳步上升,达到峰值,约为根部表达量的3倍,在绿果末期至枯萎期其表达量逐步下降,而此时茎、叶组织的SS基因几乎不表达,仅在根部有少量表达,说明SS基因的表达具有明显的组织特异性,在石柱参根、叶中表达活跃,在茎中表达量有限。可见,石柱参SS基因随着生长周期的结束,其活跃程度降低,趋向于不表达状态,经统计学分析后,各组间差异极显著(P<0.01)。
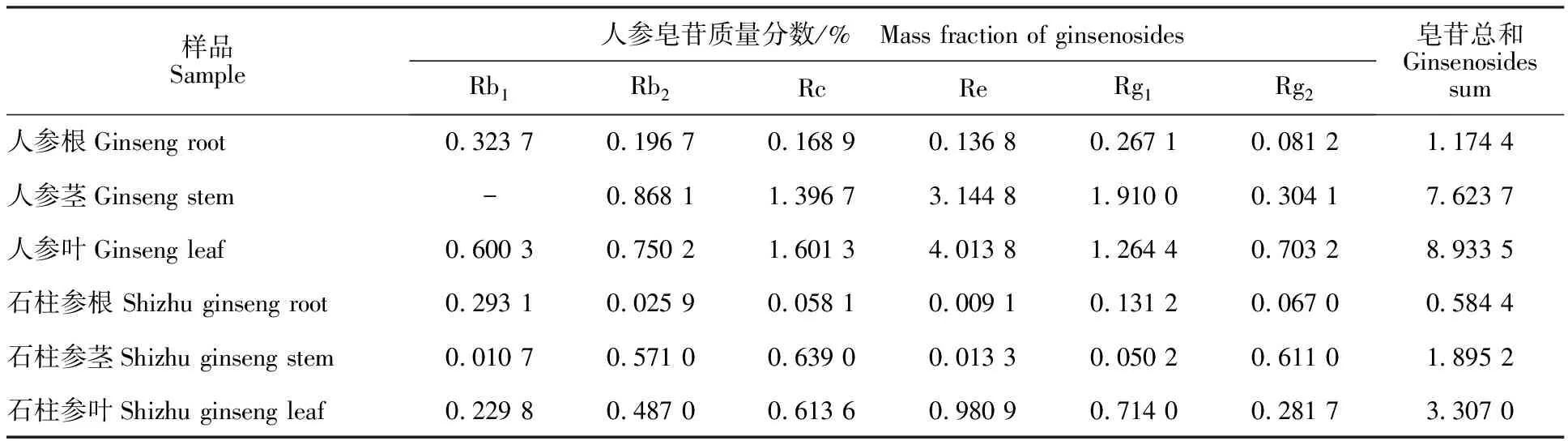
表3 人参、石柱参不同药用部位中人参皂苷质量分数Table 3 Mass fraction of ginsenosides in ginseng and shizhu ginseng %

表4 6种人参皂苷的线性回归方程Table 4 Linear regression equation of six ginsenosides
CYP82D47基因在5 a生石柱参根、茎、叶组织中不同生长时期的表达量(图3)。可见,CYP82D47基因在根组织中的表达量除展叶期较高外,其余各生长期的表达均处于较低水平;在茎组织中,从展叶期至根生长期Ⅰ的CYP82D47基因表达量逐渐升高,并达到峰值,随后下降,但仍高于同时期根组织的表达量;在叶组织中,从展叶期至绿果初期,其表达量稳步上升,之后均具有较高的表达量,高于同时期根、茎的表达量,可见,CYP82D47基因在石柱参中的表达部位主要是茎、叶组织,经统计学分析后,各组间差异极显著(P<0.01)。
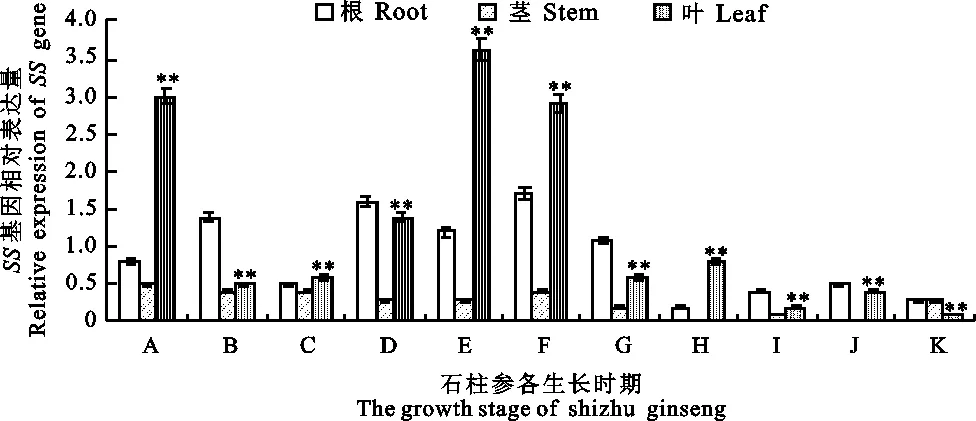
“**”表示差异极显著(P<0.01),“*”表示差异显著(P<0.05);下图同 “**”the difference was statistically very significant(P<0.01) ,“*”the difference was statistically significant (P<0.05);the same below
图2 石柱参人参皂苷合成酶SS基因qPCR表达分析
Fig.2 The qPCR relative expression analysis ofSSgene in shizhu ginseng

图3 石柱参人参皂苷合成酶 CYP82D47基因qPCR表达分析Fig.3 The qPCR relative expression analysis of CYP82D47 gene in shizhu ginseng
CYP716A42基因在5 a生石柱参根、茎、叶组织中不同生长时期的表达量(图4)。可见,CYP716A42基因在根部的表达与CYP82D47基因完全不同,其表达量先增高后降低,且在绿果末期达到峰值,约为展叶期的3倍(P<0.05),随后逐渐下降至枯萎期几乎不表达;在茎组织中的表达不活跃,在结果期和绿果末期其表达量较高,随后各生长期几乎不表达;在叶组织中表达量变化较大,展叶期较高,至盛花期降低至不表达,随后至绿果初期表达量逐步增加并出现峰值,随后降低,但同期相比,叶组织中的CYP82D47基因在枯萎期表达水平远高于根、茎组织,经统计学分析后,各组间差异极显著(P<0.01)。
2.4 人参、石柱参人参皂苷合成酶基因表达量的比较
综上所述,人参皂苷合成酶基因在石柱参绿果期的叶组织中相对表达量较高;所以,本试验检测同时期人参叶片中人参皂苷合成酶基因的表达量为对照组,结果如图5,人参、石柱参的人参皂苷合成酶基因SS、CYP716A42在叶片组织绿果期的表达量差异极显著(P<0.01),基因CYP82D47在叶片组织绿果期的表达量差异极显著(P<0.01)。
2.5 重复性试验
荧光定量PCR对3个平行试验检测的结果计算标准差及变异系数表明,同一份样品的组内重复变异系数为0.12%~1.03%,同一植株相同部位3份样品间的组间重复变异系数为 0.19%~ 1.92%(表5),表明该方法具有较好的组内和组间重复性。因此,说明本试验建立的实时荧光定量PCR方法不仅灵敏度和准确性高,而且稳定性较好。
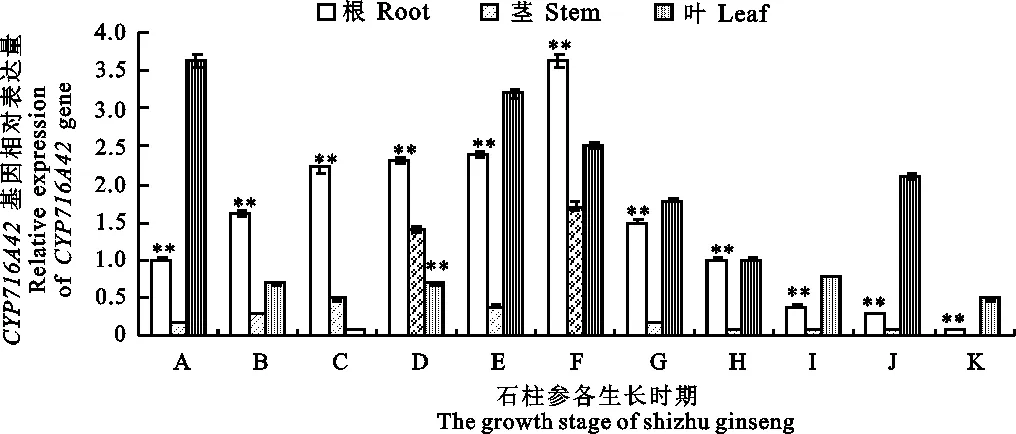
图4 石柱参人参皂苷合成酶 CYP716A42基因qPCR表达分析Fig.4 The qPCR relative expression analysis of CYP716A42 gene in shizhu ginseng
2.6 石柱参 CYP82D47基因克隆鉴定
由于绿果期CYP82D47基因的表达量较高,所以分别以石柱参绿果期根、茎、叶为材料,以逆转录cDNA为模板,采用细胞色素CYP82D47基因特异性引物扩增该基因,片段如图所示(图6)。

图5 人参、石柱参人参皂苷合成酶基因表达量的比较Fig.5 Comparison of ginsenoside synthase gene expression in ginseng and shizhu ginseng
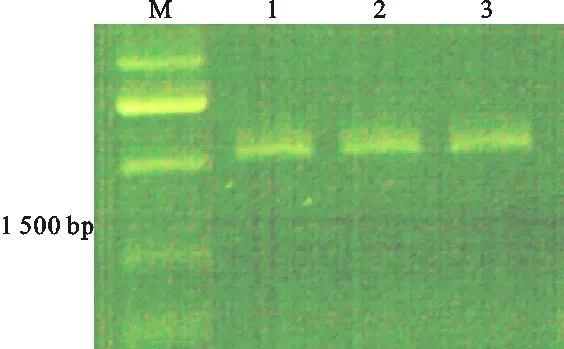
M.Marker;1~3.依次为以石柱参根、茎、叶组织cDNA为模板克隆的CYP82D47基因片段 Amplified fragment ofCYP82D47gene from Shizhu ginseng’s root,stem and leaves cDNA as the template
图6CYP82D47基因克隆图谱
Fig.6 Cloning map ofCYP82D47gene

表5 重复性试验结果Table 5 Results of repeated experiments of real-time quantitative PCR assay
将纯化得到的目的片段连接到pMD20-T载体上并转化到大肠杆菌Top10 DH5α的感受态细胞中,采用菌落PCR方法检测阳性克隆菌液,电泳得到约1 524 bp目的基因条带,随后对阳性克隆的菌液进行测序,采用DNAMAN软件对序列进行拼接,获得细胞色素P450CYP82D47基因cDNA全长序列,片段大小为1 524 bp,起始密码子位于114 bp,终止密码子位于1 205 bp,开放阅读框总长1 091 bp,共编码氨基酸324个,序列如图7。
根据石柱参细胞色素P450CYP82D47基因的氨基酸序列,在NCBI数据库中检索与其氨基酸序列相似度较高的序列建立系统进化树(图8)。可见,14个遗传关系较近的品种聚为4个类群,第一类群2个品种,即楤木和刺楸;第二类群5个品种,即通草、羽叶三七、姜状三七、三七和扣子七;第三类群4个品种,即西洋参、竹节参、人参和石柱参;第四类群3个品种,即无梗五加、细柱五加和刺五加。其中石柱参CYP82D47基因的氨基酸序列与人参、竹节参和西洋参亲缘关系较近,说明该结果与物种进化程度相符合。
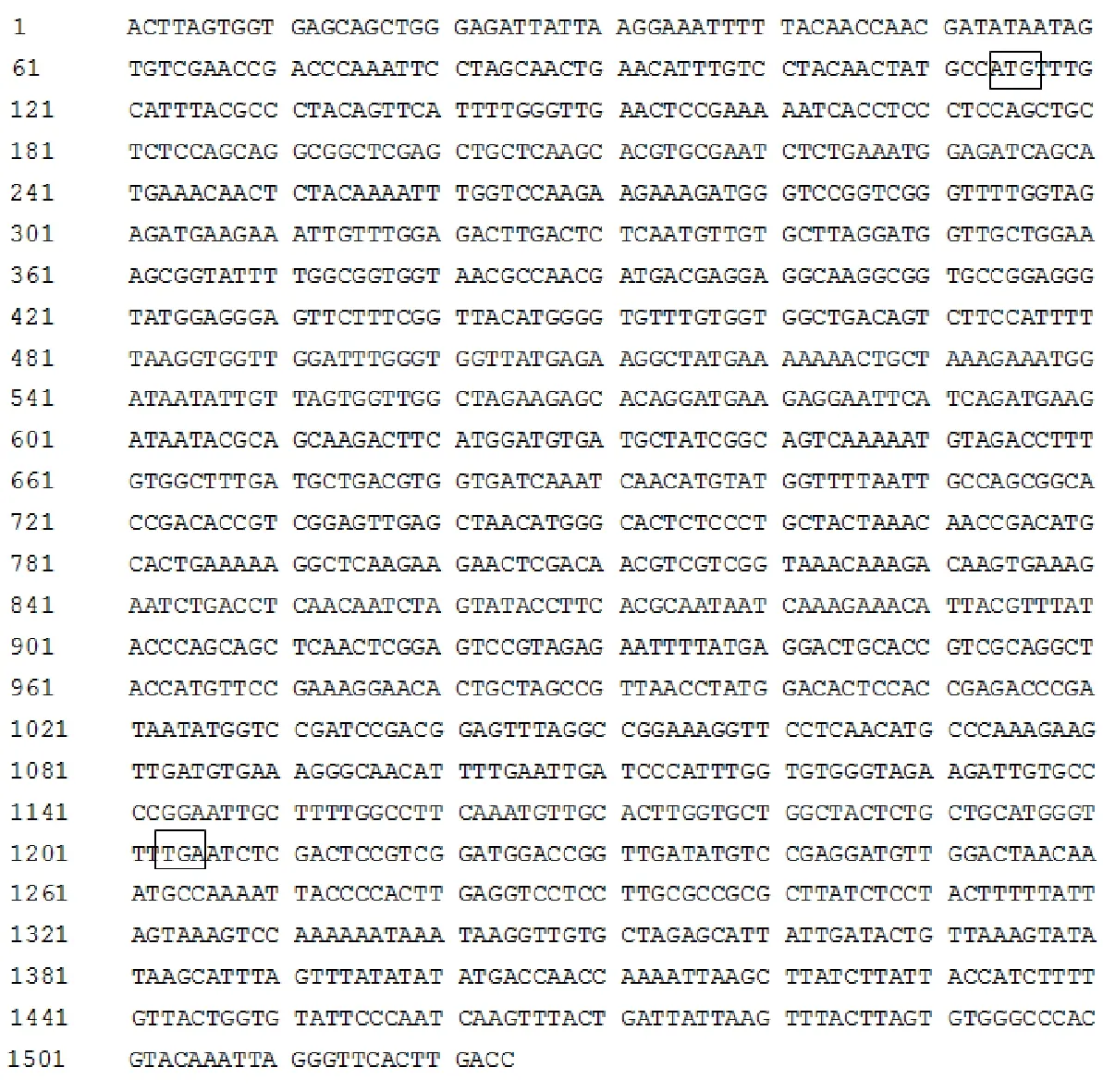
图7 CYP82D47基因cDNA序列Fig.7 cDNA sequence of CYP82D47 gene

图8 石柱参 CYP82D47基因系统发育树Fig.8 Phylogenetic tree of CYP82D47 gene in shizhu ginseng
3 讨 论
人参皂苷质量分数是评价石柱参品质的关键,其质量分数受环境和人参皂苷合成酶的协同影响,人参皂苷合成酶基因的表达影响人参皂苷合成途径中各物质流向。曲正义等[22]对不同生长时期人参根、茎、叶中的人参皂苷质量分数进行测定分析,发现人参中总皂苷质量分数为叶>根>茎,人参叶片中质量分数较高的单体皂苷是Re、Rd、Rb1和Rg1,人参根中质量分数较高的单体皂苷是Rg1、Re和Rb1,人参茎中质量分数较高的单体皂苷是Rg1和Re,牛云云等[23]发现三七人参皂苷合成酶基因在茎、叶中的表达量明显高于根中,均与本文研究结果一致;此外,人参皂苷合成酶基因的表达在根、茎、叶组织中具有较高的组织差异性,比如SS基因在石柱参根、叶中表达活跃,而茎中表达量则有限,且石柱参SS基因随着生长周期的结束,其活跃程度降低,趋向于不表达状态;CYP82D47基因主要表达部位是茎、叶组织;而CYP716A42基因在根、茎、叶中表达较活跃,尤其是根、叶中;人参皂苷合成酶基因的表达量在绿果期叶片中质量分数较高,但由于基因表达量不稳定且带有波动性,所以以人参为对照组,检测二者绿果期叶片中各人参皂苷合成酶基因的表达量,结果发现相同条件下,石柱参人参皂苷质量分数较人参差了近3倍,Han等[24]研究发现,人参CYP82D47在茉莉酸甲酯调控下表达量上调,而CYP82D47是一个尚未明确功能的P450羟化酶,所以造成人参皂苷质量分数较低的原因之一可能是人参皂苷合成酶基因CYP82D47的表达量相对较低,影响了人参皂苷合成过程中量的积累,该基因主要催化达玛烷型原二醇到原人参二醇的C-12位羟基化,推进了人参皂苷的生物合成。此外,克隆CYP82D47基因cDNA全长序列,进行生物信息学分析,由CYP82D47基因氨基酸序列及检索相似度较高的序列建立石柱参系统进化树,可见,石柱参与人参、竹节参、西洋参等的亲缘关系较近,结果与物种进化程度相符合。CYP716A42和CYP82D47同为细胞色素P450超基因家族成员,深入研究CYP450s,并进一步验证其功能和作用位点,阐述人参皂苷合成酶基因的表达如何调控人参皂苷生物合成的生理生态机制,对今后在微生物中重建人参皂苷合成途径、通过基因工程手段培育高质量分数人参皂苷的石柱参具有重要的实践意义。

