大麦白粉病抗性的遗传分析与QTL定位
费新茹 朱 娟 郭 晖 郭 红 吕 超 郭宝健 许如根,*
(1 扬州大学大麦研究所/江苏省作物遗传生理国家重点实验室/粮食作物现代产业技术协同创新中心/教育部植物功能基因组学重点实验室,江苏 扬州 225009;2 盐都区农业科学研究所,江苏 盐城 224011;3 江苏省农垦农业发展股份有限公司,江苏 南京 210008)
大麦(HordeumvulgareL.)为禾本科大麦属一年生草本植物,是世界第四大禾谷类作物,总产量和种植面积仅次于小麦、水稻和玉米[1]。大麦因具有丰富的膳食纤维、高β-葡聚糖含量等营养成分,可作为饲料、粮食、啤酒工业原料和保健用品等,受到了人们广泛的关注[2]。然而近年来,大麦白粉病(barley powdery mildew)的发生和传播严重影响了大麦的产量和品质。大麦白粉病是由大麦专化型活体寄生菌布氏白粉菌(Blumeriagraminisf. sp.hordei,Bgh)引起的真菌病害,可造成20%~30%的产量损失[3],是世界大麦主产区的主要病害之一[4]。因此,培育并推广抗白粉病品种是防治大麦白粉病最经济有效的手段。
目前已有关于大麦白粉病抗性遗传[5-6]、基因定位[7-8]的研究报道。如严隽析[9]研究发现大麦白粉病抗性由单个显性基因或2对基因控制;俞志隆等[10]研究认为大麦白粉病田间抗性受多基因控制;黄金堂[11]研究认为大麦白粉病抗性遗传符合加性-显性遗传模型,且加性效应作用更明显。大麦对白粉菌的抗性主要受专化性抗病基因的控制,目前已鉴定到100多个抗性基因,其中22个专化性抗病基因分布于不同的染色体上[12]。研究表明,某些抗病基因存在多个不同的复等位基因,如Weibull 等[[13]在Mla基因座共鉴定出32个抗性复等位基因。大麦野生型Mlo基因位点通过突变可以产生一系列不同的mlo隐性等位基因,mlo基因介导大麦几乎对目前已知的所有Bgh生理小种都有抗性[14]。
随着大麦白粉病病原菌生理小种的不断分化,新菌株可能导致原有抗病品种的抗性下降甚至丧失。为确保大麦生产上应用品种的大麦白粉病抗性,必须不断鉴定发掘新的大麦白粉病抗性基因并在育种中加以利用[15]。本研究以1个大麦白粉病抗感DH群体及其亲本为试验材料,对其大麦白粉病抗性进行遗传分析与QTL定位,以期为大麦白粉病抗性基因的精细定位及分子标记辅助选择育种奠定理论基础。
1 材料与方法
1.1 材料
1.1.1 供试材料 以含173个DH系的DH群体及其亲本为试验材料,该DH群体是以扬饲麦1号×Gairdner杂交F1的花药经组织培养、染色体加倍等技术构建的,其中母本为感大麦白粉病六棱饲料大麦扬饲麦1号,父本为抗大麦白粉病二棱啤酒大麦Gairdner,均由澳大利亚塔斯马尼亚大学周美学教授惠赠。
1.1.2 田间种植 于2014年秋季将试验材料播种于扬州大学大麦试验田。每材料人工点播两行,行长1.2 m,株距0.03 m, 行距0.2 m,每行点播40粒,并设3次生物学重复。田间管理同大田常规栽培方法。
1.2 方法
1.2.1 抗性鉴定方法 大麦白粉病病级调查参照Li等[16]的方法,在大麦白粉病发病始期(抽穗期)开始调查,每隔7 d调查1次,连续调查3期。每个株系连续调查10株。根据叶片病斑的有无、大小及发病部位,将大麦白粉病病级分为6级(详见表1)。2015年4月上旬和中旬,扬州为多雨天气,随着气温逐渐上升(>15℃),田间温度和相对湿度较适宜大麦白粉病的发生,大麦白粉病的发病程度随着调查时期延长而加重。按照公式计算大麦白粉病病情指数(disease index, DI)[11]:
式中,x代表每个调查植株抗性级别(0、1、2、3、4、5级);n代表各病级的植株数量;N代表所调查的总植株数。
1.2.2 DH群体遗传连锁图谱的构建方法 筛选亲本间多态性好的SSR标记,利用这些多态性标记对亲本及173个DH系进行基因型鉴定,与扬饲麦1号相同的带型记为0,与Gairdner相同的带型记为2,杂合或缺失记为1。利用JoinMap 4.0 软件构建DH群体的分子标记遗传连锁图谱。
1.2.3 QTL定位方法 利用1年3个时期的数据,采用Windows QTL IciMapping 4.0软件[17]中的完备区间-加性模型(inclusive composite interval-additive mapping,ICIM-ADD)定位方法,扫描步长为1 cM,以LOD值2.5作为阈值[18],QTL的命名遵循McCouch[19]的原则。
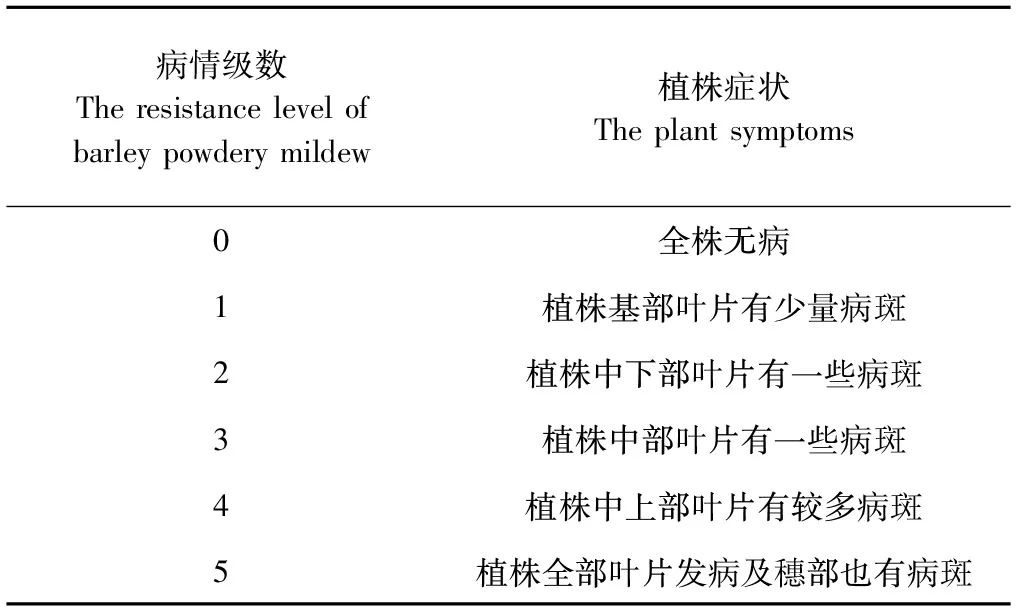
表1 大麦白粉病病级划分Table 1 The resistance level of barley powdery mildew
1.3 数据分析
利用Microsoft Excel 2016对原始数据进行整理,利用 SPSS 16.0 数据统计软件对双亲及DH群体进行抗性差异的统计分析。亲本大麦白粉病抗性差异采用t测验分析,DH群体大麦白粉病抗性差异采用方差分析。
2 结果与分析
2.1 DH群体及其亲本大麦白粉病病情指数的差异性分析
2.1.1 DH群体及其亲本病情指数的表现 由表2可知,3个调查时期大麦白粉病病情指数在亲本间均存在极显著差异,其中亲本及DH群体大麦白粉病病情指数平均值均以第三期最高。从DH群体变异系数和变幅来看,3个调查时期白粉病病情指数在DH群体内存在广泛的变异,且存在不同程度的超高亲或超低亲遗传现象。
由图1可知,3个时期DH群体的大麦白粉病病情指数均呈连续性分布,表明可进一步对大麦白粉病抗性进行QTL定位。
2.1.2 DH群体病情指数的方差分析 由表3可知,白粉病病情指数在调查时期间、DH系间及基因型与调查时期互作间的差异均达到极显著水平,表明白粉病病情指数在DH群体各系间存在丰富的遗传变异。同时,DH群体发病程度还受不同调查时期气候条件的影响。
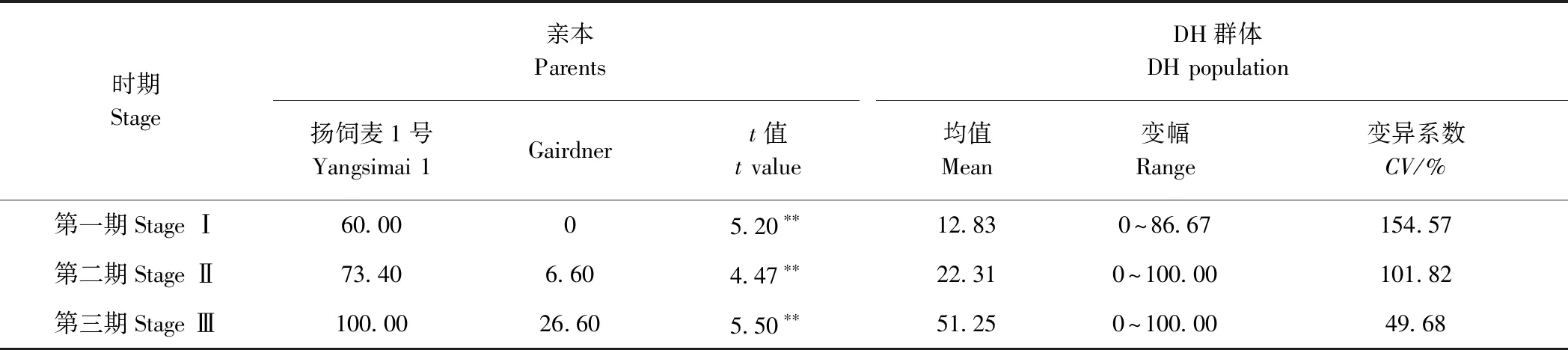
表2 亲本及DH群体的病情指数Table 2 DI of DH population and its parents
注:**表示在0.01水平差异显著。下同。
Note:**indicates significant difference at 0.01 level. The same as following.
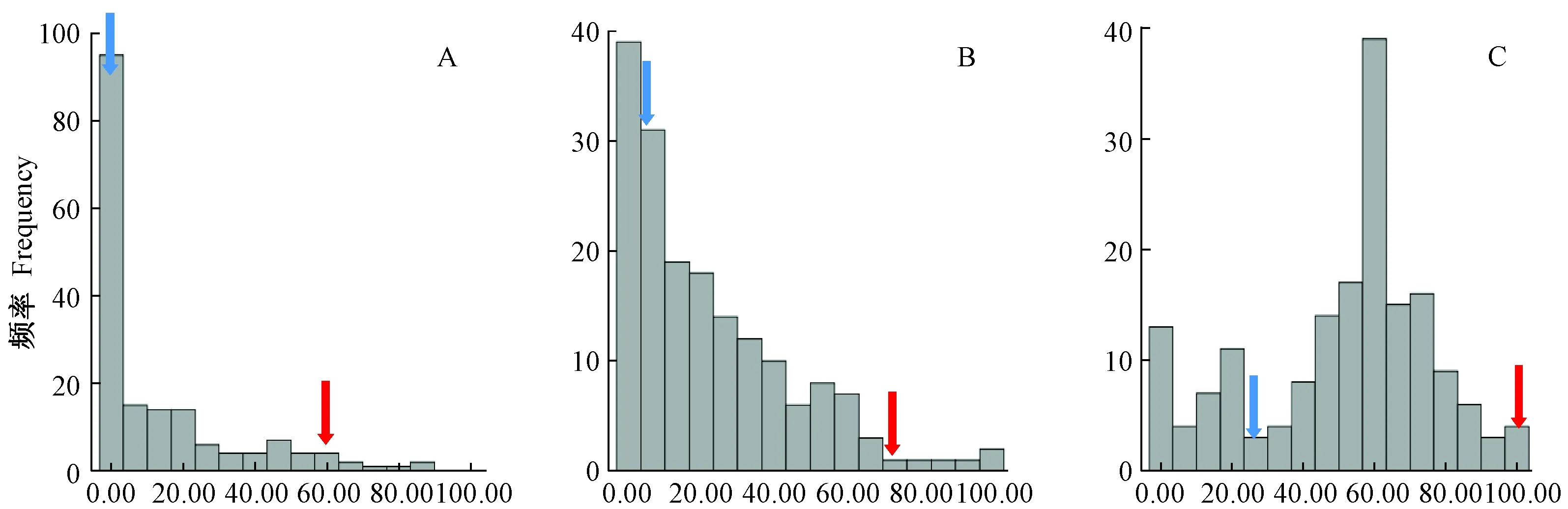
注:A:第一期病情指数;B:第二期病情指数;C:第三期病情指数。红色箭头代表扬饲麦1号;蓝色箭头代表Gairdner。Note:A:DI of stage Ⅰ.B:DI of stageⅡ. C:DI of stage Ⅲ. The red arrow represents Yangsimai 1. The blue arrow represents Gairdner.图1 DH群体白粉病病情指数频数分布Fig.1 Frequency distribution of the DI in DH population
2.2 DH群体遗传连锁图谱的构建与大麦白粉病抗性QTL定位
2.2.1 DH群体遗传连锁图谱的构建 由表4可知,对扬州大学农学院大麦研究所保存的1 008个SSR标记在亲本间进行多态性筛选,获得91对多态性好的SSR标记。利用这些多态性标记对亲本及173个DH系进行基因型鉴定,构建了覆盖大麦全基因组 1 161.99 cM的遗传连锁图谱,图谱包含91对SSR标记,较均匀分布于大麦7条染色体上,标记间平均遗传距离为12.77 cM,平均每条染色体上标记个数为13个。
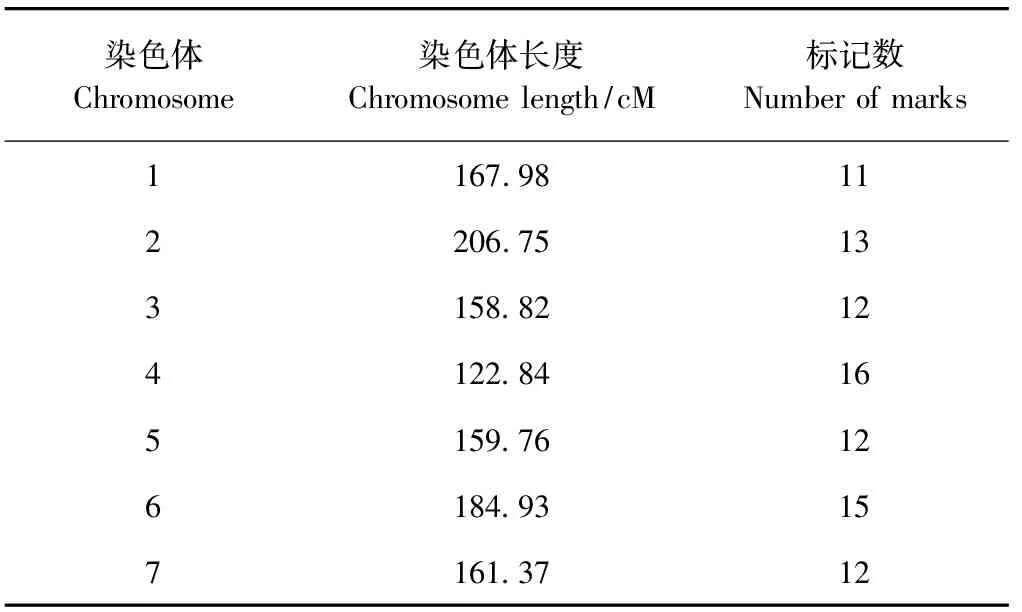
表4 大麦DH群体遗传图谱各染色体的长度及标记数Table 4 The length of chromosome and number of marks in barley DH population
2.2.2 大麦白粉病抗性QTL定位 由表5可知,3个调查时期共检测到5个与大麦白粉病抗性相关的QTLs,分布于第2、第3和第4号染色体上,分别为qPM-2Ha、qPM-2Hb、qPM-3Ha、qPM-4Ha和qPM-4Hb。第2号染色体上的qPM-2Ha在3个调查时期均被检测到,位于Bmag0711-AWBMS56标记区间内,可解释7.48%~12.50%的表型变异;qPM-2Hb在第一期和第二期检测到,位于Bmag0749-GBM1475标记区间内,可解释6.22%~8.13%的表型变异。第3号染色体上的qPM-3Ha仅在第三期检测到,位于EBmac0705-HVLTPPB.2标记区间内,可解释3.97%的表型变异。第4号染色体上的qPM-4Ha在3个调查时期均被检测到,位于EBmac0906-HVM68标记区间内,可解释23.07%~32.09%的表型变异;qPM-4Hb仅在第三期检测到,位于GBM1388-HDAMYB标记区间内,可解释13.34%的表型变异。qPM-2Ha、qPM-4Ha及qPM-2Hb的加性效应均为负值,说明其白粉病抗性基因均来源于抗病亲本Gairdner;qPM-3Ha和qPM-4Hb的加性效应均为正值,说明其白粉病抗性基因来源于感病亲本扬饲麦1号。
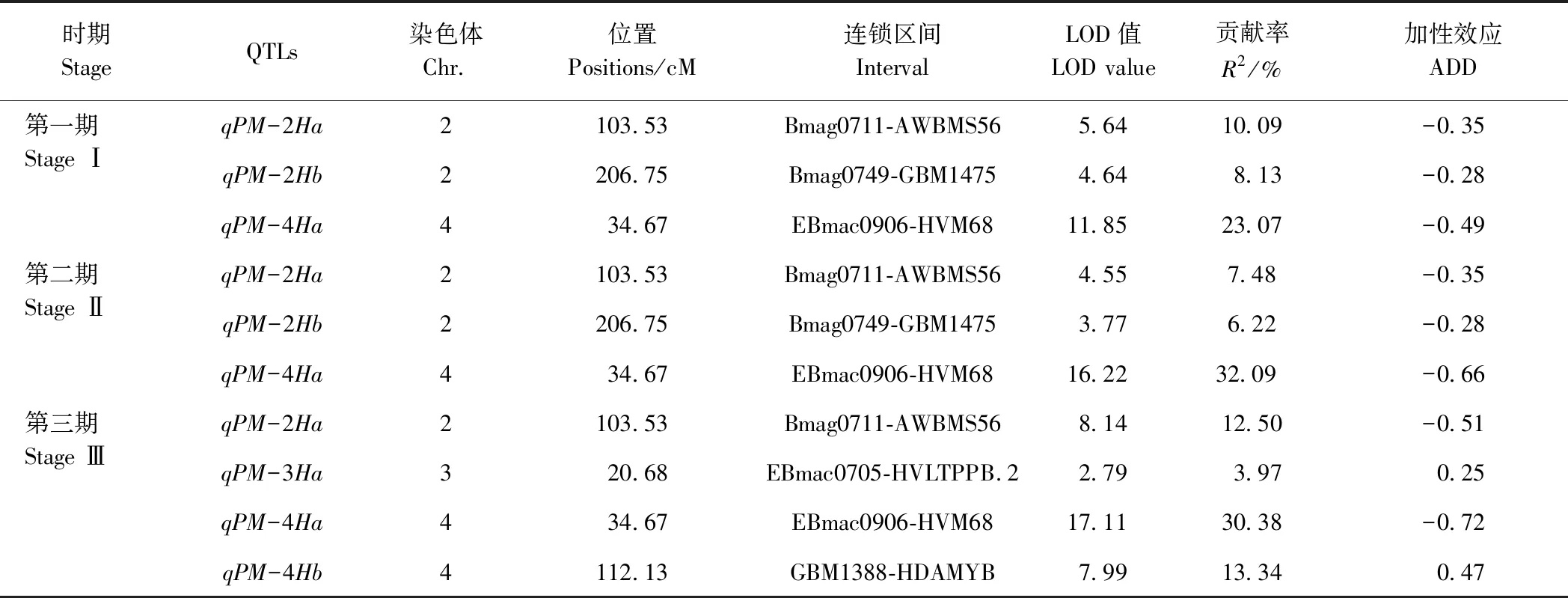
表5 大麦白粉病抗性QTLs在染色体上的位置及效应分析Table 5 The chromosome positions and effects analysis of barley powdery mildew resistance QTLs
3 讨论
大麦白粉病是由布氏白粉菌属大麦专化型活体寄生菌引起的真菌病害,其流行程度主要与寄主抗病性、气候条件、栽培措施等密切相关[5,15]。寄主抗病性一方面取决于是否具有抗病基因,另一方面也受株型和群体结构的影响,如抗病品种病菌形成缓慢,且发病轻;叶片直立生长、长且窄的品种通常发病也较轻[20]。此外,白粉病发病程度受温度、湿度、光照等气候条件影响较大[20]。白粉病发生适温为15~20℃,低于10℃时发病缓慢,低于0℃或高于28℃不发病;高湿条件有利于发病,相对湿度大于70%有可能引起病害流行;白粉病病菌的分生孢子对直射阳光较敏感,散射光有利于病害发生[20-21]。播种量大,田间植株密度大会加重白粉病[22]。若施用氮肥过多,会造成植株贪青、徒长等利于白粉病的发生[22];而水肥不足、土壤干旱、植株生长衰弱、抵抗力低也利于该病发生[20]。本研究中亲本和DH群体在3个调查时期白粉病发病程度呈逐渐加重的趋势,这与发病期间气温逐渐上升、雨水匀和利于白粉菌侵染大麦相关。
大麦白粉病一般表现为多基因控制的数量性状,同时受环境及基因与环境互作的影响[10]。目前,已有部分大麦白粉病抗性QTLs被定位[23-24]、克隆[25-26]并应用于大麦品种改良[27-28]。本研究检测到的部分QTLs与已报道的基因可能是等位基因或同一基因,如qPM-2Ha在染色体上的位置与Hilbers等[29]利用Ris03S×Sultan 和Alf ×Vogelsanger Gold 2构建的2套DH群体定位到的位于RFLP分子标记cMWG660与MWG97之间的抗白粉病基因MlLa位置相近,表明其可能是MlLa的等位基因。qPM-4Ha的位置与Görg等[30]利用大麦近等基因系定位到与RFLP分子标记MWG032共分离的抗白粉病基因Mlg位置相近,即其可能是Mlg的等位基因。Hinze等[31]利用6个不同基因型的大麦品种构建的回交群体定位到第4号染色体上,与RFLP分子标记bAL88/2共分离的抗白粉病基因mlo,qPM-4Hb与mlo位置相近,可能是其等位基因。第2号染色体上qPM-2Hb和第3号染色体上qPM-3Ha所在区域至今没有相关的白粉病QTL报道,可能是新的抗大麦白粉病QTL位点,但尚需进一步验证。
4 结论
本研究共检测到5个与大麦白粉病抗性相关的QTLs,其中qPM-2Ha、qPM-4Ha和qPM-4Hb与已报道的基因可能是等位基因或同一基因,位于第2号染色体上qPM-2Hb和位于第3号染色体上qPM-3Ha所在区域目前尚没有相关的白粉病抗性位点报道,可能是新的抗大麦白粉病QTL位点。本研究结果为大麦白粉病抗性QTL的发掘、基因精细定位、基因克隆和分子标记辅助选择育种奠定了一定的理论基础。

