芹菜素对3-氯-1,2-丙二醇诱导的大鼠肾损伤及线粒体分裂融合的影响
钟玉杰,师振强,晋程妮,王晓瑞,李 璇,韩佳慧,薛 维,伍 鹏,彭晓丽*,夏效东*
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
氯丙醇类化合物是目前国际上广为关注的食品污染物,其中3-氯-1,2-丙二醇(3-monochloropropane-1,2-diol,3-MCPD)因其污染大、毒性强,被视为氯丙醇类化合物的代表和毒性参考物[1]。高盐、高脂食品在热加工过程中极易产生此种化合物[2]。3-MCPD易溶于水和脂,经消化道吸收后,可随血液循环分布于机体各个组织和脏器中,其中肾脏和雄性生殖系统是其主要靶器官[3]。最初,3-MCPD在酸水解蛋白加工的酱油中被发现[4],另外,热加工食品婴幼儿配方奶粉中也含有一定量的3-MCPD[5-7]。3-MCPD对啮齿类动物的毒性较大,世界卫生组织的技术性报告初步发现剂量为30 mg/kg的3-MCPD可引起大鼠肾小管扩张坏死并可能引发肾小管病变、肾小管增生等现象[8]。Cho等研究发现用400 mg/L 3-MCPD处理时,雄性和雌性大鼠肾小管腺瘤、肾小管增生和慢性进行性肾病显著增加[9]。鉴于3-MCPD分布的广泛性及其对机体的毒害效应,寻求更多能够缓解3-MCPD毒性的天然活性物质具有现实意义。
芹菜素是一种天然存在的黄酮类化合物,广泛存在于多种水果、蔬菜和草药中,尤其在芹菜根中含量最高(高达74 mg/kg)[10]。芹菜素可通过调节活性氧簇(reactive oxygen species,ROS)含量及谷胱甘肽(glutathione,GSH)水平发挥其抗氧化效果从而缓解红藻氨酸诱导的老鼠体内及体外兴奋毒性[11]。给结肠炎大鼠模型灌胃芹菜素,结果显示芹菜素预处理组的大鼠结肠质量下降了10%,结肠髓过氧化物酶(myeloperoxidase,MPO)和碱性磷酸酶活性分别下降了35%和21%,炎性标记物肿瘤坏死因子-α(tumor necrosis factor,TNF-α)等也趋于正常表达[12]。以脂多糖诱导的原代培养SD大鼠的主动脉平滑肌细胞为研究对象,20、40 μmol/L芹菜素可抑制细胞有丝分裂使细胞停滞于G0/G1期,从而抑制细胞增殖[13]。Fu等[14]的研究表明芹菜素逆转了TNF-α导致的B细胞淋巴瘤/白血病-2(B cell lymphoma/lewkmia-2,Bcl-2)的减少和Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)的增加,降低了Caspase 3的活性从而抑制了TNF-α诱导的细胞凋亡。另外,芹菜素能缓解神经退行性疾病,如阿尔茨海默症的发生和发展[15-16]。以上研究表明,芹菜素具有抗炎、抗氧化、心血管保护、神经保护、抑制药物诱导的细胞凋亡性死亡等多种生理作用。
线粒体是高度动态化的管状互连网络,维持这种涉及线粒体分裂 、融合及蠕动的复杂网状组织对线粒体和细胞功能的实现非常重要[17]。当线粒体融合分裂动态平衡被破坏或线粒体相关转录因子异常表达时,会引发多种脏器损伤,尤其是富含线粒体的肾脏。Qin Shuangli等[18]发现氟中毒大鼠肾组织中MFN1表达水平降低,同时FIS1表达水平升高,从而导致了肾脏近曲小管上皮细胞线粒体形态紊乱。Gall等[19]发现敲除MFN2的小鼠肾小管上皮细胞线粒体融合降低,引发了Bax的激活和细胞色素c的释放。脓血症致肾损伤大鼠模型中PGC1表达量下降,而PGC1转基因小鼠的缺血耐受力增强[20]。由以上文献知,线粒体分裂融合状态与肾脏损伤有着直接或间接的联系。目前鲜见关于3-MCPD诱导线粒体分裂融合异常的相关报道,也鲜有用芹菜素缓解大鼠肾毒性的相关研究。本实验基于线粒体分裂融合、转录因子表达水平的变化,探讨芹菜素对3-MCPD诱导的大鼠肾损伤的保护作用。
1 材料与方法
1.1 动物、材料与试剂
SPF级健康干净的雄性SD大鼠((200f10)g),购自西安交通大学医学实验动物中心,许可证号:SCXK2013-003。
3-MCPD(纯度98%) 北京百灵威科技有限公司;芹菜素(纯度98%) 南京春秋生物工程有限公司;超纯RNA提取试剂盒、HiFiScript cDNA Synthesis试剂盒、UitraSYBR Mixture试剂盒、辣根过氧化物酶(horseradish peroxidase,HRP)标记的二抗 康为世纪生物科技有限公司;丙烯酰胺、甲叉丙烯酰胺、三羟甲基氨基甲烷、甘氨酸、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、四甲基乙二胺、苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)、羧甲基纤维素钠(carboxymethylcellulose sodium,CMC) 美国Sigma公司;BCA蛋白定量试剂盒、苏木精-伊红染色试剂盒 上海碧云天生物技术有限公司;一抗(FIS1、NRF1、MFN2、ACTB) 美国Proteintech公司。
1.2 仪器与设备
垂直电泳槽、垂直电泳仪配套梳子、基础电泳仪、化学发光成像系统、IQ5实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)仪 美国伯乐公司;定轨摇床 海门市其林贝尔仪器;核酸蛋白测定仪 杭州奥盛仪器;SXD-100D数码倒置显微镜上海蔡康仪器有限公司。
1.3 方法
1.3.1 动物分组及处理
将36 只SD大鼠按体质量随机分为6 组,每组6 只。动物在空气相对湿度60%~70%、温度(20f2)℃的动物房中适应性生长1 周,期间大鼠可自由摄食、饮水,明暗交替时间为12 h。1 周后进行灌胃处理:对照组灌胃超纯水;溶剂对照组灌胃CMC;3-MCPD组灌胃30 mg/kg mb3-MCPD;芹菜素低、中、高剂量组先分别灌胃20、40、80 mg/kg mb芹菜素,2 h 后再灌胃30 mg/kg mb3-MCPD。芹菜素先用质量分数1% CMC溶液悬浮,然后用超纯水进行相应稀释,确保每只大鼠摄入CMC的量一致;3-MCPD用超纯水溶解。
每天记录大鼠的饮水量和进食量。灌胃28 d后,处死大鼠,解剖取其肾脏、肝脏、脑组织,用预冷的生理盐水冲洗组织,滤纸吸干脏器上残留水分,天平称质量,计算各脏器质量指数。将组织保存在-80 ℃冰箱中。
1.3.2 脏器质量指数
肝脏、肾脏、脑组织质量指数按以下公式计算。
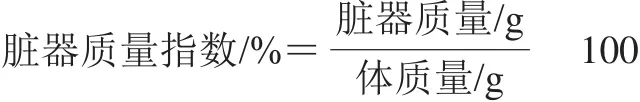
1.3.3 肾脏组织病理学分析
用苏木精和伊红染色观察肾脏组织的病理变化。用质量分数1%戊巴比妥钠麻醉大鼠后,用生理盐水和质量分数4%多聚甲醛进行心脏灌注。取出右肾,经质量分数4%多聚甲醛固定24 h,经脱水透明后包埋在石蜡中,然后用质量分数4%多聚甲醛洗涤两次。切片脱蜡后,分别用苏木精染色7 min,伊红染色1 min,树脂封片后,在数码倒置显微镜下放大100 倍进行观察。
1.3.4 实时荧光定量PCR检测基因表达
用超纯RNA提取试剂盒提取肾组织总RNA,微量核酸和蛋白质的定量仪测定其质量浓度。根据HiFiScript cDNA Synthesis试剂盒指示将9 μL总RNA样品转化为cDNA,反应体系为20 μL,逆转录产物采用nano drop核酸蛋白测定仪检测浓度并调整质量浓度为100 ng/μL。用UitraSYBR Mixture染料,实时PCR检测系统测定mRNA的表达量。PCR循环参数:预变性 95 ℃ 10 min;变性95 ℃ 15 s,退火60 ℃ 1 min,延伸60 ℃ 1 min,循环40 次。基因相对表达量用2-ΔΔCt法计算。实时荧光定量PCR引物序列如表1所示。

表1 引物序列Table1 Primer sequences used in this study
1.3.5 Western blot检测蛋白表达
称取约30 mg组织,剪碎于10 mL离心管中,加入500 μL含体积分数1%的100 mmol/L PMSF溶液,匀浆20 次后在冰上放置30 min使之充分裂解,13 400hg离心5 min,吸取上清液。采用BCA蛋白定量试剂盒来检测未知样品中蛋白的含量。将变性后的蛋白样品用SDS-聚丙烯酰氨凝胶电泳分离,然后在100 V、0.3 A的条件下转移到PVDF膜上,用含质量分数5%脱脂奶粉的封闭液在室温下均匀振荡孵育2 h,一抗孵育过夜,弃去一抗,TBST洗3 次,每次20 min,随后用HRP标记的二抗于室温振荡条件下孵育2 h,弃去二抗,TBST洗3 次,每次20 min。将超敏ECL化学发光试剂盒中A液与B液等体积混合后,滴在膜上,经化学发光系统显色后用图像分析软件ImageJ计算灰度。
1.4 数据处理
数据用SPSS 20.0统计软件进行单因素方差分析,结果采用平均值±标准差表示。组间比较采用Duncan法,P<0.05为差异显著,P<0.01为差异极显著,均具有统计学意义。
2 结果与分析
2.1 芹菜素对3-MCPD致肾损伤大鼠体质量、摄食量的影响
由图1可见,与对照组相比,灌胃一周后,3-MCPD组大鼠食欲开始下降,28 d时3-MCPD组大鼠摄食量降低。随着灌胃时间的延长,相较3-MCPD处理组,芹菜素保护组大鼠食物摄入量增加,灌胃14 d后芹菜素保护组大鼠的食物摄入量均高于3-MCPD组。结果提示芹菜素能显著改善3-MCPD组大鼠精神萎靡、食欲不振、生长迟缓等状况。
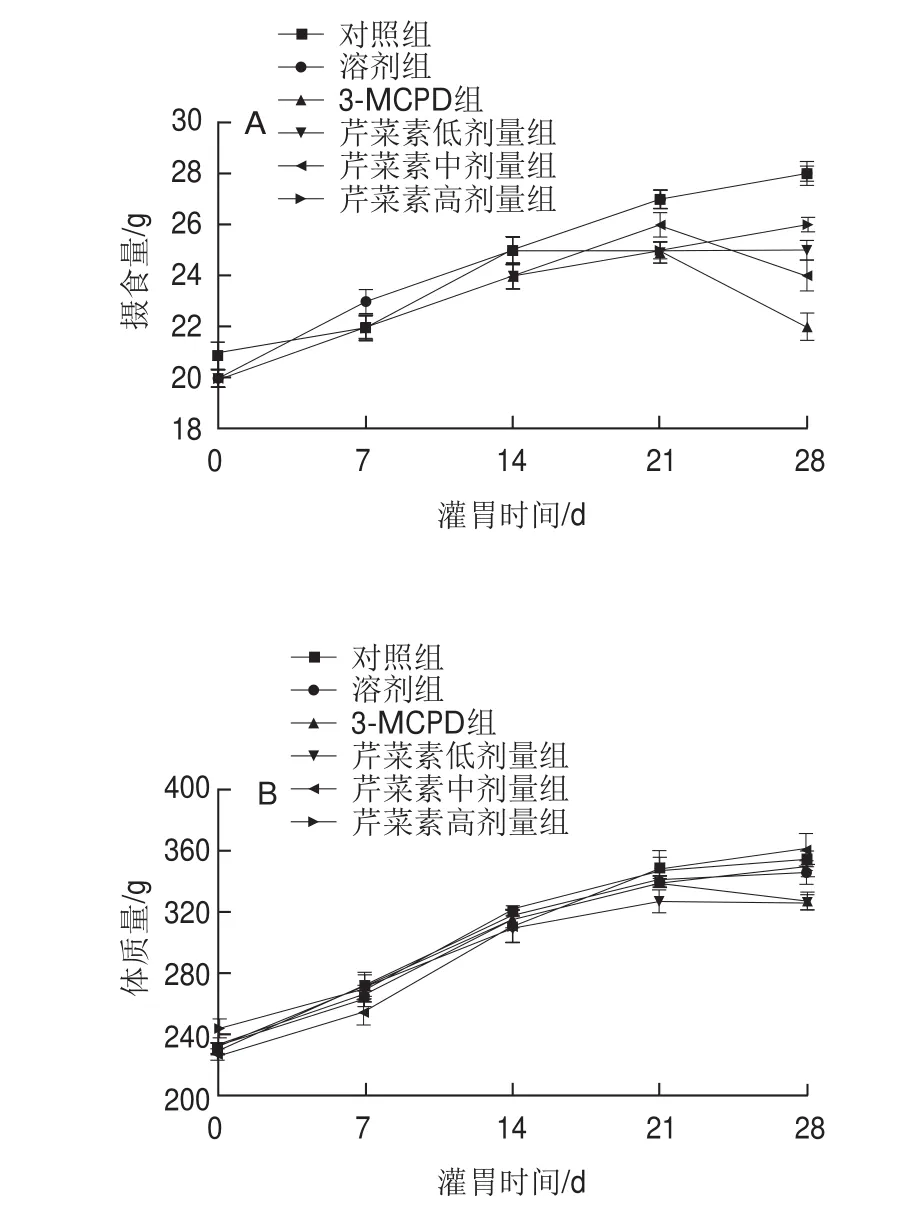
图1 3-MCPD、芹菜素和3-MCPD协同处理后大鼠摄食量(A)、体质量(B)变化(n =5)Fig.1 Changes in food intake (A) and body mass (B) of rats after treated with 3-MCPD alone or in combination with apigenin (n = 5)
2.2 芹菜素对3-MCPD致肾损伤大鼠肾脏、肝脏、脑质量指数的影响
由图2可知,相较对照组,3-MCPD组大鼠肾脏质量极显著增加(P<0.01)、肝脏质量指数也有所增加(P<0.05)。芹菜素保护组大鼠肾脏质量指数均低于3-MCPD组,其中高剂量芹菜素保护组肾脏质量指数与3-MCPD组相比差异极显著(P<0.01)。对于肝脏质量指数,芹菜素保护组较3-MCPD组无明显差异。由脑质量指数可知,3-MCPD组、芹菜素保护组脑质量指数与对照组相比无明显变化。通过以上脏器比指数知,肾组织对3-MCPD敏感,这与肾脏是3-MCPD的靶器官的研究一致。由此可知,芹菜素以剂量依赖性地方式缓解了3-MCPD对大鼠肾组织的毒害作用。

图2 3-MCPD、芹菜素和3-MCPD协同处理后大鼠肾脏(A)、肝脏(B)、脑(C)质量指数Fig.2 Changes in renal/body mass ratio (A), liver/body mass ratio (B),and brain/body mass ratio (C) of rats subjected to 3-MCPD and 3-MCPD plus apigenin treatment
2.3 不同处理组大鼠肾脏组织病理学分析
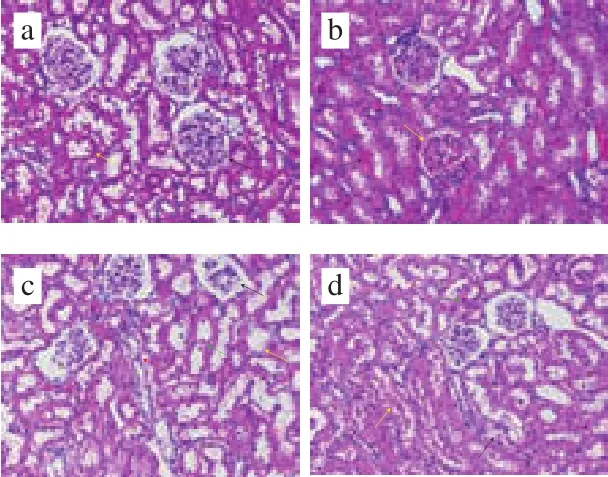
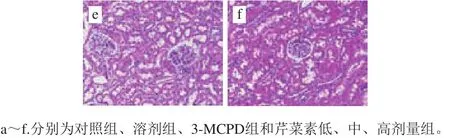
图3 大鼠肾脏组织病理学分析Fig.3 Histopathological analysis of rat kidney tissues
由图3病理组织切片可知,对照组的肾组织无明显异常,CMC组除肾小球毛细血管轻度出血外,也未发现其他明显病变。与对照组相比,3-MCPD处理组的大鼠肾组织集合管上皮细胞排列不齐,发生水样变性,胞体肿胀,胞浆淡染(红色箭头);肾小球缩小,肾小囊变大(黑色箭头);肾小管上皮细胞数量减少,管腔中可见少量脱落的上皮细胞(绿色箭头);静脉血管内膜疏松、增厚(黄色箭头)。低剂量芹菜素保护组中集合管上皮细胞排列不齐(黑色箭头);肾小管上皮细胞数量减少,胞浆嗜酸性增强(绿色箭头);肾小管管腔中可见多量红色滴状物(黄色箭头)。由中剂量芹菜素保护组的病理切片可知,集合管上皮细胞排列不齐,轻微损伤,胞核居于一侧(黑色箭头);肾小管部分上皮细胞胞核消失,呈空泡状(黄色箭头)。高剂量芹菜素保护组中集合管结构完整,上皮细胞排列较整齐。病理组织切片结果表明芹菜素在一定程度上缓解了3-MCPD诱导的肾损伤。
2.4 芹菜素对3-MCPD致肾损伤大鼠线粒体转录因子基因表达的影响
由图4可见,与对照组相比,3-MCPD组大鼠线粒体合成相关基因PGC1、NRF1、TFAM表达显著下调,分别降低了约76%、56%、38%(P<0.01)。与3-MCPD处理组相比,芹菜素协同3-MCPD组的PGC1、NRF1、TFAM基因表达显著上调,具有药物依赖性,其中高剂量芹菜素协同处理组的PGC1从24%上升到116%,NRF1从44%上升到130%,TFAM从62%上升到100%(P<0.01)。结果表明芹菜素协同处理能显著改善3-MCPD导致的线粒体转录因子表达下降,这间接反映出芹菜素能维持线粒体正常结构和功能。
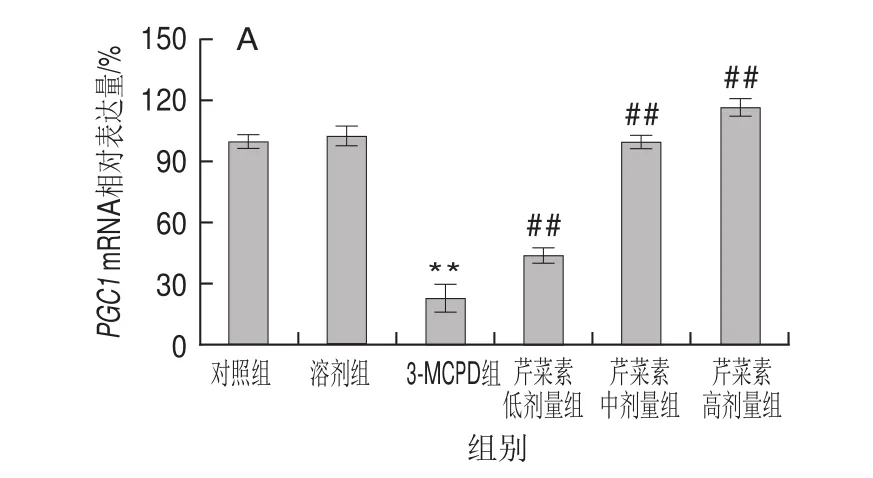
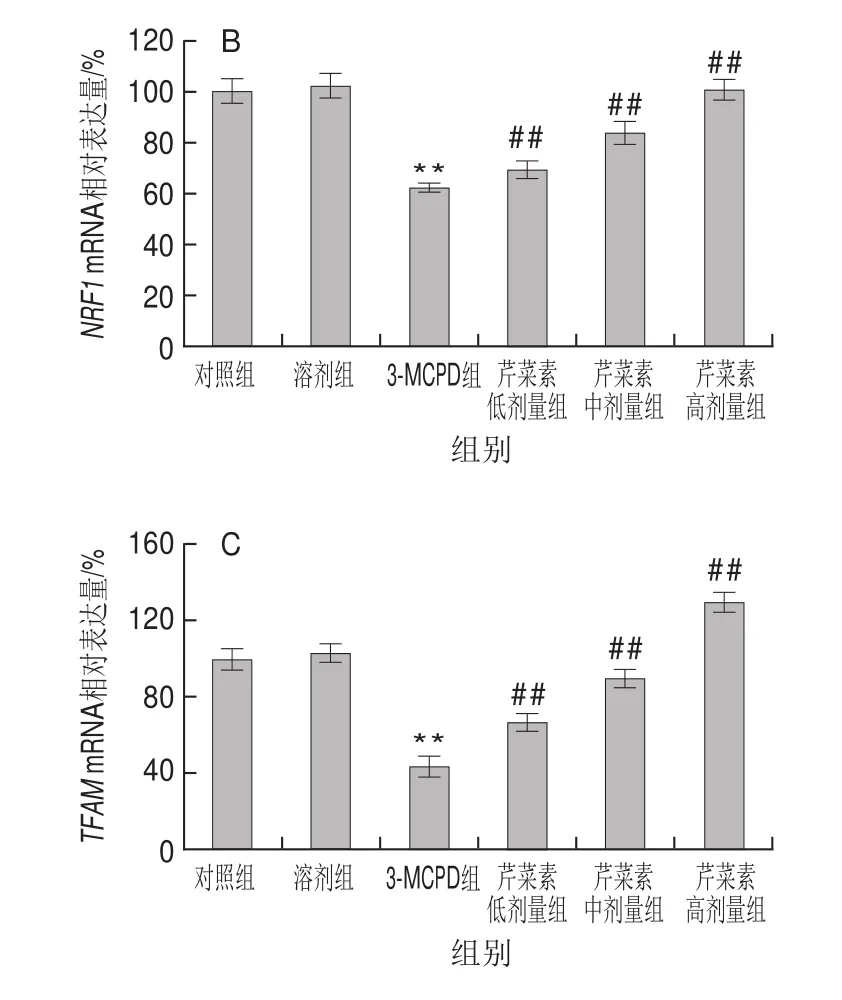
图 4 3-MCPD、芹菜素和3-MCPD协同处理后大鼠PGC1(A)、NRF1(B)、TFAM(C)基因表达Fig.4 Expression of PGC1 (A), NRF1 (B) and TFAM (C) genes in rats subjected to 3-MCPD and 3-MCPD plus apigenin treatment
2.5 芹菜素对3-MCPD致肾损伤大鼠分裂融合基因表达的影响
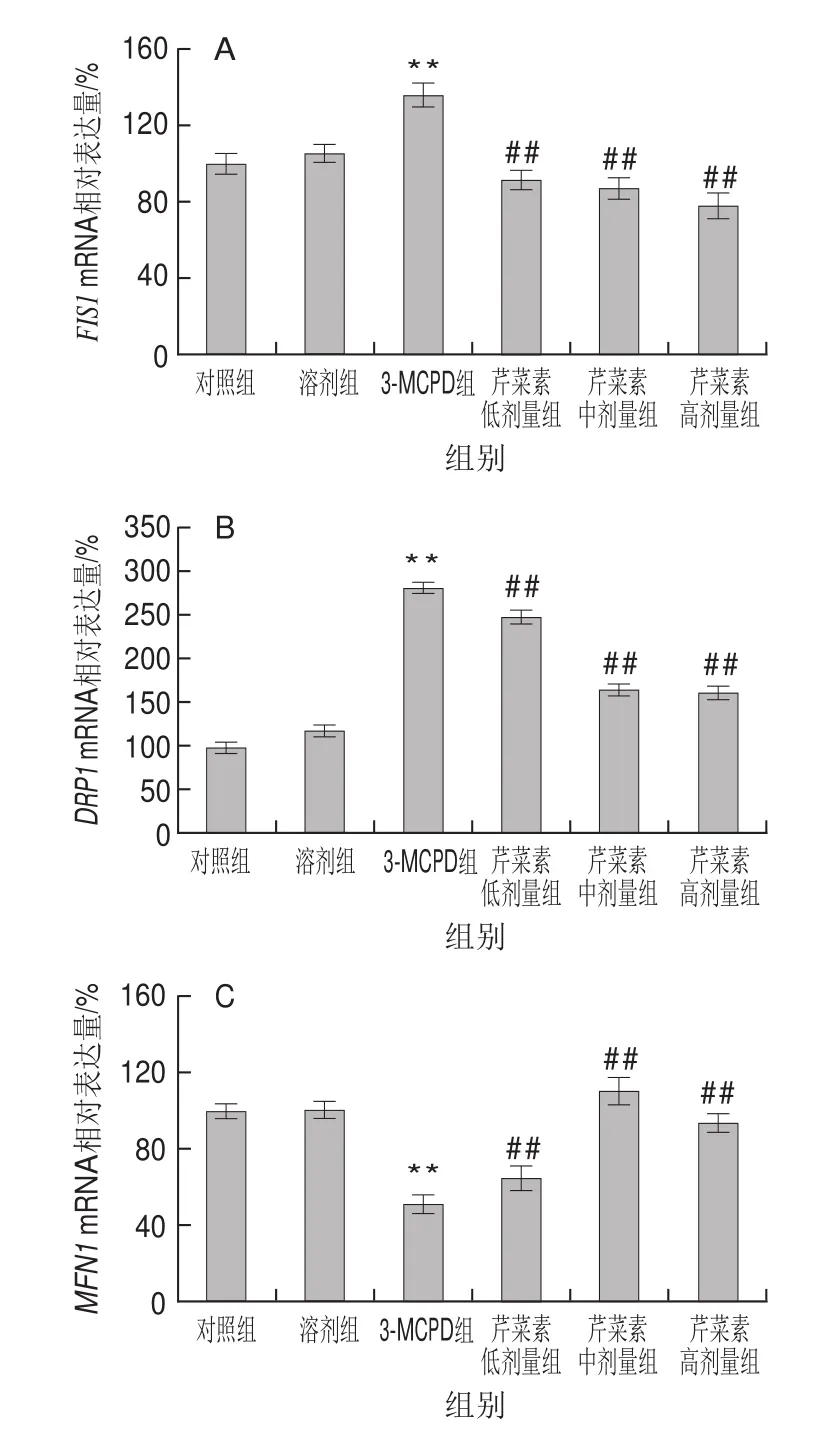
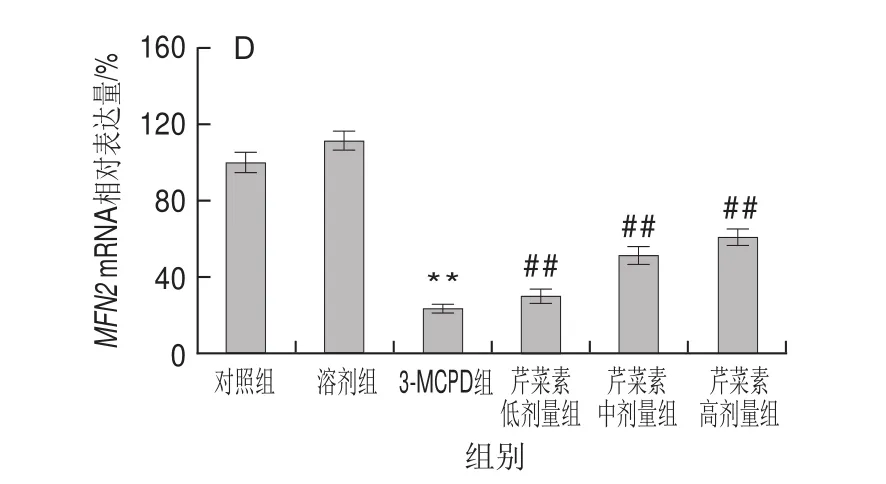
图5 3-MCPD、芹菜素和3-MCPD协同处理后大鼠FIS1(A)、DRP1(B)、MFN1(C)、MFN2(D)基因表达情况Fig.5 Expression of FIS1 (A), DRP1 (B), MFN1 (C) and MFN2 (D)genes in rats subjected to 3-MCPD and 3-MCPD plus apigenin treatment
相较对照组,3-MCPD组MFN1基因下调表达约49%(P<0.01),芹菜素保护组MFN1的基因表达量在3-MCPD组的基础上显著上调,其中高剂量芹菜素组的基因表达量增加了62%(P<0.01)(图5C);与MFN1基因表达一致,3-MCPD处理组的MFN2基因下调表达约76%,高剂量芹菜素使受抑制的MFN2基因表达显著回升,达到60%(P<0.01)(图5D)。与此相反,3-MCPD组大鼠线粒体分裂相关蛋白:FISI、DRP1基因表达较对照组、CMC组明显增加,其中DRP1的基因表达量同对照组相比增加了1倍,芹菜素使3-MCPD导致的FISI、DRP1基因的上调表达回落(P<0.01)(图5A、B)。研究结果表明芹菜素缓解了3-MCPD导致的线粒体过度分裂和融合抑制,表明芹菜素有利于维持线粒体动态平衡、正常结构和功能。
2.6 芹菜素对3-MCPD致肾损伤大鼠 NRF1、FISI、MFN2蛋白表达的影响
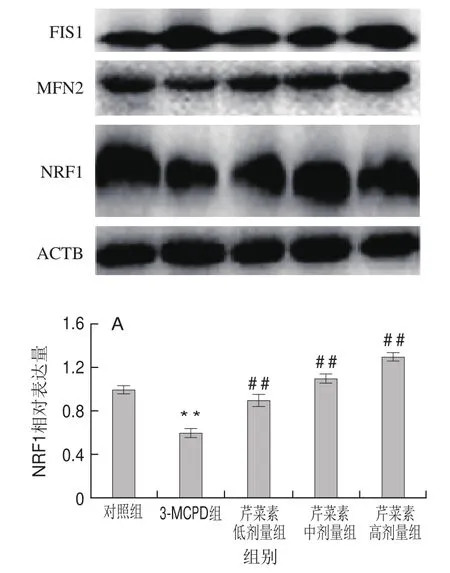
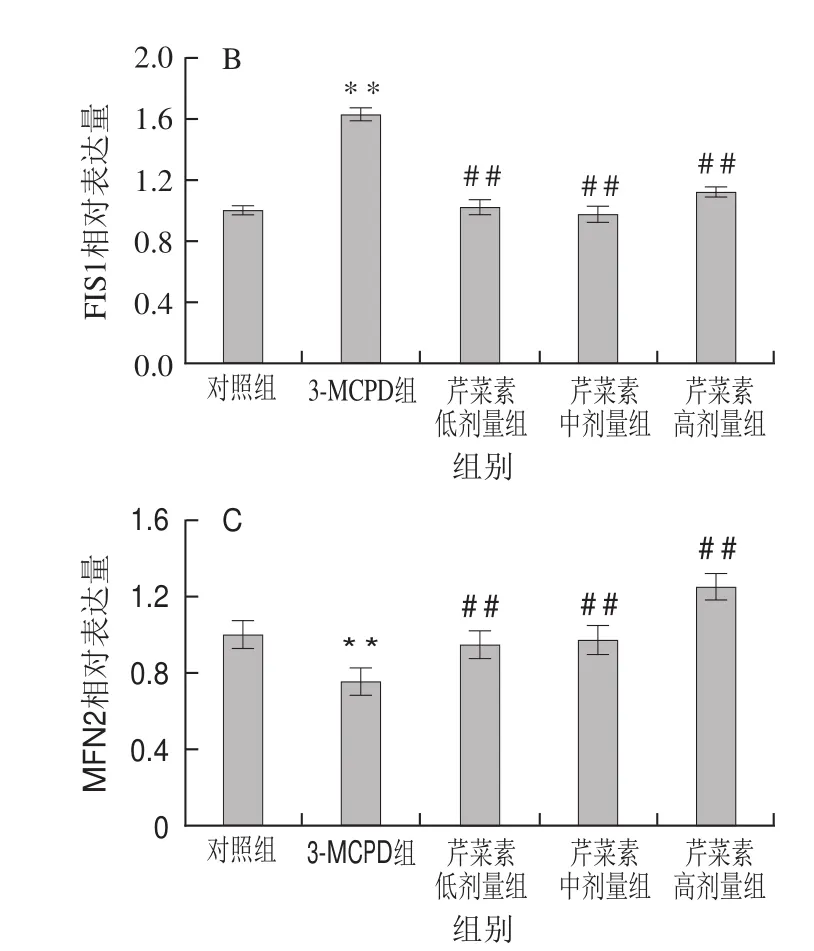
图6 3-MCPD、芹菜素和3-MCPD协同处理后大鼠NRF1(A)、FIS1(B)、MFN2(C)蛋白表达情况Fig.6 Expression of NRF1 (A), FIS1 (B) and MFN2 (C) proteins in rats subjected to 3-MCPD and 3-MCPD plus apigenin treatment
蛋白表达结果与基因表达结果一致,相对于对照组,3-MCPD组的大鼠线粒体合成因子NRF1蛋白表达下调了40%,而芹菜素协同3-MCPD处理的大鼠NRF1蛋白表达显著上调(P<0.01)(图6A)。3-MCPD组线粒体分裂蛋白FIS1的蛋白表达量上调了63%,线粒体融合蛋白MFN2水平下调表达了约25%,高剂量芹菜素致使3-MCPD诱导的FIS1蛋白下调到112%,MFN2蛋白上调到120%(P<0.01)(图6B、C)。这表明芹菜素能保护大鼠免受3-MCPD引起的线粒体合成受阻、线粒体融合降低、线粒体分裂增加,从而保证线粒体功能的有效运转。
3 讨 论
肝脏、肾脏、脑组织水肿和肥大可以侧面反映机体组织炎症蔓延及损伤情况[21]。随着灌胃剂量的增加与灌胃时间的延长,3-MCPD组SD雄性大鼠出现精神萎靡、食欲不振症状,肾脏质量指数、肝脏质量指数显著增加,其中肾脏质量指数增加幅度最大为11%。表明3-MCPD导致了严重的肾损伤,这与肾脏是3-MCPD作用的靶器官结论一致。芹菜素协同3-MCPD处理组的大鼠精神状态逐渐转好,肾组织大小、肾脏质量指数逐渐降低,其中,高剂量芹菜素保护组的肾质量指数从0.43%下降到0.35%,说明芹菜素可缓解3-MCPD引起的大鼠肾损伤,且该保护作用呈剂量依赖性关系。
肾脏组织病理学检查进一步证实了芹菜素对肾脏的保护作用。3-MCPD组的大鼠肾组织集合管、肾小球、肾小囊、肾小管均有不同程度的病变,另外,管腔中可见少量脱落的上皮细胞(绿色箭头);静脉血管内膜疏松、增厚(黄色箭头)。而高剂量芹菜素与3-MCPD协同处理组肾组织集合管的结构完整,上皮细胞排列较整齐。
仅次于心脏,肾脏是线粒体含量第二丰富的脏器,其生理功能的正常行使依赖于能量供给,也就依赖于细胞线粒体结构和功能的稳定[22]。当大量线粒体损伤时,线粒体自噬途径被激活,使得线粒体的数量不断被消耗,为维持线粒体稳定,细胞必须生成新的线粒体[23]。线粒体合成是一个复杂的过程,需要核基因组和线粒体基因组这两套基因组的协调配合。PGC-1是调节线粒体生物合成的关键性信号分子,然而当肾损伤发生时,PGC-1的表达被显著下调表达[24]。3-MCPD显著抑制了PGC1基因表达,其基因表达量下调了76%,然而芹菜素保护组PGC1表达量从24%增加到了116%,表明芹菜素对3-MCPD诱导的线粒体生物合成有一定的保护作用。作为PGC1的下游,线粒体合成时,NRF1被PGC1激活,NRF1可继续激活TFAM[25]。3-MCPD肾损伤组NRF1、TFAM表达量皆显著下调,而芹菜素组使NRF1表达量从44%增加到130%,TFAM表达量从62%增加到100%。芹菜素显著缓解了3-MCPD组大鼠线粒体合成相关因子的下调表达,保护了线粒体的生物合成,在一定程度上改善了大鼠肾损伤。
当细胞状态、代谢需求变化时,细胞中线粒体形态、定位也会随着改变。对于哺乳动物来说,即使线粒体网状结构很稳定的时候,细胞中的线粒体也在不停地进行着融合和分裂[26-29]。线粒体分裂蛋白有FIS1、DRP1、FIS1主要分布在线粒体外膜上,它通过募集DRP1开启线粒体分裂过程,然而过表达DRP1可导致线粒体的片段化[30]。线粒体融合蛋白MFN1、MFN2是一种高度保守的定位于线粒体外膜上的GTP酶[31]。正常细胞线粒体分裂和融合处于动态平衡,过度分裂或者融合受阻可引起线粒体片段化,线粒体的片段化可导致急性肾损伤。研究发现,3-MCPD组线粒体分裂蛋白FIS1、DRP1的基因和蛋白水平均显著上调,线粒体融合蛋白MFN1、MFN2的表达显著下调,但是芹菜素协同处理组,无论在蛋白水平上还是基因水平上,线粒体分裂蛋白表达显著下调,融合蛋白的表达呈剂量依赖性显著上调。芹菜素在一定程度上保护了3-MCPD导致的线粒体融合分裂异常,避免了线粒体的片段化,有效降低了3-MCPD的肾毒性。
综上,芹菜素通过缓解3-MCPD诱导的线粒体合成下降、线粒体过度分裂和融合受阻,显著改善了3-MCPD导致的SD大鼠食欲不振、精神萎靡、肾组织病变等状况,在一定程度上保护了3-MCPD诱导的肾损伤。

