不同栽培模式下豫北沙化土壤微生物量和酶活性
蔺 芳
(新乡学院 生命科学技术学院,河南 新乡 453000)
土壤微生物量是土壤有机质和养分转化与循环的重要驱动力,微生物量库对土壤肥力的提高具有重要作用[1-2]。土壤微生物量碳(SMBC)、土壤微生物量氮(SMBN)和土壤微生物量磷(SMBP)是植被所需碳、氮、磷的重要 “源”或 “库”,是综合评价土壤质量或肥力的重要指标,也是土壤生态系统变化的预警及敏感指标[3]。土壤酶是陆地生态系统功能的基础,可作为评价土壤质量的生物指标[4]。SMBC,SMBN,SMBP和土壤酶对土壤环境因子的变化十分敏感,土壤的微小变动均会引起其含量或活性的变化[5],当前,对土壤微生物量和酶活性的监测已成为所有生态体系研究必不可少的内容[6]。紫花苜蓿Medicago sativa是世界范围内人工草地栽培面积最大的豆科Leguminosae牧草,因其根瘤能够有效固定空气中的游离态氮而提高土壤肥力[7];无芒雀麦Bromus inermis是禾本科Gramineae优良的放牧型牧草,适口性好,营养价值高[8]。近年来,豆科和禾本科牧草栽培对人工草地中SMBC,SMBN,SMBP和土壤酶的影响已引起了众多研究者的格外关注[9],本研究就豫北地区紫花苜蓿单播、无芒雀麦单播和紫花苜蓿/无芒雀麦混播3种栽培模式下SMBC,SMBN,SMBP的质量分数及相关土壤酶活性进行了连续6 a的定位研究,旨在探寻既能满足豫北地区饲草优质高效生产,又能有效改良沙化土壤的人工草地栽培模式,以期为今后该地区人工草地的合理建植提供理论参考。
1 材料与方法
1.1 研究区概况
试验地河南省新乡市洪门镇原堤村(35°16′N,113°57′E),地处豫北平原,南临黄河,北面是余河通道,属黄河冲积平原,土壤沙化较为严重。该区属暖温带大陆性季风气候,年均气温为14.2℃,年均降水量为573.4 mm,年均日照时数为2 400 h,年均湿度为68.0%,无霜期为220 d。降水年际间分配不均,主要集中在7和8月。供试土壤类别为砂壤土,试验地0~40 cm土层基础理化性质见表1。
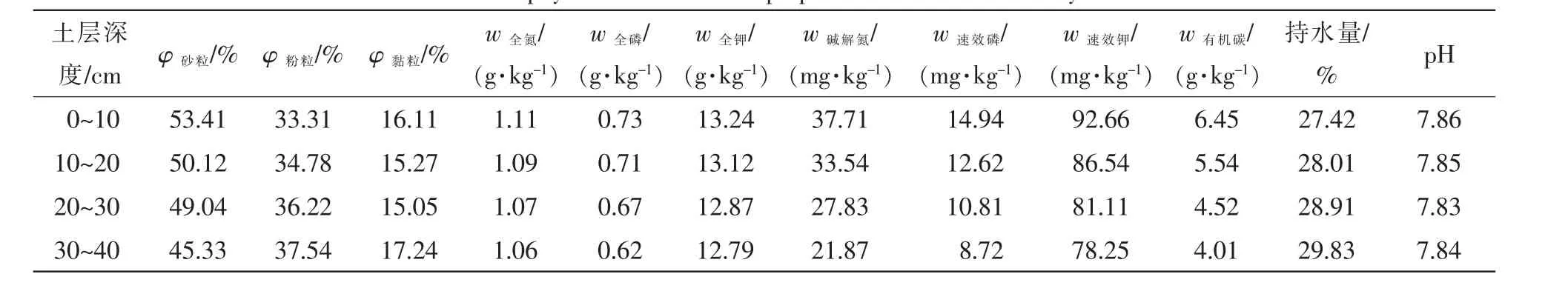
表1 试验地0~40 cm土层土壤基础理化性质Table 1 Soil basic physical and chemical properties in 0-40 cm soil layer at test site
1.2 试验设计
试验地总面积为720 m2,2012年10月用旋耕机进行整体旋耕作业,随后连续6 a进行播种试验。随机区组设计,重复3次·小区-1,共12个小区,各小区面积为20 m2(4 m×5 m),以沙化裸地为对照,设紫花苜蓿单播、无芒雀麦单播、紫花苜蓿/无芒雀麦混播3种不同的栽培模式;于2012年10月6日同时播种,紫花苜蓿的单播播量为15.0 kg·hm-2,无芒雀麦的单播播量为22.5 kg·hm-2,紫花苜蓿/无芒雀麦混播播量均为相应单播播量的一半。播种方式为条播,行距30 cm。试验期间免耕处理,不施用任何肥料,定期刈割牧草,5次·a-1,定期浇水与人工除草。
1.3 土壤样品采集及测定
1.3.1 土壤样品采集 2017年10月30日试验结束后,以五点取样法在各小区用土钻分层(0~10,10~20,20~30, 30~40 cm)取样。采集到的土样带回实验室,并剔除粗根和小石块,风干磨碎后过0.15mm孔筛,备用。
1.3.2 土壤生物学指标测定 各生物学指标按各测定方法[10]。SMBC采用氯仿熏蒸-硫酸钾浸提法测定;SMBN用氯仿熏蒸-茚三酮比色法测定;SMBP采用熏蒸提取-全磷法测定;脲酶用靛酚蓝比色法测定,以24 h后1.0 g土壤中氨态氮质量分数(mg·g-1)表示;蔗糖酶、淀粉酶用3,5-二硝基水杨酸比色法测定,以24 h后 1.0 g土壤中葡萄糖质量分数(mg·g-1)表示;碱性磷酸酶用磷酸苯二钠比色法测定,以1.0 g土壤中24 h后苯酚的质量分数(mg·g-1)表示;蛋白酶用茚三酮比色法测定,以1.0 g土壤中24 h后氨基氮的质量分数(mg·g-1)表示;β-葡糖苷酶活性用硝基苯比色法测定,以对硝基酚的质量分数(mg·g-1)表示;过氧化氢酶用紫外分光光度法测定,以20 min内1.0 g土壤中分解的过氧化氢的质量分数(mg·g-1)表示。
1.4 数据分析
数据经过Excel 2003整理和作图后,采用SPSS 24.0进行方差分析、回归分析和通径分析。不同栽培模式间各指标的差异采用单因素方差分析(one-way ANOVA)和最小显著差法(LSD)进行分析比较,各因子间的相关关系采用Pearson相关系数法进行评价,采用线性回归 “Linear”程序进行通径分析,所有数据均以3次重复的平均值±标准差来表示。
2 结果与分析
2.1 不同栽培模式下各土层土壤微生物量比较
由图1可知:各样地SMBC质量分数表现为283.71 mg·kg-1(紫花苜蓿/无芒雀麦混播)>207.51 mg·kg-1(紫花苜蓿单播)>188.71 mg·kg-1(无芒雀麦单播)>113.26 mg·kg-1(沙化裸地); SMBN 质量分数表现为 41.78 mg·kg-1(紫花苜蓿/无芒雀麦混播)>35.43 mg·kg-1(紫花苜蓿单播)>31.83 mg·kg-1(无芒雀麦单播)>18.99 mg·kg-1(沙化裸地); SMBP 质量分数表现为 18.65 mg·kg-1(紫花苜蓿/无芒雀麦混播)>16.55 mg·kg-1(紫花苜蓿单播)>14.79 mg·kg-1(无芒雀麦单播)>10.20 mg·kg-1(沙化裸地)。 与沙化裸地相比,3种栽培模式下SMBC,SMBN和SMBP质量分数均显著增加(P<0.05)。其中,土壤表层(0~20 cm)混播模式下SMBC,SMBN和SMBP质量分数较2种单播模式均呈显著差异(P<0.05),紫花苜蓿单播模式下SMBC,SMBN和SMBP质量分数显著大于无芒雀麦单播(P<0.05);土壤亚表层(20~40 cm)混播模式较2种单播模式也均呈显著差异 (P<0.05),但2种单播模式的SMBC,SMBN和SMBP质量分数差异不显著(P>0.05)。
从土壤剖面来看,沙化裸地和3种栽培模式下SMBC,SMBN和SMBP质量分数整体表现为土壤表层(0~20 cm)高于亚表层(20~40 cm), 呈表聚性特征。
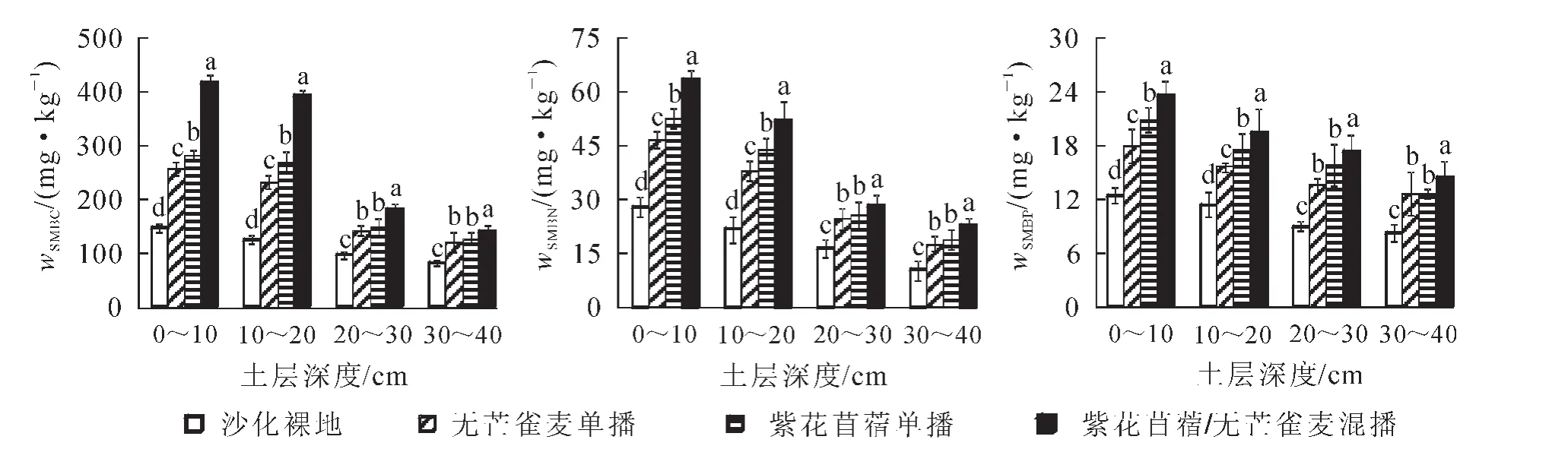
图1 不同栽培模式下土层中土壤微生物量比较Figure 1 Comparison of soil microbial content in different cultivating patterns
2.2 不同栽培模式下各土层土壤酶活性比较
表2可以看出:不同栽培模式下土壤7种酶(脲酶、蔗糖酶、碱性磷酸酶、蛋白酶、淀粉酶、β-葡萄糖苷酶和过氧化氢酶)活性从高到低均依次为紫花苜蓿/无芒雀麦混播、紫花苜蓿单播、无芒雀麦单播和沙化裸地,与沙化裸地相比,3种栽培模式下7种酶活性均不同程度增加(P<0.05)。
具体来说,与单播相比,各土层紫花苜蓿/无芒雀麦混播模式下脲酶和蔗糖酶活性均显著增加(P<0.05), 土壤表层(0~20 cm)紫花苜蓿单播较无芒雀麦单播显著增加(P<0.05), 亚表层(20~40 cm)2 种单播则差异不显著(P>0.05)。各土层3种栽培模式下碱性磷酸酶活性差异不显著(P>0.05)。与单播相比,各土层紫花苜蓿/无芒雀麦混播模式下蛋白酶和淀粉酶活性均显著增加(P<0.05),但2种单播之间差异不显著(P>0.05)。各土层混播和紫花苜蓿单播模式下β-葡萄糖苷酶活性较无芒雀麦单播呈显著增加(P<0.05),但混播和紫花苜蓿单播之间差异不显著(P>0.05);较无芒雀麦单播,混播和紫花苜蓿单播使土壤表层(0~20 cm)β-葡萄糖苷酶活性显著增加(P<0.05),但混播和紫花苜蓿单播之间差异不显著(P>0.05)。此外,土壤7种酶的活性均随着土层深度的增加而减小。

表2 不同栽培模式下土层土壤7种酶活性Table 2 7 soil enzyme activities in different soil layers under different cultivating patterns
2.3 不同栽培模式下土壤微生物量和土壤酶的相关性分析
对土层中SMBC,SMBN,SMBP与土壤酶活性的相关性分析可知(表3):SMBC(y1),SMBN(y2)和SMBP(y3)彼此之间极显著正相关(P<0.01); 土壤脲酶(x1)、 蔗糖酶(x2)、 碱性磷酸酶(x3)、 蛋白酶(x4)、淀粉酶(x5)、 β-葡萄糖苷酶(x6)和过氧化氢酶(x7)彼此之间也表现出了极显著正相关(P<0.01); SMBC 和SMBN均与土壤脲酶、碱性磷酸酶、蛋白酶、淀粉酶、β-葡萄糖苷酶和过氧化氢酶呈极显著正相关(P<0.01),与蔗糖酶显著正相关(P<0.05);SMBP与土壤7种酶均极显著正相关(P<0.01)。
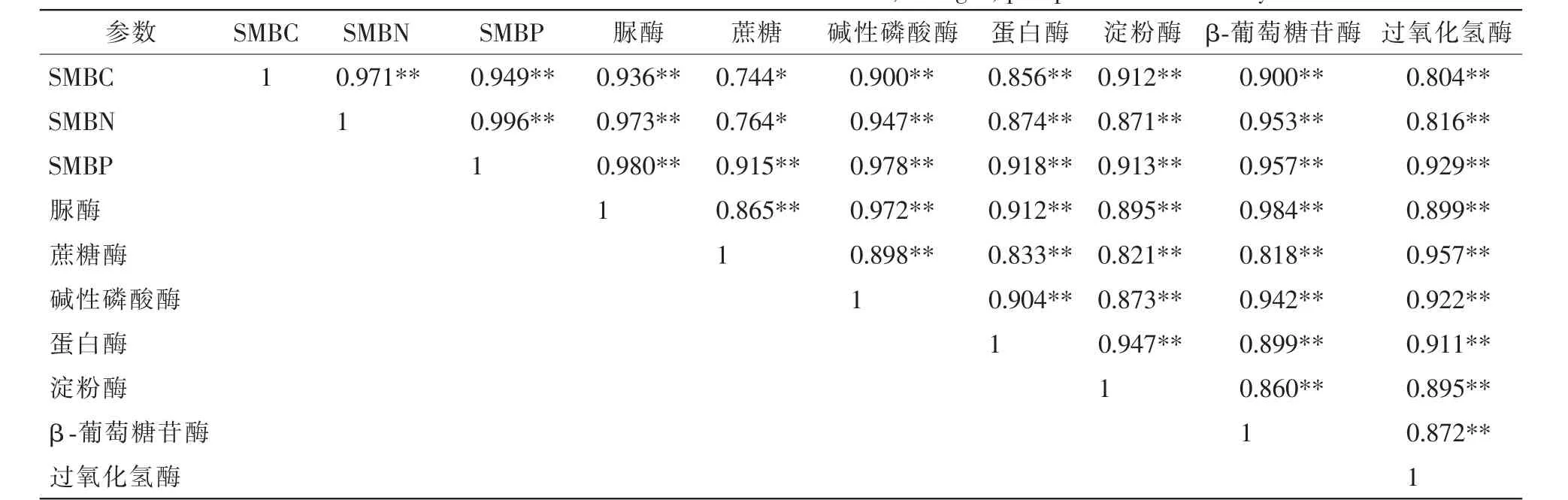
表3 土壤微生物量碳氮磷和土壤酶的相关性分析Table 3 Correlation between soil microbial biomass carbon,nitrogen,phosphorus and soil enzyme
2.4 不同栽培模式下土壤微生物量和土壤酶的逐步回归分析和通径分析
对SMBC相关的7个土壤酶经逐步回归分析,剔除次要影响因素过氧化氢酶(x7)和碱性磷酸酶(x3),剩余的5个酶与SMBC(y1)存在极显著线性关系,其回归方程为y1=754.492x1-18.909x2-13.309x4+311.551x5-48.216x6+72.325,该方程达极显著水平,检验值F=75.779,R2=0.952;对SMBN相关的7个土壤酶经逐步回归分析,剔除次要影响因素过氧化氢酶(x7)、蛋白酶(x4)和淀粉酶(x5),剩余的4个酶与SMBN(y2)存在极显著线性关系,其回归方程为y2=98.297x1-3.308x2+36.871x3-5.087x6-5.867,该方程达极显著水平,检验值F=249.808,R2=0.981;对SMBP相关的7个土壤酶经逐步回归分析,剔除次要影响因素脲酶(x1)和蛋白酶(x4),剩余的5个酶与 SMBP(y3)存在极显著线性关系,其回归方程为y3=0.817x2+9.170x3+5.215x5+1.130x6-2.459x7+6.289,该方程达极显著水平,检验值F=273.483,R2=0.986。
通径分析(表4)进一步表明:各因素对SMBC的直接通径系数按绝对值从大到小排序为脲酶、淀粉酶、β-葡萄糖苷酶、蔗糖酶和蛋白酶。脲酶对SMBC的直接通径系数最大(1.674),有强烈的正直接作用,尽管其他酶表现出对SMBC的负间接作用,但最终表现为正效应;结合脲酶且SMBC有极显著相关性,说明脲酶是影响SMBC的主要因素。蔗糖酶、蛋白酶和β-葡萄糖苷酶对SMBC都表现出较大的负效应,但受到其他酶的间接正效应,最终表现为正效应,与相关系数表现一致。淀粉酶对SMBC直接通径系数为0.646,间接通径系数总和为0.266,说明淀粉酶通过其他酶使得对SMBC的正效应进一步增强。
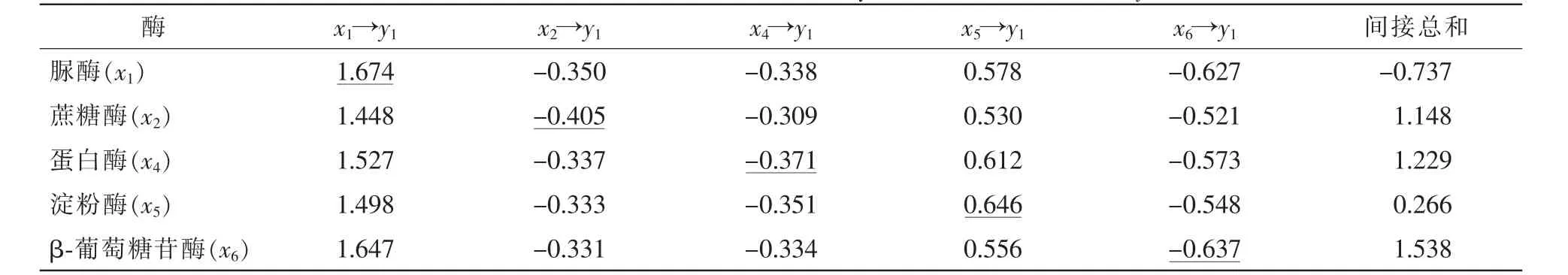
表4 土壤相关酶对微生物量碳(y1)的通径系数Table 4 Path coefficient of soil related enzymes to microbial carbon(y1)
表5所示:各因素对SMBN的直接通径系数按绝对值从大到小排序为脲酶、蔗糖酶、β-葡萄糖苷酶和碱性磷酸酶。脲酶对SMBN的直接通径系数很大(1.416),有强烈的正直接作用,尽管其通过其他酶表现出对SMBN的负间接作用,但最终表现为正效应;结合脲酶与SMBN的极显著相关性,说明脲酶是影响SMBN的主要因素。蔗糖酶对SMBN呈负效应,但是其通过其他酶的间接正效应,使得最终总和表现为正效应。碱性磷酸酶对SMBN的直接通径系数只有0.396,而其通过其他因子对SMBN的间接通径系数却达0.552,说明碱性磷酸酶主要是通过其他酶的间接作用来影响SMBN的。β-葡萄糖苷酶对SMBN表现出直接的负效应,但是其通过其他因子表现出的正效应抵消了直接的负效应,最终表现为很强的正效应。
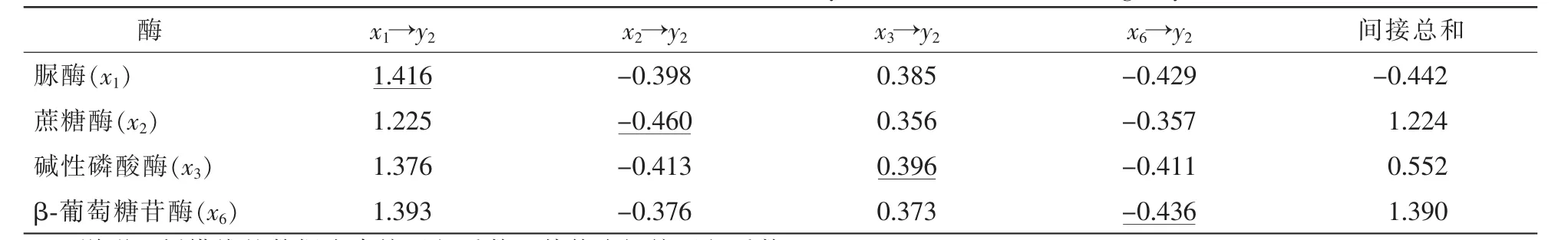
表5 土壤相关酶对土壤微生物量氮(y2)的通径系数Table 5 Path coefficient of soil related enzymes to soil microbial nitrogen(y2)
表6所示:各因素对SMBP的直接通径系数按绝对值从大到小排序为蔗糖酶、碱性磷酸酶、β-葡萄糖苷酶、过氧化氢酶和淀粉酶。土壤蔗糖酶、碱性磷酸酶、淀粉酶和β-葡萄糖苷酶对SMBP的直接和间接通径系数都为正,说明在土壤中它们对SMBP不仅表现出直接的正效应,还通过其他相关酶来加强这种正效应。过氧化氢酶对SMBP表现出负效应,但是受其他因子较大的间接正效应,最终表现为正效应。
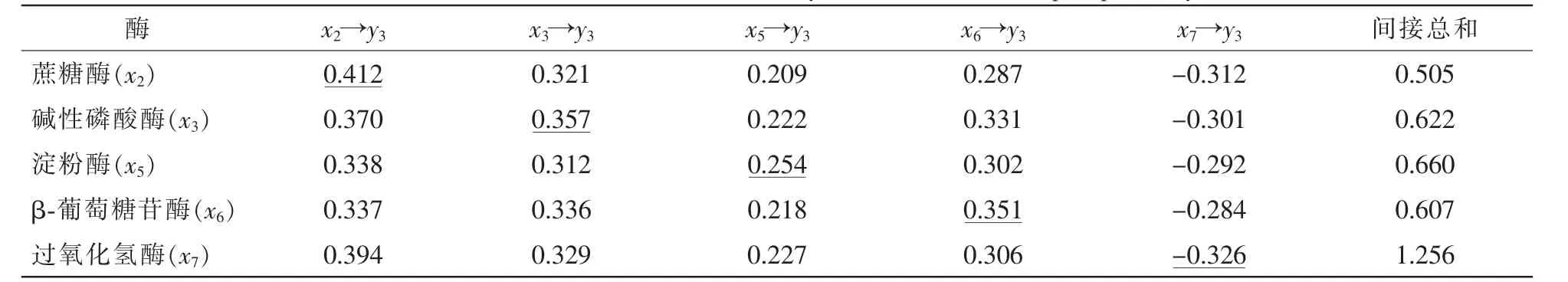
表6 土壤相关酶对土壤微生物量磷(y3)的通径系数Table 6 Path coefficient of soil related enzymes to soil microbial phosphorus(y3)
3 讨论与结论
3.1 不同栽培模式对土壤微生物量的影响
本研究中,人工草地建植6 a后,与沙化裸地相比,3种栽培模式下SMBC,SMBN和SMBP质量分数均显著性增加,从高到低依次为紫花苜蓿/无芒雀麦混播、紫花苜蓿单播、无芒雀麦单播。无芒雀麦单播的土壤微生物量最低,一方面是因为该模式下长期向外输出生物量而输入不足(试验期间未施肥且牧草均定期刈割),导致土壤微生物能源的缺乏;另一方面是因为经过连续多年栽培,无芒雀麦单播土壤养分输出较多,不利于土壤微生物的生长繁殖,其土壤微生物的储量和活性均很低。由于紫花苜蓿的生物固氮作用,紫花苜蓿单播和混播可改善土壤养分状况,提高土壤微生物量。相对于单播,混播模式下植物生长更加旺盛,不仅可以为土壤系统输入更多的有机残体,还可以通过改善土壤微生物生长的微环境,提供更多的营养物质和能源物质以提高微生物活性[11],进而提高土壤微生物量。
本研究中,3种栽培模式下SMBC,SMBN和SMBP质量分数均表现为土壤表层大于亚表层,呈现表聚性。这是因为表层土壤水热和通气状况较好,表层中细根和凋落物的快速周转,有利于微生物生长和繁殖,增强了土壤养分的生物有效性[12];随着土层的加深,微生物生境条件变差,微生物生物量的分布受到影响,因而其土壤微生物量明显低于表层[13]。
3.2 不同栽培模式对土壤酶活性的影响
本研究中,相较于沙化裸地,单播和混播模式下7种土壤酶活性较高,从高到低依次为紫花苜蓿/无芒雀麦混播、紫花苜蓿单播、无芒雀麦单播、沙化裸地,得益于紫花苜蓿和无芒雀麦根茬和根系分泌物对土壤酶活性的促进[14];紫花苜蓿单播模式大于无芒雀麦单播模式,究其原因,一方面是因为紫花苜蓿的生物固氮作用[15],对脲酶和蛋白酶活性的影响较大,促进土壤氮素转化;另一方面,紫花苜蓿根系的根瘤菌会提升土壤中的腐殖质含量,促进蔗糖酶、淀粉酶和β-葡萄糖苷酶的活性[16],从而提高土壤碳素转化效率,同时促进碱性磷酸酶和过氧化氢酶活性[17],对土壤有机磷转化、土壤微生物活动强度提高均有益。相比而言,紫花苜蓿/无芒雀麦混播对7种土壤酶活性效果更显著,这可能是混播模式中紫花苜蓿和多年生黑麦草共生,调节了其根系分泌和根茬腐解的作用,促进了根系的碳代谢生理,使这7种土壤酶活性处于较高水平,表现出与SMBC,SMBN和SMBP同样的变化规律,说明7种土壤酶与SMBC,SMBN,SMBP的关系较为密切。从土壤垂直分布来看,7种土壤酶活性均表现为表层较高,主要是因为表层土壤与大气相连,其温度和通透性更好[18],从而为微生物的良好生长提供更有利的条件[19]。
3.3 SMBC,SMBN,SMBP和土壤酶的相互关系
本研究中,SMBC和SMBN与土壤脲酶、碱性磷酸酶、蛋白酶、淀粉酶、β-葡萄糖苷酶和过氧化氢酶呈极显著正相关(P<0.01),与蔗糖酶呈显著正相关(P<0.05);SMBP与7种酶均呈极显著正相关(P<0.01)。分析原因为土壤酶是由土壤中的细菌、真菌和植物根部分泌[20],直接参与土壤中物质和能量转化[9],其活性在一定程度上能表征土壤生物氧化过程的强弱[6],反映土壤微生物活动的强度,进而影响土壤微生物量的高低。
本研究通过逐步回归分析对土壤酶彼此之间的显著相关关系进行了量化,发现入选的因子(土壤酶)对SMBC,SMBN,SMBP的决定系数高达0.952,0.981和0.986,均达极显著水平,表明筛选的影响因子真实可靠。具体来说,对SMBC的直接贡献效应因子为脲酶、淀粉酶、β-葡萄糖苷酶、蔗糖酶和蛋白酶,对SMBN的直接贡献效应因子为脲酶、蔗糖酶、β-葡萄糖苷酶和碱性磷酸酶,对SMBP的直接贡献效应因子为蔗糖酶,碱性磷酸酶,β-葡萄糖苷酶,过氧化氢酶和淀粉酶。
3.4 结论
豫北地区人工草地建植6 a后,与沙化裸地相比,土壤脲酶、蔗糖酶、碱性磷酸酶、蛋白酶、淀粉酶、β-葡萄糖苷酶和过氧化氢酶活性得到了提高,土层SMBC,SMBN和SMBP的积累明显,从高到低均依次为紫花苜蓿/无芒雀麦混播、紫花苜蓿单播、无芒雀麦单播;SMBC,SMBN和SMBP与土壤7种酶均呈显著或极显著相关;通径分析表明:脲酶是影响SMBC和SMBN的首要因子,蔗糖酶是影响SMBP的首要因子。可见,在豫北地区实施人工草地建植可以有效改良土壤,紫花苜蓿/无芒雀麦混播是最佳的种植模式。
——黔南扁穗雀麦

