超声联合CT诊断家族性甲状腺微小乳头状癌的价值
高培蓉,张震
(中国医科大学附属第一医院超声科,沈阳 110001)
甲状腺乳头状癌是最常见的甲状腺癌,约占甲状腺癌80%以上[1],其中最常见的亚型为甲状腺微小乳头状癌 (papillary thyroid microcarcinoma,PTMC)。PTMC是指直径≤1.0 cm的甲状腺乳头状癌,在所有新发的甲状腺乳头状癌中约有50%为PTMC,其中女性发病率显著高于男性。
家族性甲状腺乳头状癌是指一级亲属中有2例或2例以上甲状腺乳头状癌的患者[2],其发病率约占甲状腺恶性肿瘤的5%~15%。家族性PTMC的致病原因与散发性PTMC相同,只是具有一定的家族聚集现象,其中主要由遗传和环境两大因素导致[3]。此外,长期的高碘饮食、促甲状腺激素的刺激作用、性激素水平失调等也发挥一定的作用。但家族性PTMC更具侵袭性,局部复发和颈部淋巴结转移也较单病灶甲状腺微小癌更为常见,影像学恶性特征更为隐匿,对术式和预后有较大影响。
在PTMC的影像学检查方法中,超声诊断PTMC的准确率、灵敏度和特异度分别为94.62%、92.11%和96.36%[4],并且因其具有无创性、经济性、无辐射等优点而最为常用。形态不规则、低回声、纵横比>1及砂粒样微钙化对PTMC的诊断具有较高的价值[5]。64排CT能够明显提高PTMC颈部淋巴结转移的检出率,高频超声联合64排螺旋CT的诊断准确率明显高于单用任何一种[6],因此这2种影像学检查在诊断PTMC时最为常用。本文通过回顾性分析同一家族内3例PTMC中的影像学表现,探讨PTMC家族史对预判甲状腺结节良恶性的价值,为进一步提高家族性PTMC的诊断率提供参考和依据。
1 材料与方法
1.1 患者一般情况
收集2017年2月于我院体检发现并入院治疗的3例家族性PTMC患者的病历资料。3例患者分别为母亲 (病例1)、女儿 (病例2) 和儿子 (病例3),男∶女=1∶2,年龄39~63岁,平均年龄 (47.6±10.9) 岁。3例患者均长期居住于辽宁省海城市。患者术前均进行超声和CT检查。
1.2 PTMC诊断标准
1.2.1 超声诊断标准:超声诊断甲状腺结节的标准参考甲状腺影像报告与数据系统 (thyroid imaging reporting and data system,TI-RADS) 分级,TI-RADS是在乳腺影像报告与数据系统分级基础上提出的,根据结节的大小、形态、边界、内部回声、后方回声、血供等进行分类。我院分级标准参考詹维伟等[7]建立的TI-RADS分级诊断标准。1 级:正常甲状腺;2级:良性结节,恶性风险0%;3级:良性可能性大,恶性风险≤5%;4级:可疑结节,包括4a级 (低度恶性风险>5%~20%,具有1 个恶性特征)、4b级 (中度恶性风险>20%~50%,具有2个恶性特征)、4c级 (高度恶性风险>50%~90%,具有3~4个恶性特征);5级:恶性风险>90%,具有5~6个恶性特征或结节发现时已有颈部淋巴结转移;6级:恶性结节,已得到病理证实。我院临床工作中把TI-RADS 2、3、4a级评判为偏良性病变,TI-RADS 4b、4c、5级评判为偏恶性病变。
1.2.2 CT诊断标准:边缘模糊的实性结节、钙化 (尤其是砂粒样微钙化)、强化明显 (仍低于邻近甲状腺组织),增强后显示病灶范围减小、中心结节状强化及周边密度较低,包膜侵犯,可能出现多发病灶及淋巴结转移,以上1种或多种征象提示甲状腺癌。
2 结果
2.1 二维超声
3例患者术前超声检查 (图1) 均观察到实性低回声或稍低回声结节。均位于腺体中部,2例位于左侧,1例位于右侧。边缘清晰2例,欠清晰1例,伴有不同程度的不典型微钙化及粗大钙化。1例病灶纵横比>1,2例病灶纵横比<1。TI-RADS分级为4a 1例,4b 2例。见表1。

图1 3例家族性PTMC患者的超声图像

表1 3例家族性PTMC患者的超声特点
2.2 平扫与增强CT
3例患者术前CT检查 (图2)均观察到甲状腺类圆形低密度影,2例边缘模糊伴弱强化,1例边缘清晰伴明显强化。1例显示点状钙化,其余2例未显示钙化。2例提示恶性,1例提示良性。
2.3 术式及病理
3例患者均进行患侧全切伴患侧Ⅵ区淋巴结清扫术。病例2术中发现伴有LR6 (1/5) 淋巴结转移,故同时行对侧部分切除术。术后病理 (图3) 显示肿瘤直径均≤1.0 cm,且均证实为PTMC。见表2。
3 讨论
本文3例家族性PTMC患者的影像学特点为实性低回声结节,纵横比>1,砂砾样微钙化,形态不规则,边界不清等。
PTMC病理学特征与内部回声具有相关性,本组3例PTMC患者均表现为低回声是由于癌细胞体积较大,分化程度低,间质成分重叠少,透声较好,在声像图中无法形成强烈的反射界面。纵横比>1是一种与肿瘤生长方式相关的指标,在肿瘤早期,前后方向的癌细胞大多增殖较左右方向更活跃,导致肿瘤前后径大于左右径。微钙化指直径<1 mm的钙化,是由于癌组织生长过快,营养供应不足导致细胞凋亡、坏死所产生的钙盐沉积。有研究[8]发现,PTMC中微钙化率高达78.43%,微钙化诊断PTMC特异性高于90%。形态不规则、边界不清晰则是由于癌组织向周围组织迁移、侵袭的能力不同,形成癌组织与周围组织的过渡带。
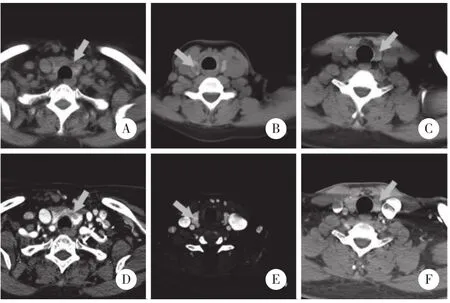
图2 3例家族性PTMC患者的平扫及增强CT
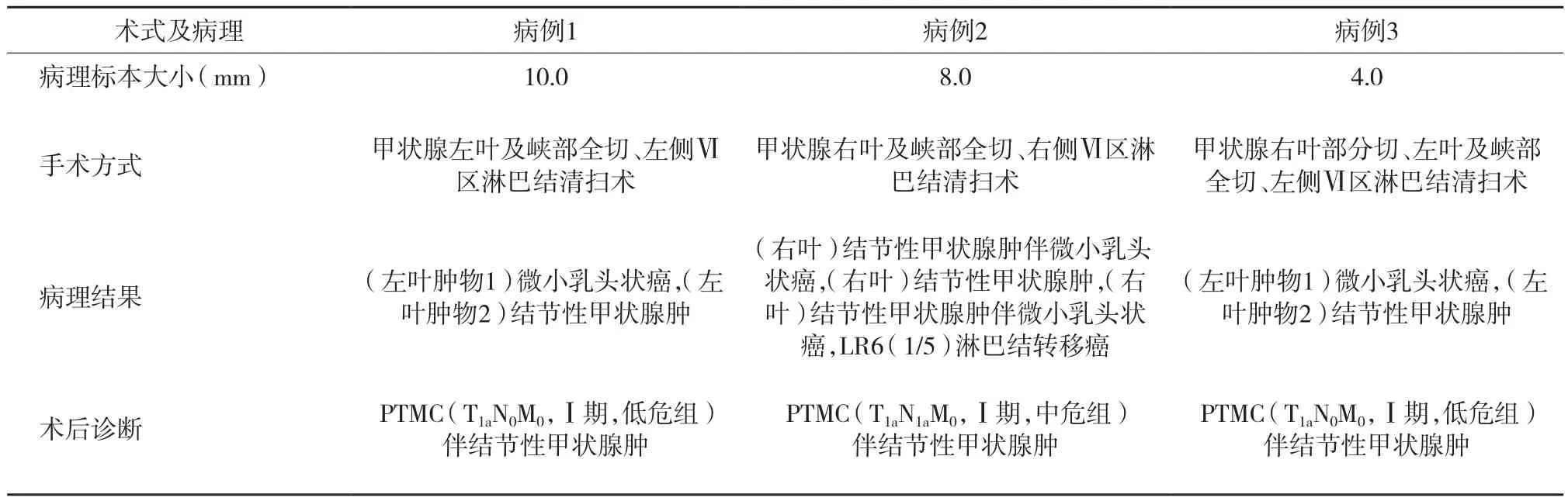
表2 3例家族性PTMC患者的术式和病理诊断
本组3例PTMC患者术前超声及CT检查中,2例超声诊断为TI-RADS 4b级,为中度可疑恶性。对应的CT表现为结节状低密度影,边界模糊,增强扫描强化欠均匀,呈弱强化,其内点状钙化等特点,提示怀疑恶性。超声和CT均发现2例恶性结节影像学特征性表现,诊断较为精准,术后病理证实2例均为PTMC。
1例PTMC术前误诊,超声诊断为TI-RADS 4a级,即低度可疑恶性,并且CT检查强化明显,诊断为腺瘤样结节,2种检查均提示为良性。术后病理证实为PTMC伴颈部中央区淋巴结转移。误诊的可能原因:(1) 结节内部伴彗尾状微钙化,彗尾状微钙化是甲状腺良性结节在超声图像中的特征表现; (2) 结节后方无衰减,说明结节硬度较小,与恶性结节特征不相符; (3) 结节边缘及内部可见多处条状血流,CT增强扫描强化明显,在2017年美国TI-RADS分级标准中,彩色血流未被纳入诊断标准; (4) PTMC多与桥本氏甲状腺炎、结节性甲状腺肿同时存在,在超声检测中常存在声像重叠现象; (5) 检查者没有足够重视患者的家族史,单从结节本身的特性判断其良恶性质,从而降低可疑结节的恶性程度; (6) 超声和CT诊断小结节本身存在难度,PTMC体积过小,诊断更加困难; (7) 家族性PTMC影像学特征更加隐匿,诊断更加困难。因此,有必要对家族性PTMC影像学特征进行补充。
3例病例包括母亲及其子、女,符合MUSHOLT[2]提出的家族性PTMC的诊断。其中1例误诊病例在术前就已发生颈部淋巴结转移,提示家族性甲状腺癌比散发性甲状腺癌具有更强的侵袭性,更容易出现早期淋巴结转移和复发[9]。相比母亲确诊PTMC时的年龄,子女的确诊年龄明显提前。且母亲与女儿甲状腺为单发结节,儿子为多发结节,这与PARK等[10]和高健等[11]研究结果一致,即家族性非髓样甲状腺癌患者第二代比第一代确诊年龄更早,且更容易出现多癌灶及中央区淋巴结转移。这提示在PTMC影像学诊断中应该重视家族史的询问及筛查,临床工作中对类似患者的术式选择也具有指导意义。
因此,家族史或可以作为超声及CT判断甲状腺恶性结节的一项指标,以提高具有家族史PTMC患者的检出率,为家族性PTMC患者的早期诊断和治疗提供依据。当患者具有PTMC家族史、结节本身没有恶性特征而提示TI-RADS 3级时,可考虑升级为TI-RADS 4a级;当结节本身有一项恶性特征而符合TI-RADS 4a级的诊断时,可考虑升级为TI-RADS 4b级,以此类推。
大量临床病例证实,甲状腺乳头状癌淋巴结转移不影响患者的存活率,但转移淋巴结可显著增加术后的局部复发率。本组3例患者目前仍在随访,至今未发现复发和淋巴结转移,预后良好,说明家族性PTMC可用单例PTMC的术式进行替代治疗。
综上所述,由于家族性PTMC更具隐匿性和侵袭性,在影像学诊断PTMC时,需结合患者的家族史等“隐性”特征,将其纳入TI-RADS分级的恶性风险评估中,TI-RADS 分级为3级及以下的患者如无症状无须治疗,超声定期复查即可,TI-RADS分级4级及以上的患者,需结合超声造影或甲状腺细针穿刺术等检查以明确诊断,尽可能避免误诊和漏诊,进一步提高家族性PTMC的早期诊断率,这对家族性PTMC的术式和预后也具有一定的指导意义。

