土壤理化性质和微生物活性对水田改果园的动态响应
杨东伟, 章明奎, 刘千千, 张鹏启, 李 雪, 董 静, 黄 笑
(1.浙江大学 环境与资源学院, 浙江 杭州 310058;2.河南师范大学 旅游学院, 河南 新乡 453007; 3.广西大学 商学院, 广西 南宁 530004)
土地利用方式的改变是全球环境变化的主要原因之一,并对生态系统服务造成重要影响[1]。水稻田是承载着中华文明的人工湿地生态系统,在维持我国粮食安全和环境健康方面具有积极意义和重要的生态服务价值。近30 a来,随着我国农业产业结构调整,一些地区大面积水田改种果树、苗木等经济林木。水田改果园后,土地耕作制度改变,土壤水分状况和通气性发生明显变化,从而引起土壤环境因子和土壤微生物性质的变化。土壤微生物作为生命元素循环的驱动者,是陆地生态系统中最活跃的成分,被称为地球关键元素循环过程的引擎[2],在土壤有机质分解和生态系统养分循环过程中发挥着关键作用,影响植被的发育和演替[3],进而影响景观和生态系统的变化[4-5]。土壤微生物对其生存环境的质量状况具有重要的指示作用,能够快速对土壤系统过程中的环境改变做出反应,是土壤生态系统变化的预警及敏感指标[2,6]。以往一些学者对水田改旱作后土壤基本理化性质的演变进行了研究,表明水田改旱作后土壤pH值、有机质、微生物生物量下降[7-11],而有关水田改为果园后土壤理化性质及微生物活性的动态响应规律,以及土壤环境因子之间关联性研究还比较缺乏。本文以浙江省水网平原为研究区,采用时空互代法,建立后切型时间序列,探讨土壤微生物特性及环境因子对水田改果园的动态响应规律,以期为进一步研究土地利用变化对土壤生态环境的影响,预测水田改果园后土壤质量的长期变化趋势提供科学依据。
1 材料与方法
1.1 研究区域
研究区域位于浙江省宁波市余姚市黄家埠镇上塘村,地理坐标位于30°7′13″—30°7′25″N和120°56′25″—120°56′40″E之间,属于中北亚热带季风气候过渡带,平均气温为15.0~18.1 ℃,多年平均降水量在1 060~2 000 mm之间,雨日150~190 d,成土母质为浅海沉积物,采样点海拔在3~4 m之间[12]。
1.2 土样采集
根据野外土地利用现状和分布数量,确定不同类型土壤样本的采集数量;共采集18个耕层土壤样本(0—12 cm),对应18个田地,其中水田样本3个,果园土壤样本15个(种植果树年限详见表3),采集的果园土壤在植树之前均为水田。依据第二次土壤普查资料,目前种植水稻的土壤在发生分类中属于潴育型水稻土亚类,粉泥田土属,粉泥田土种[12]。水田与果园位置相邻,果园土壤目前种植梨树(梨树种植年限在4~20 a之间),供试土壤黏粒含量在219.63~241.31 mg/kg之间。每个样地设置5个重复进行观察与取样,采用多点混合取样法采集土壤样品。采集的土样分为两部分:一部分带回实验室风干处理,分别过2,0.25和0.15 mm土筛,用于土壤理化指标和土壤酶活性测定;另一份置于冰盒中带回实验室,放入4 ℃冰箱,一周内完成土壤微生物生物量和土壤含水率等的测定。土地利用方式及土壤施肥量等信息详见表1。
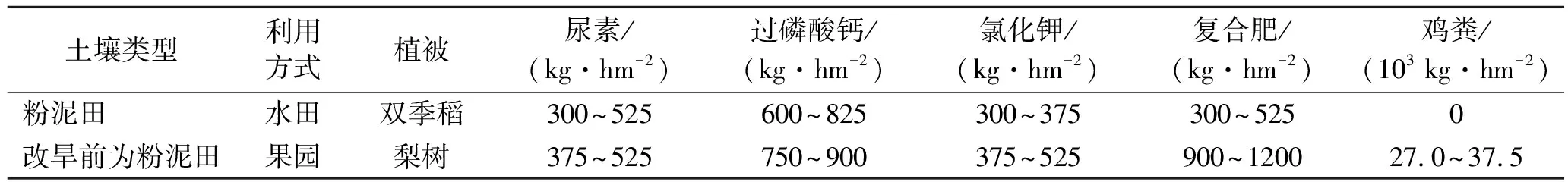
表1 水田和果园土壤施肥量
1.3 测定项目与方法
土壤含水率、pH值、>0.25 mm水稳性团聚体、盐基饱和度、土壤颗粒组成、有机质、全氮、碱解氮、全磷、有效磷、全钾、速效钾等基本理化性质采用土壤标准测定方法进行,具体测定步骤见参考文献[13]。土壤微生物生物量碳氮采用氯仿熏蒸—K2SO4浸提法,土壤脲酶活性测定采用苯酚钠比色法,土壤酸性磷酸酶活性测定采用磷酸苯二钠比色法,土壤过氧化氢酶活性测定采用滴定法[14]。
1.4 数据分析与计算方法
采用Excel和Origin 8.0制图,SPSS 10.0进行相关性分析。
土壤微生物熵=1.724×土壤微生物生物量碳/土壤有机质
2 结果与分析
2.1 水田改果园对土壤物理性质的影响
水田改果园后土壤含水率明显下降,并与植树年限呈极显著(p<0.01)负相关(图1)。
水田改果园后土壤>0.25 mm水稳性团聚体明显下降,水田土壤中土壤>0.25 mm水稳性团聚体平均含量为68.3%,改果园后下降到52.8%,降幅达到22.7%,并与植树年限呈极显著(p<0.01)负相关(图1)。
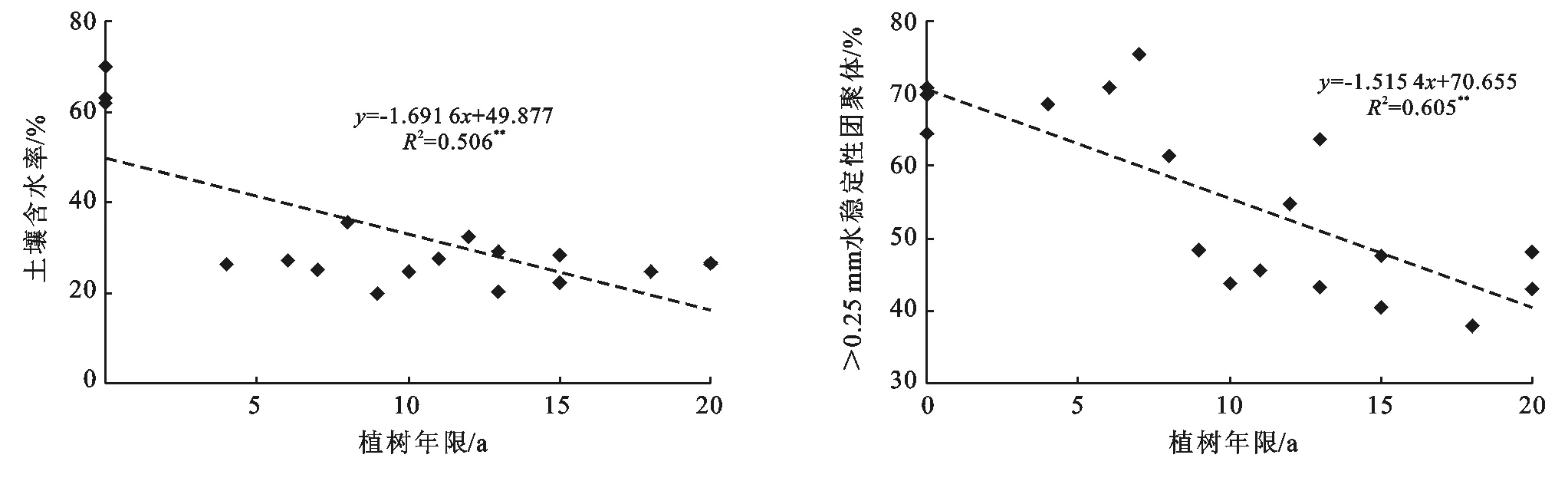
注:*表示显著相关(p<0.05);**表示极显著相关(p<0.01)。下同。
2.2 水田改果园对土壤基本化学性质的影响
水田改果园后,土壤明显酸化,水田土壤pH平均值为5.51,改果园后pH值平均值下降到4.45,并与植树年限呈极显著(p<0.01)负相关(图2)。随着植树年限的延长土壤盐基饱和度呈现出下降趋势,并与植树年限呈极显著(p<0.01)负相关(图2)。改果园后,随着植树时间的延长土壤有机质含量呈下降的趋势,水田土壤中土壤有机质平均含量为34.2 g/kg,改果园后平均含量下降到20.8 g/kg,降幅达到39.1%,并与植树年限呈极显著(p<0.01)负相关(图2)。
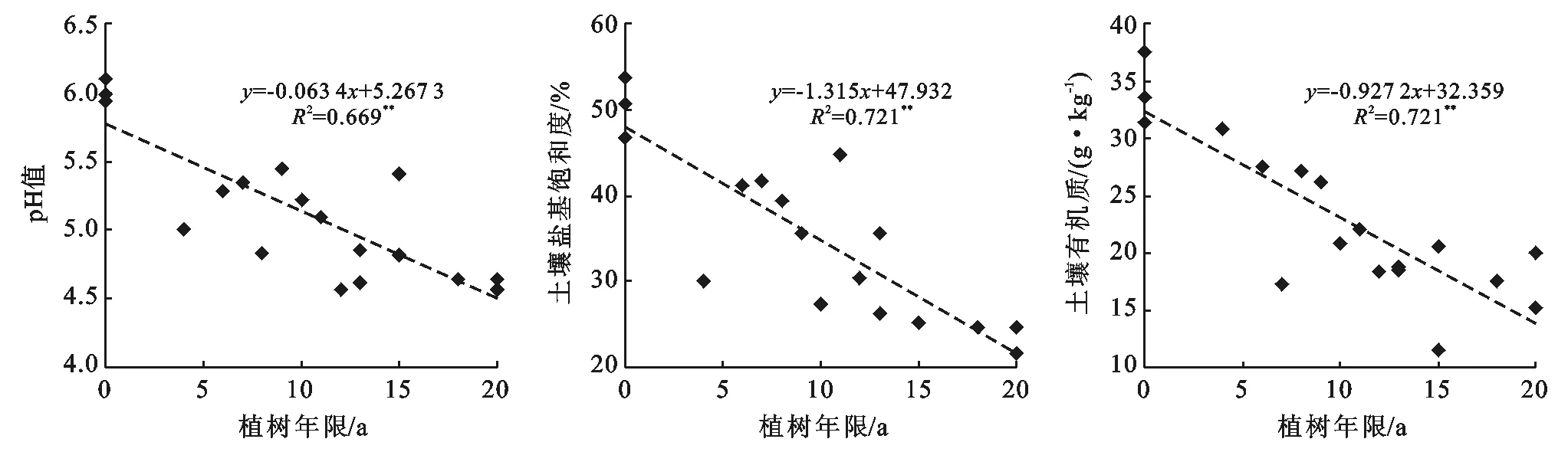
图2 土壤pH值、盐基饱和度和有机质随时间的变化
2.3 水田改果园对土壤养分的影响
土壤养分对土地利用方式由水田改为果园响应较敏感,水田土壤中全氮和碱解氮等高于改果园土壤,磷素和钾素含量低于果园土壤。水田土壤中全氮和碱解氮平均含量分别为2.38 g/kg,220.2 mg/kg,改果园后平均含量分别下降到1.08 g/kg和143.6 mg/kg,降幅分别为54.6%和34.8%,并与植树年限呈极显著(p<0.01)负相关(图3)。水田土壤中全磷和有效磷平均含量分别为0.81 g/kg和42.7 mg/kg,改果园后分别增加到1.15 g/kg和326.6 mg/kg,分别增加了42.0%和6.65倍,并与植树年限呈极显著(p<0.01)正相关(图4)。水田土壤中全钾和有效钾平均含量分别为16.0 g/kg和111.7 mg/kg,改果园后分别增加到19.5 g/kg和172.8 mg/kg,增幅分别为21.9%和54.7%,并与植树年限呈极显著(p<0.01)正相关(图5)。
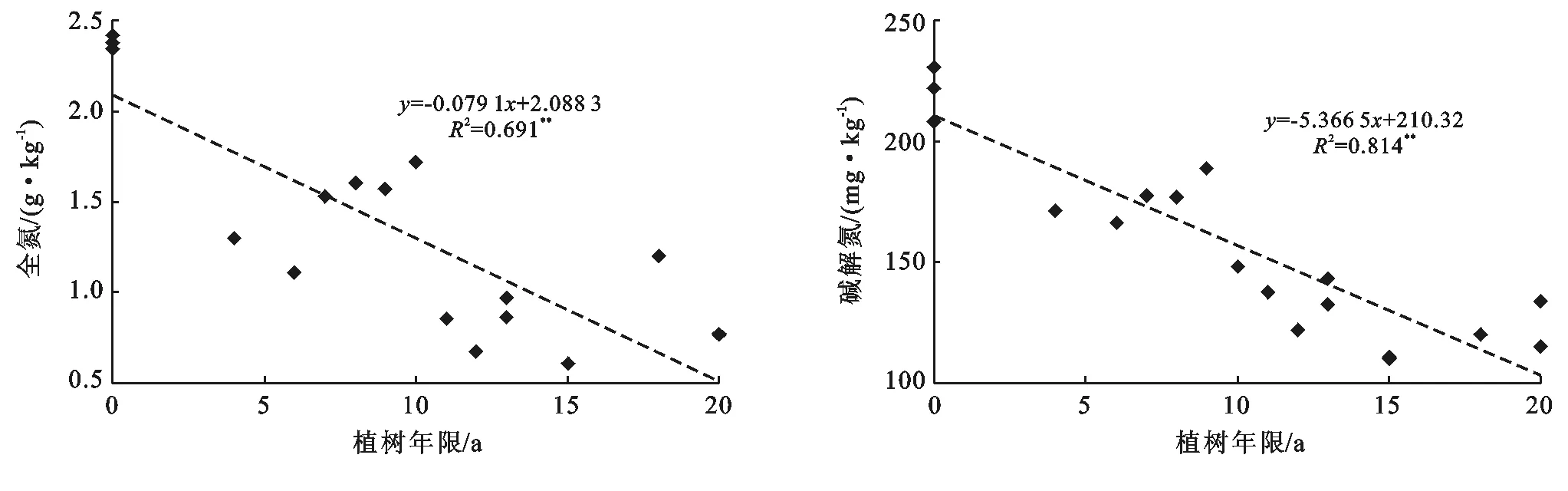
图3 土壤全氮和碱解氮随时间的变化
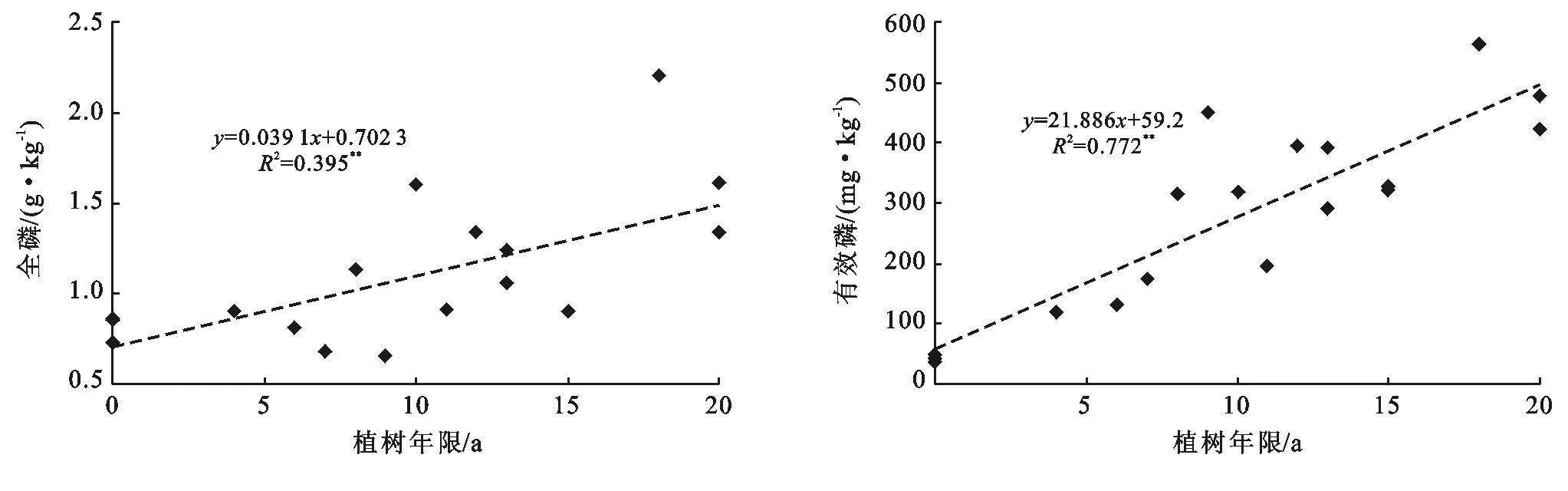
图4 土壤全磷和有效磷随时间的变化
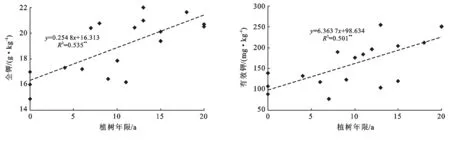
图5 土壤全钾和有效钾随时间的变化
2.4 土壤理化指标主成分分析
为进一步了解土壤理化性质与土地利用方式及利用年限之间关系,对水田和果园土壤11个土壤理化指标进行了主成分分析(principal component analysis, PCA)。主成分PC1,PC2,PC3和PC4分别解释了水田改果园后69.2%,10.5%,5.8%和4.1%的土壤理化性质的变异,累积贡献率为89.6%。第1主成分与自然含水率、>0.25 mm 水稳定性团聚体、pH值、有机质、盐基饱和度、全氮、碱解氮呈极显著(p<0.01)正相关,与全磷、有效磷、全钾和有效钾呈极显(p<0.01)著负相关(表2)。这与土壤环境因子与植树年限的相关性一致,表明主成分1主要受土地利用年限的影响,土地利用年限是促使土壤环境变化的主要因素。研究表明,分布在A区域的3个土壤样本均为水田土壤样本,在这些土壤样本中,自然含水率、>0.25 mm水稳性团聚体、pH值、盐基饱和度、有机质、全氮、碱解氮等含量明显高于其它土壤,而全磷、有效磷、全钾、有效钾等指标明显低于其它土壤。分布在B区域的7个土壤样本均为植树年限不超过11 a的果园土壤样本,其土壤理化指标的数值大小总体上介于A区域和C区域土壤样本理化指标的数值之间。依据土壤理化性质主成分分析的结果(图6),改果园土壤可以分为短期果园土壤(S4—S10,≤11 a)和长期果园土壤(S11—S18,>11 a)两个阶段。区域A与B的距离,大于区域B与C的距离,表明土地利用方式对土壤理化性质的影响要大于利用年限的影响。
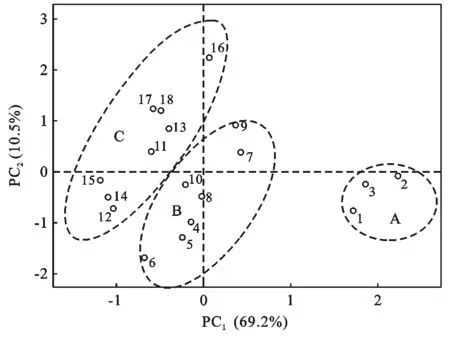
注:图中数字表示样品编号
2.5 水田改果园对土壤微生物生物量和微生物熵的影响
水田土壤微生物生物量碳(microbial biomass carbon, MBC)平均含量为1 026.33 g/kg,改果园后土壤MBC平均含量降低到262.51 mg/kg,降幅达到74.4%(图7),并与植树年限呈极显著负相关(p<0.01)。水田土壤微生物生物量氮(microbial biomass nitrogen, MBN)平均含量为104.94 mg/kg,改林地后土壤MBN平均含量降低到28.00 mg/kg,降幅达到73.3%,并且与植树年限呈极显著负相关(p<0.01)(图7)。MBC主要取决于输入有机物质的数量和性质,在一定条件下,有机质输入越多,MBC就越高[15-16]。相关分析表明,改果园后,土壤微生物生物量碳氮与土壤自然含水率、>0.25 mm 水稳性团聚体、pH值、盐基饱和度、有机质、全氮、碱解氮含量呈显著(p<0.05)或极显著(p<0.01)正相关(表4),与土壤有效磷、全钾和有效钾呈显著(p<0.05)或极显著(p<0.01)负相关(表4)。
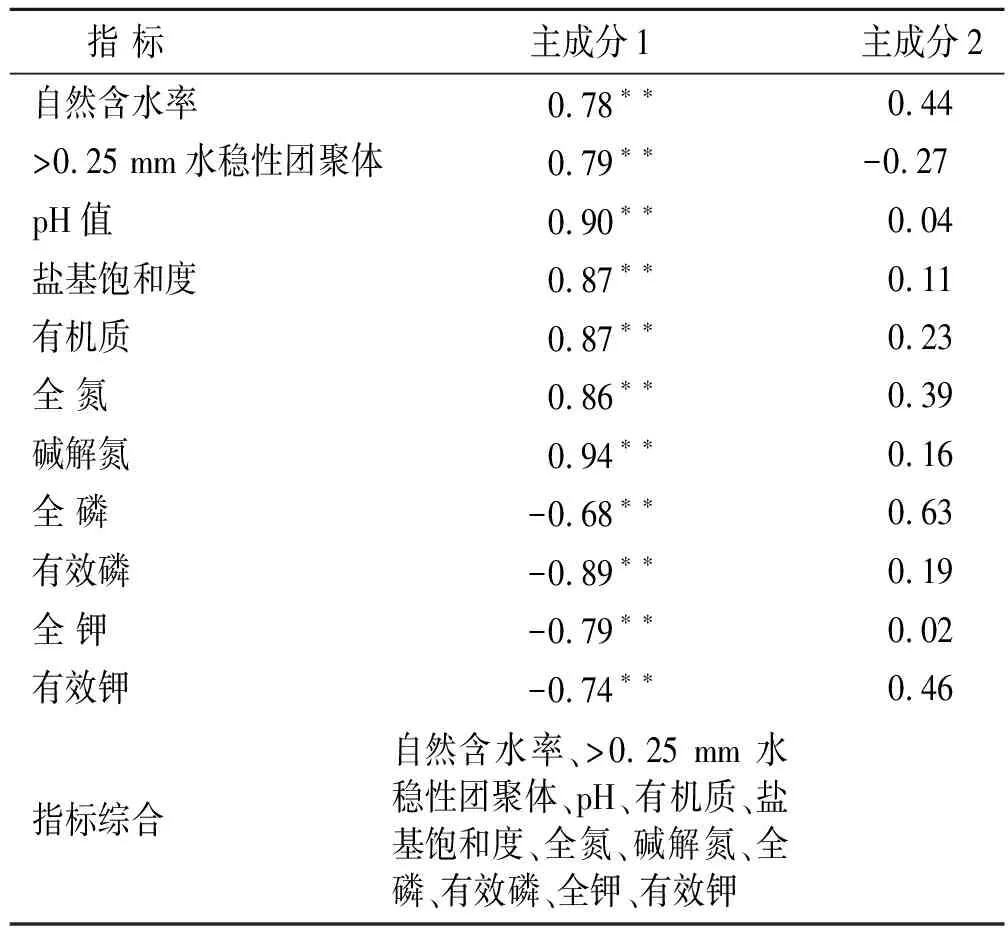
表2 土壤理化性质与主成分的相关系数
土壤微生物熵(microbial biomass carbon/total organic carbon, MBC/TOC)的变化反映了土壤中输入的有机质向微生物生物量碳的转化效率[17]。土壤被过度使用时,土壤生物生物量碳库会以较快速率下降,最终引起土壤有机质和微生物熵降低[18]。水田改果园后,土壤微生物熵随着植树年限的延长而下降,并与植树年限呈极显著负相关(p<0.01)(图7),表明水田改果园后土壤微生物生物量碳比土壤有机碳降低更加迅速,土壤出现过度使用的情况,也说明水田在积累有机碳的同时,有利于土壤微生物生物量的提高。
2.6 水田改果园对土壤酶活性的影响
水田土壤中脲酶活性平均值为0.20 mg/g(以24 h内土壤中的NH3-N计),改林地后土壤脲酶活性平均值增加到0.28 mg/g(表3),增幅为40.0%,并与改林地年限呈极显著正相关,相关性系数为r=0.78**(n=18)。水田土壤酸性磷酸酶活性平均值为2.15 mg/g(以24 h 内土壤中的酚计),改林地后土壤酸性磷酸酶活性平均值增加到3.05 mg/g(表3),增幅为41.8%,与改林地年限呈极显著正相关,相关性为r=0.82**(n=18);并与土壤pH值呈极显著(p<0.01)负相关,与土壤有效磷含量呈极显著(p<0.01)正相关(表4)。水田土壤过氧化氢酶活性平均值为7.98 ml (以1 g干土1 h内分解的H2O2对应的0.01 mol/L KMnO4体积计),改林地后平均值降低到2.45 ml(表3),下降了69.3%,并与改林地年限呈极显著负相关,相关性系数为r=-0.79**(n=18)。此外,土壤过氧化氢酶活性与土壤pH值以及有机质都呈极显著(p<0.01)正相关(表4)。
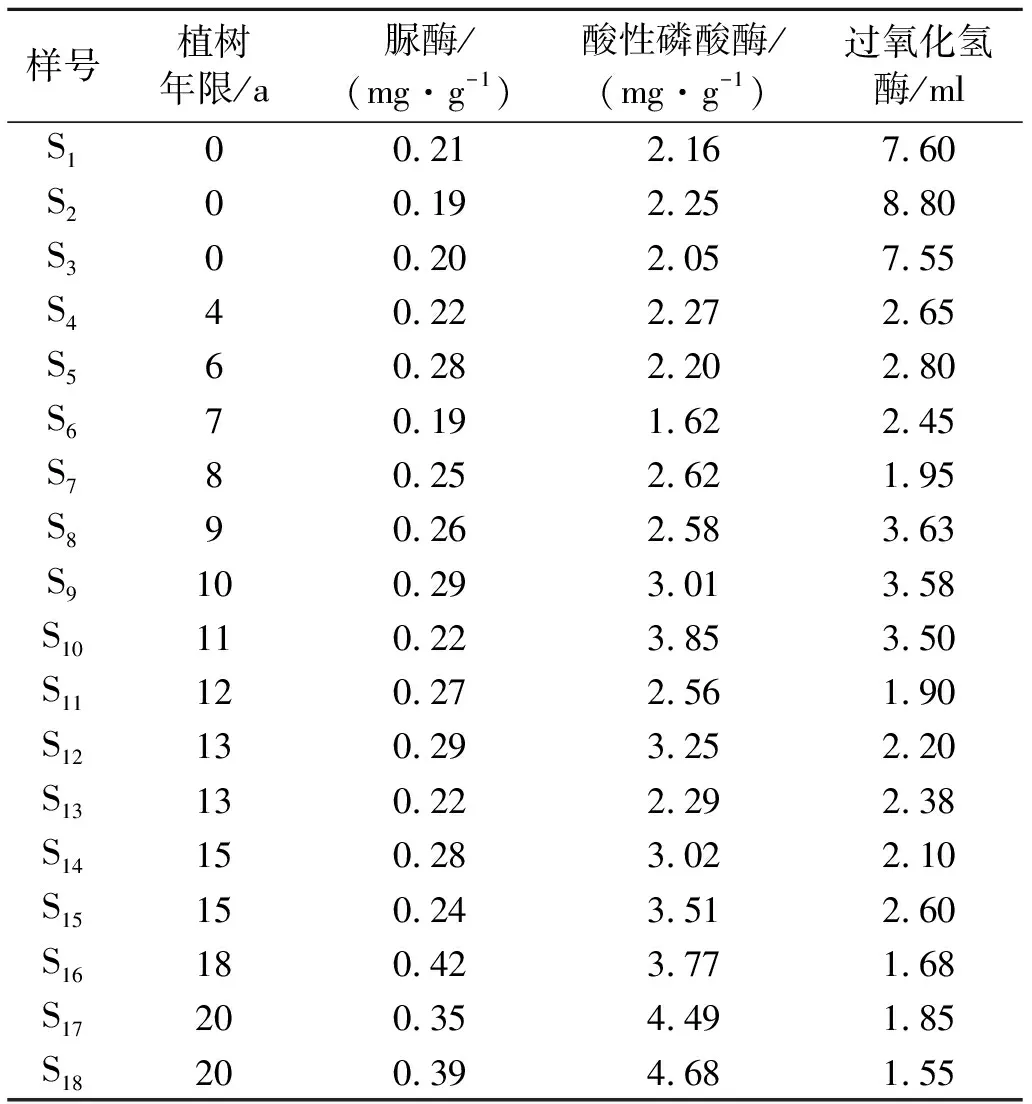
表3 水田和果园土壤酶活性
注:脲酶活性以24 h 内土壤中的NH3-N(mg/g)计,酸性磷酸酶活性以24 h 内土壤中的酚(mg/g)计,过氧化氢酶活性以1 g干土1 h内分解的H2O2对应的0.01 mol/L KMnO4体积(ml)计,—表示“无”。
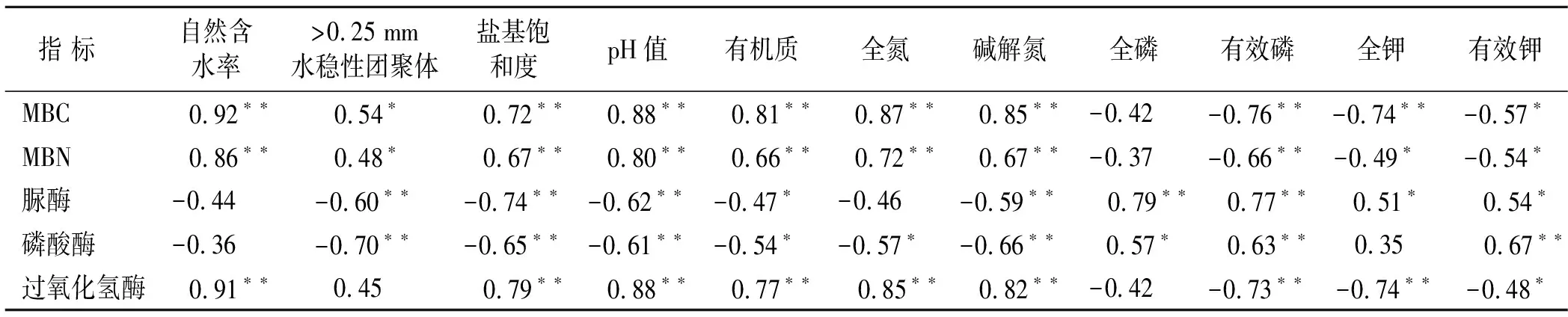
表4 土壤微生物指标与土壤理化性质相关系数
3 讨 论
3.1 水田改果园后土壤理化指标的响应规律
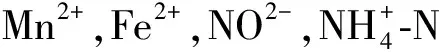

3.2 水田改果园后土壤微生物特性的响应规律
土壤微生物生物量碳是土壤有机碳中活性较高的部分,它对环境因子变化非常敏感[21-22]。土壤微生物生物量氮是土壤有效氮活性库的主要部分,其含量能够反映土壤肥力状况和土壤的供氮能力[23]。水田改果园后土壤微生物生物量显著下降(p<0.01),变化的主要原因是稻田土壤为微生物提供了相对充足的有机碳源、氮源和水分等主要营养物质,使得稻田土壤微生物的生长旺盛,土壤微生物生物量相对较高;另一方面,水田改果园后土壤酸化,抑制了土壤微生物活性,特别是占土壤微生物多数的细菌的活性,此外,土壤微生物生物量与大于0.25 mm的水稳定性团聚体呈显著(p<0.05)正相关(表4),表明水田中较多的水稳定性团聚体有利于土壤水分和土壤空气的消长平衡,为微生物生长提供了良好的生境[24]。
脲酶是土壤酶系中唯一催化尿素水解的酶,其活性反映了土壤酰胺态氮的转化能力和供应无机态氮的能力,通常情况下,它与土壤有机质和微生物数量有很大关系[23]。土壤pH值较高时土壤有机—无机胶体、土壤脲酶和尿素三者的结合体较稳定,从而使脲酶发生“钝化”[25-26]。水田改果园后,土壤pH值下降,脲酶活性增强,表明土壤中全氮和碱解氮含量降低,与脲酶活性增强有一定关系。
磷酸酶是土壤酶系中唯一催化有机磷脂水解成可供植物吸收的无机磷酸的酶,其活性的高低直接影响着土壤中有机磷的分解转化和生物有效性,对有机磷的矿化作用非常明显[23]。水田改果园后,土壤酸性磷酸酶活性增强,并与土壤有效磷含量呈极显著(p<0.01)正相关(表4),这与改果园后土壤磷肥施用量增加,残留在土壤中可供微生物利用的磷素(底物)增多,微生物受到底物刺激,分泌的磷酸酶增多有关;并与土壤有效磷含量增加、诱导作用增强,致使土壤磷酸酶活性增强等因素有关[27-28]。此外,土壤酸性磷酸酶的最适pH值为4.0~5.0[29],改果园后土壤pH值逐渐降低也是酸性磷酸酶活性增强的重要原因。
过氧化氢酶主要来源于细菌、真菌以及植物根系分泌物,是参与土壤物质和能量转化的一种重要的氧化还原酶,土壤过氧化氢酶能够促进过氧化氢的分解有利于防止对生物体的毒害作用,其活性能反映土壤生物氧化过程的强弱,与有机质积累程度有关[14,23,30]。当pH值在5.0以下时过氧化氢酶的活性几乎完全消失[31]。水田改果园后,土壤过氧化氢酶活性降低,并与土壤pH值和有机质含量呈极显著(p<0.01)正相关(表4),表明土壤pH值和有机质下降是土壤过氧化氢酶活性降低的重要原因。水田中还原性物质较果园多,水田大量的还原性物质被氧化过程中,需要大量电子受体,过氧化氢酶活性增强,促进过氧化氢快速分解,分解产物氧分子可以将土壤中的还原性物质氧化,因而水田中过氧化氢酶活性较强。
4 结 论
水田改果园后,土壤酸化,土壤结构变差,碳汇作用减弱,土壤综合肥力下降。改果园后全氮和碱解氮下降,而全磷、有效磷、全钾和有效钾明显增加,引起土壤养分失衡,并对土壤生态环境造成影响,增加了因养分流失而导致水体富营养化的风险。结果表明,水田改果园后土壤环境因子发生阶段性变化,土地利用年限是促使土壤环境因子变化的主要因素,土地利用方式的影响要大于利用年限的影响。研究表明,水田改果园后土壤环境因子的改变对土壤微生物生物量及酶活性产生重要影响,土壤生态功能减弱,对土地的可持续利用产生不利影响。

