拉伸指数和单指数模型DWI应用于前列腺癌和前列腺增生鉴别诊断的对照
陈雨菲,何为,刘剑羽
作者单位:
北京大学第三医院放射科,北京,100191
前列腺癌是老年男性最常见的恶性肿瘤之一[1],而磁共振成像(magnetic resonance imaging,MRI)是诊断前列腺癌的最佳影像学检查方式[2]。其中扩散加权成像(diffusion weighted imaging,DWI)可无创地检测组织中水分子扩散的水平,提高MRI诊断前列腺癌的能力[3]。但部分前列腺增生,尤其是基质型增生在MRI上与前列腺癌表现相似,难以鉴别。对DWI图像进行定量分析,可更加客观地评价病变水分子扩散受限的程度,提高DWI的鉴别能力。传统DWI采用单指数模型,忽略了体素内不同区间水分子扩散水平不一致的情况,难以真实地反应组织的扩散状况[4]。2003年,Bennett等[5]提出拉伸指数模型,可在不区分体素内有多少不同区间的情况下,评估组织体素内的异质性,提供更多信息。本研究旨在探讨拉伸指数模型在鉴别前列腺癌和前列腺增生中的应用价值,并与传统单指数模型进行对比。
1 材料与方法
1.1 临床资料
回顾性搜集我院2013年10月至2018年6月因怀疑前列腺疾病就诊,行MRI检查,并取得病理结果的病例。纳入标准:(1) MRI检查包括T1WI、T2WI、多b值DWI序列;(2)行MRI检查前未进行任何形式的治疗,前4周内未进行前列腺穿刺活检;(3) MRI检查后1个月内行经直肠超声(TRUS)引导下标准12针法前列腺穿刺活检或前列腺癌根治手术,病理证实为前列腺腺癌或前列腺增生。排除标准:(1)图像质量差,影响诊断;(2)最大病灶直径<0.5 cm,影响准确测量。最终纳入前列腺癌患者61例(手术病理证实32例,穿刺病理证实29例),年龄50~88岁,中位数年龄73岁,前列腺特异性抗原(prostate specific antigen,PSA)范围2.34~750.00 ng/ml;纳入前列腺增生患者49例(手术病理证实1例,穿刺病理证实48例),年龄49~80岁,中位数年龄66岁,PSA范围0.45~35.24 ng/ml。
1.2 MRI检查方法
患者均采用3.0 T磁共振扫描仪(MR750,GE Healthcare,USA)和8通道相控阵心脏线圈进行扫描。扫描参数:(1)轴位快速自旋回波(fast spin-echo,FSE)T1WI:TR 459~790 ms,TE 6.7~7.3 ms,矩阵320×224,FOV 32 cm×32 cm,层厚5.0 mm,层间距0.5 mm;(2)轴位快速恢复FSE T2WI:TR 4036~8447 ms,TE 95.5~131.5 ms,矩阵288×288,FOV 18 cm×18 cm,层厚4.0 mm,层间距 0.4 mm;(3)轴位单次激发平面回波成像DWI:TR 2600 ms,TE 74.7 ms,矩阵128×160,FOV 30 cm×30 cm,层厚5.0 mm,层间距1.0 mm。共11个b值,分别为 0、30、50、100、150、200、400、800、1000、1500、2000 s/mm2。
1.3 影像分析方法
将多b值DWI图像传入GE Advantage Workstation 4.6进行后处理。由2名影像科医师参照手术病理和穿刺病理的结果,在MRI图像上协商确定患者病灶的选择和位置。前列腺癌灶的选取标准:(1)对行TRUS引导下标准12针法穿刺活检病例的前列腺进行分区,分为左、右叶移行带的基底部、中部、尖部和左、右叶外周带的基底部、中部、尖部共12个区(若前列腺增生严重,外周带明显受压变扁甚至消失时,则对内、外部进行均匀划分),分别对应标准12针法的相应穿刺部位。选择T2WI上呈低信号且相应分区部位穿刺结果为阳性的病变为癌灶;(2)前列腺癌根治术后的病例,则依据术后病理对前列腺癌累及范围的描述进行癌灶的定位;(3)若同一患者有多处癌灶,则选取最大的癌灶进行测量。前列腺增生灶的选取标准:(1)若有病变表现为T2WI低信号,DWI高信号,影像学上可疑为前列腺癌而病理证实为前列腺增生,则选择该病灶进行测量;(2)若DWI上无高信号病变,则选择T2WI上表现为低信号的基质型增生病灶,或以低信号为主的混合型增生病灶。感兴趣区(region of interest,ROI)的选取:在病灶与周围组织对比最明显的DWI图像上手动勾画ROI,若病灶在DWI图像上信号不高,则参照T2WI图像在b=0 s/mm2的DWI图像上进行勾画。选取病灶的最大层面进行测量,ROI尽量包含最大实体区域,并注意避开病灶边缘、出血、钙化和坏死等。相同的ROI自动生成在同层面的表观扩散系数(apparent diffusion coefficient,ADC)、分布扩散系数(distributed diffusion coefficient,DDC)和α参数图上,获得并记录各个病灶的参数值,测量3次取平均值。
1.4 统计学方法
2 结果
2.1 前列腺癌组的病理结果

图1 男,75岁,前列腺癌患者。A:T2WI,右叶移行带示低信号结节;B:DWI (b = 2000 s/mm2),结节呈明显高信号;C:ADC图,结节呈低信号(ADC值0.659×10-3 mm2/s);D:DDC图,结节呈低信号(DDC值0.649×10-3 mm2/s);E:α图,结节信号略减低(α值0.686) 图2 男,74岁,前列腺增生患者。A:T2WI,移行带体积增大,呈不均匀低信号;B:DWI(b=2000 s/mm2),左叶移行带病变呈片状稍高信号;C:ADC图,病变见少许低信号(ADC值1.090×10-3 mm2/s);D:DDC图,病变呈相对低信号(DDC值1.340×10-3 mm2/s);E:α图,病变未见明显信号改变(α值为0.779)Fig.1 A 75-year-old patient with PCa.A: T2WI, showed a low signal nodule in the right transition zone.B: DWI (b=2000 s/mm2), the nodule showed markedly high signal.C: ADC map, the nodule showed low signal (ADC: 0.659×10-3 mm2/s).D: DDC map, the nodule showed low signal (DDC: 0.649×10-3 mm2/s).E: α map, the nodule showed mildly low signal (α: 0.686).Fig.2 A 74-year-old patient with BPH.A: T2WI, the transition zone was enlarged, and the signal was nonhomogeneous low.B: DWI (b=2000 s/mm2), the left lesion in the transition zone showed mildly high signal.C: ADC map, the lesion had some mildly low signal (ADC:1.090×10-3 mm2/s).D: DDC map, the lesion showed relatively low signal (DDC: 1.340×10-3 mm2/s).E: α map, showed no obvious change (α: 0.779)
表1 前列腺癌和前列腺增生的ADC值、DDC值及α值()Tab.1 Mean and standard deviation of ADC, DDC, α parameters for PCa and BPH ()
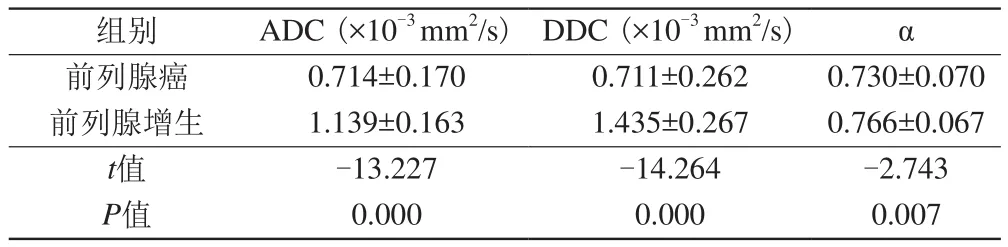
表1 前列腺癌和前列腺增生的ADC值、DDC值及α值()Tab.1 Mean and standard deviation of ADC, DDC, α parameters for PCa and BPH ()
组别 ADC (×10-3 mm2/s) DDC (×10-3 mm2/s) α前列腺癌 0.714±0.170 0.711±0.262 0.730±0.070前列腺增生 1.139±0.163 1.435±0.267 0.766±0.067 t值 -13.227 -14.264 -2.743 P值 0.000 0.000 0.007

表2 ADC值、DDC值和α值鉴别前列腺癌和前列腺增生的能力对比Tab.2 Comparison of performance of ADC, DDC, and α parameters for differentiating PCa and BPH
61例前列腺癌中,26例为外周带癌,18例为移行带癌,17例为同时累及移行带及外周带的前列腺癌。61例前列腺癌的Gleason评分为6~10分,其中9例为6分,10例为3+4=7分,12例为4+3=7分,9例为8分,15例为9分,6例为10分。其中低级别癌(≤3+4=7分)19例,高级别癌(≥4+3=7分) 42例 。
2.2 前列腺癌和前列腺增生各参数的测量结果及比较

图3 各参数的ROC曲线对比Fig.3 Comparisons of ROC curves of all parameters.
外周带癌、移行带癌和两者共同累及前列腺癌的ADC值分别为(0.731±0.186)×10-3mm2/s、(0.754±0.187)×10-3mm2/s、(0.647±0.101)×10-3mm2/s,DDC值分别为(0.711±0.282)×10-3mm2/s、(0.788±0.298)×10-3mm2/s、(0.630±0.161)×10-3mm2/s,α值分别为0.732±0.083、0.740±0.051、0.716±0.066。不同部位前列腺癌各参数值之间无显著差异(P>0.05)
前列腺癌的ADC、DDC和α值均显著低于前列腺增生(表1;图1,2)。在前列腺增生中,DDC值高于ADC值,两者具有统计学差异(P<0.001)。在前列腺癌中,ADC值和DDC值无显著差异(P>0.05)。
2.3 各参数的ROC曲线分析结果
ADC值、DDC值和α值诊断前列腺癌的ROC曲线分析见图3。各参数的AUC、诊断前列腺癌的最佳截断值及其对应的敏感性、特异性见表2。ADC值和DDC值诊断前列腺癌的AUC要高于α (P<0.05),ADC值与DDC值之间的AUC无显著差异(P>0.05)。
2.4 与Gleason评分的关系
前列腺癌的ADC值、DDC值与Gleason评分呈负相关(相关系数分别为-0.432、-0.369,P<0.01),α值与Gleason评分无相关性(P>0.05)。无论低级别癌还是高级别癌,其ADC值和DDC值均低于前列腺增生(P<0.05)。高级别癌的α值低于前列腺增生(P<0.05),但低级别癌与前列腺增生的α值之间无差异(P>0.05)。
区分低级别癌与前列腺增生时,ADC、DDC和α值的AUC分别为0.882、0.885、0.539,区分高级别癌与前列腺增生时三者的AUC分别为0.981、0.987、0.696。各参数区分高级别癌与前列腺增生的AUC高于区分低级别癌与前列腺增生的AUC,但两者之间无差异 (P>0.05)。
3 讨论
3.1 单指数模型与拉伸指数模型的理论发展
前列腺癌在T2WI上表现为低信号,在DWI 上,癌组织的细胞密度较良性组织增大,呈相对扩散受限的状态[6],从而表现为相对高信号。部分前列腺增生,尤其是基质型增生,也可在T2WI表现为低信号,DWI上高信号,而与前列腺癌难以鉴别。为了获得定量数据,以更加客观地评价病变,需应用数学模型对DWI图像的信号衰减进行模拟。
目前应用最广泛的为传统单指数模型,以ADC值来表示组织内的水分子扩散水平,其计算公式为:S(b)/S0=exp (-b×ADC)。其中b为扩散系数,S(b)和S0分别代表DWI图像在相应b值和b=0 s/mm2时的信号强度。在单指数模型中,认为体素内的水分子为同一区间,扩散方式均一,忽视了组织结构的复杂性。且一些研究结果表明,DWI衰减方式在部分b值范围内会偏离单指数模型曲线[7-8]。
1988年,Le Bihan等[4]提出了体素内不相干运动(intravoxel incoherent motion,IVIM)模型,将体素内的水分子分为两个区间,分别代表水分子扩散和血流灌注。然而,实际的微观结构要更为复杂,如水分子扩散即可分为细胞内水分和细胞外间质水分的扩散,同时,各区间之间还存在水分子的互相交换。因此,要精确定义及描述体素内的水分子区间分布几乎是不可能的。Bennett等[5]在2003年提出了拉伸指数模型,该模型不对体素内的区间数量进行区分,而是用拉伸指数α来反映体素内的扩散异质性。计算公式为:S(b)/S(0)=exp[-(b×DDC)α]。其中,拉伸指数α代表体素内水分子扩散的异质性,取值范围0~1。α值越趋近于1,体素内的水分子扩散的方式越接近单指数模型,而α值越趋近于0,体素内的水分子扩散方式越复杂,异质性越高。DDC 值为多区间的ADC值按体积分数加权比的总和。Mazaheri等[9]报道,相比于单指数模型,拉伸指数模型在前列腺组织中的拟合优度更佳。
3.2 各参数鉴别前列腺癌与前列腺增生的能力
前列腺癌的ADC值低于良性前列腺组织,这一结论已得到了广泛认可[10-11],且ADC值减低已成为第二版前列腺影像报告和数据系统(PI-RADS v2)评估前列腺癌的标准之一[12]。本研究结果与这一结论相符。在拉伸指数模型中,由于DDC值是ADC值的一种复合表现形式,前列腺癌的DDC值变化趋势应与ADC值相同。本研究中前列腺癌的DDC值明显减低,与理论相符,且与以往的几项研究结果相同[13-17]。另外,根据Liu等[15]的研究结果,在前列腺癌中,DDC值要低于ADC值,而在正常前列腺组织中,DDC值高于ADC值,这使得前列腺癌与正常组织之间DDC值的差距更大。Li等[14]在一项前列腺癌与良性疾病(前列腺增生、前列腺炎)的对比研究中也得到了类似的结论。在本研究中,前列腺增生组的DDC值明显高于ADC值(P<0.001),与前两者的结果相同,但在前列腺癌中两者无显著差异,可能与本研究的参数设置、测量误差等因素有关。由于DDC值在前列腺癌组织与良性组织的差异大于ADC值,DDC值鉴别前列腺癌和前列腺增生的能力将有可能高于ADC值。在本研究中,DDC值诊断前列腺癌的AUC要略高于ADC值,但两者之间差异不显著(P>0.05),与Li等[14]的研究结果相同。
b值的选择会对DWI的定量测量产生一定影响[16,18]。在本研究中,单指数模型ADC值采用多b值计算,而在实际的临床工作中,常用2个b值来计算。Merisaari等[19]的研究结果表明,多b值计算的ADC值可重复性更高,但并不会影响ADC值的诊断能力。对于拉伸指数模型,Feng等[16]对不同b值范围的DWI进行对比研究发现,在b值处于较低范围(0~1000 s/mm2)时,DDC值的诊断能力要高于ADC值(P=0.014),而在b值处于较高范围(0~2000 s/mm2或更高)时,两者的诊断能力无明显差异,说明在低b值范围时,DDC值更具有优势。而本研究和Li等[14]的研究均采用0~2000 s/mm2的较高b值范围,未体现出DDC值的优势。尽管如此,高b值范围计算出的DDC值诊断能力要优于低b值范围,因此更推荐使用高b值范围来进行拉伸指数模型的计算[16]。采用拉伸指数模型时应采用何种b值范围,以及b值对DDC值的诊断能力有何影响,还需要进一步研究。
α值代表了组织体素内的异质性。通常情况下,癌组织的细胞和腺体多形性高,体素内的异质性要高于良性组织,因此癌组织的α值更低[16]。在本研究中,前列腺癌的α值低于前列腺增生,两者具有统计学差异(P<0.01)。但α值诊断前列腺癌的AUC较低,因此,不推荐用α值来鉴别前列腺癌和前列腺增生。其他研究结果也得到了类似的结论[15-16]。但α值的变化趋势尚存在一定争议。在Hectors等[13]的研究结果中,前列腺癌的α值高于正常外周带组织的α值,与本研究的结果相反。这或许与α值本身的变异度较高有关[19]。
3.3 与Gleason评分的关系
前列腺癌的组织结构分化程度不同,侵袭性也有所不同。临床上使用Gleason评分对前列腺病变中的主要结构和次要结构进行评分,范围为1~5分,分数越高代表侵袭性越高,两者分数相加即为最终的Gleason评分[20]。本研究中,ADC值与DDC值与Gleason评分呈负相关,而α与Gleason评分无相关性,与Liu等[21]的研究结果相同。依据最新Gleason评分的观点[22],笔者将前列腺癌分为低级别癌(≤3+4=7分)和高级别癌(≥4+3=7分)。无论是低级别癌还是高级别癌,ADC值和DDC值均可用于与前列腺增生的鉴别,且诊断低级别癌的能力与诊断高级别癌的能力相当。而α值仅能区分高级别癌与前列腺增生,在低级别癌与前列腺增生中无显著差异。进一步证实ADC值和DDC值应用于前列腺癌与前列腺增生鉴别诊断的价值,而α值的临床意义有限。
3.4 本研究的不足
本研究的不足有以下几点:(1)纳入的样本量不足,可能会产生偏移。(2)穿刺活检可能出现漏诊[23]、Gleason评分与术后评分不同[24]等情况,因此诊断的准确性有限。(3) ROI的选取没有包括病灶所有层面,不能体现病灶整体的特性。且以参数平均值做统计检验,病灶体素间的异质性得不到体现。后续可通过直方图分析来体现病灶整体的异质性。(4)拉伸指数模型的最优b值数量和范围尚无统一定论,优化b值方案或许可以提高DDC值的诊断效能。
综上所述,相比于单指数模型,拉伸指数模型能提供更多信息,对组织内水分子扩散的描述也更加精确。前列腺癌的ADC值、DDC值和α值均低于前列腺增生。DDC值与ADC值有相同的诊断效能,而α值的诊断效能较低。前列腺癌的ADC值、DDC值与Gleason评分呈负相关。在鉴别前列腺癌与前列腺增生上,拉伸指数模型较单指数模型是否具有优势仍需要更多的研究。
利益冲突:无。

