3.0 T MRI全身扩散加权成像在多发性骨髓瘤诱导治疗疗效评估中的应用
郑梦龙,翁春娇,李文娟,姚紫云,谢道海
作者单位:
苏州大学附属第一医院放射科,苏州 215006
多发性骨髓瘤(multiple myeloma,MM)是一种浆细胞恶性增殖性疾病,其特点为骨髓中的浆细胞克隆性增殖并伴有大量单克隆免疫球蛋白分泌。多发性骨髓瘤是第二常见的血液系统恶性肿瘤,约占血液系统恶性肿瘤的10%~15%,全世界每年预计有86 000新发病例,占所有新发恶性肿瘤的0.8%[1-2]。近年来,多种治疗方案的更新使得多发性骨髓瘤的治疗效果有了飞速的进展,预后得到了明显的改善。最近研究表明深度缓解,包括完全缓解(complete response,CR)和非常好的部分缓解(very good partial response,VGPR)是影响多发性骨髓瘤总体生存(overall survival,OS)率的独立预后良好因素[3-5]。扩散加权成像(diffusion-weighted imaging,DWI)是一种通过表观扩散系数(apparent diffusion coefficient,ADC)值量化细胞内外水分子扩散量的检测方法,也是唯一可以无创性反映人体组织水分子扩散的检测技术[6]。大量报道表明全身扩散加权成像(whole body diffusion-weighted imaging,WB-DWI)在评估肿瘤对治疗的反应具有很大价值[7-8],但是国内还没有关于WB-DWI对多发性骨髓瘤治疗效果评估的研究。本研究通过应用3.0 T MRI WB-DWI,将治疗前后ADC值变化与多发性骨髓瘤治疗效果进行对照,旨在探讨WB-DWI在多发性骨髓瘤疗效评估方面的应用。
1 材料与方法
1.1 研究对象
收集2016年4月至2018年6月在苏州大学附属第一医院就诊的经过骨髓穿刺及实验室检查确诊的多发性骨髓瘤患者54例,其中男性36例,女性18例,年龄32~73岁,平均年龄57岁。临床表现主要为骨痛、贫血、肾功能不全、高钙血症等。在诱导治疗前及四个周期诱导治疗结束时均行WB-DWI检查。排除标准:(1)有MRI检查禁忌证(幽闭恐惧症、心脏起搏器、金属移植物等);(2)初次磁共振检查前进行放化疗干预的患者;(3)合并其他恶性肿瘤;(4)未完成整个化疗周期。所有患者均自愿接受WB-DWI检查并签署知情同意书。
1.2 扫描方法
采用3.0 T MRI扫描仪(Magnetom Verio,Siemens Healthcare,Erlangen,Germany)对患者进行扫描。患者取仰卧位,头先进,双手置于身体两侧,扫描时嘱患者自由呼吸。采用EPI-DWI序列,从头顶部至股骨上段,共分七段行轴位扫描。扩散敏感系数b值选择50、700 s/mm2,层厚5 mm,TR 5500 ms,TE 75 ms,视野(FOV) 450 mm,矩阵200×256。全身冠状位T2-tirm抑脂序列扫描参数:层厚5 mm,层间距0 mm,TR 5000 ms,TE 84 ms,FOV 460 mm,矩阵352×512。WB-DWI联合全身各段冠状位T2-tirm脂肪抑制序列扫描全程检查时间约40 min。
1.3 图像后处理及分析
应用Composing软件对全身各段T2-tirm脂肪抑制序列图像进行融合得到全身冠状位T2脂肪抑制图像。经3D MIP/MPR重组背景抑制的全身DWI图像获得多方位WB-DWI图像,并将WB-DWI图像进行黑白翻转,得到与正电子发射体层摄影术(positron emission tomography,PET)相似的成像效果,即全身类PET图像。所有患者的DWI数据均传到Syngo MultiModality工作站上,运用Funtool软件处理生成ADC图。经2名5年以上MRI诊断经验的影像医师(R1、R2)共同阅片。选择DWI上为高信号,ADC上相应部位为低信号的病变区域放置感兴趣区(region of interest,ROI),大小约18 mm2,每个感兴趣区连续测量三次,取其平均值作为选择病变区域的ADC值。测量时尽量避开出血、坏死、血管及椎间盘。分别测量和记录同一病变区域在诱导治疗前、四周期诱导治疗结束时的ADC值。
1.4 实验室检查及疗效评估
所有患者在治疗前及四周期诱导治疗后均进行以下检查:血清和尿免疫固定电泳、蛋白电泳、血清游离轻链检测、β2微球蛋白检测及骨髓抽吸活检。在四周期诱导治疗结束后,依据国际骨髓瘤工作组(International Myeloma Working Group,IMWG)的标准,对每一个患者进行治疗疗效评估。在本研究中,完全缓解(complete response,CR)、非常好的部分缓解(very good partial response,VGPR)被定义为深度缓解,部分缓解(partial response,PR)、最小缓解(minimal response,MR)、疾病稳定(stable disease,SD)以及疾病进展(progressive disease,PD)被定义为非深度缓解。
1.5 统计学分析
采用SPSS 20.0软件统计分析软件进行数据分析。所有计量资料均先进行正态分布检验及方差齐性检验,服从正态分布数的数据以均数±标准差()表示,对不服从正态分布的数据以[M (min~max)]表示。采用Bland-Altman法对2名观察者参数的定量测量值间的一致性进行检验,采用独立样本t检验对两组间计量资料进行比较,采用配对t检验对组内计量资料进行比较。构建受试者工作特性曲线(receive operating characteristic curve,ROC)进行诊断效能评价,计算曲线下面积(area under curve,AUC),按公式(灵敏度+特异度-1)计算约登指数,其所对应的最大值即灵敏度及特异度的最佳诊断阈值。P>0.05(双侧)表明差别无统计学意义;P<0.05 (双侧)表明差别具有统计学意义,其中P<0.01 认为差别具有显著的统计学意义。
2 结果
2.1 化疗疗效
54例患者,其中IgG/κ型28例,IgG/λ型26例。54例患者均进行了四周期诱导治疗,其中深度缓解组35例(CR16例、VGPR19例),非深度缓解组19例(PR16例、MR2例、PD1例)。54例患者化疗前M蛋白值(37.60±24.19)g/L与四周期诱导治疗结束时的(4.55±7.44) g/L差异显著(P<0.01)。深度缓解组和非深度缓解组治疗前M蛋白分别为(37.51±25.25) g/L,(37.75±22.77) g/L,差别没有统计学意义(P=0.972)。治疗前后M蛋白变化率在深度缓解组和非深度缓解组分别为98.65%,59.62%,差异具有显著统计学意义(P=0.006)(表1)。
2.2 观察者一致性检验
2名医师分别测量病灶化疗前及化疗后ADC值,Bland-Altman图显示绝大多数点分布在95%一致性界限的上下限范围内,数据分布范围窄,一致性好(图1)。
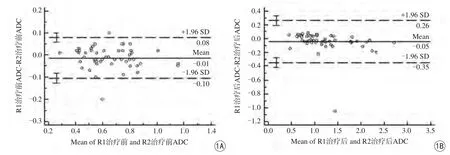
图1 2名医师间病灶测量结果可重复性。Bland-Altman图的中间实线代表各参数差值的平均值,上下两条虚线代表95%一致性界限的上下限,绝大多数病灶各参数值的差值不超过一致性界限,代表2名医师间一致性好Fig.1 The application of Bland-Altman method assessing the reproducibility of the quantitative measurements of the lesions between the two physicians.The solid line in the middle represents the average value of the difference of each parameter, the upper and lower dashed lines represent the upper and lower bounds of the 95% limits of agreement, the differences of the parameters of most lesions did not exceed the limits of agreement demonstrating that there was a good agreement between the two physicians.
2.3 治疗过程中ADC值变化情况
化疗前ADC值在深度缓解组和非深度缓解组分别为(0.66±0.20)×10-3mm2/s,(0.63±0.13)×10-3mm2/s,差异没有统计学意义(P=0.48)。化疗前后ADC值变化量在深度缓解组和非深度缓解组分别为(0.68±0.39)×10-3mm2/s、(0.24±0.17)×10-3mm2/s,差异具有显著统计学意义(P<0.01)。化疗前后ADC值变化率在深度缓解组和非深度缓解组分别为101.63%、39.32%,深度缓解组患者的ADC值变化率显著高于非深度缓解组患者(表2),差异具有显著统计学意义(P<0.01)。四周期诱导治疗结束后,深度缓解组和非深度缓解组ADC值分别为(1.34±0.53)×10-3mm2/s,(0.87±0.24)×10-3mm2/s,差异具有显著统计学意义(P<0.01)。图2、3为多发性骨髓瘤患者在四周期诱导治疗前后的WB-DWI黑白翻转图像。
表1 54例患者四周期诱导治疗前后M蛋白变化结果及2名医师测得ADC值变化结果()Tab.1 The changes of M-proteins and ADC value measured by two physicians before and after induction chemotherapy in 54 patients ()

表1 54例患者四周期诱导治疗前后M蛋白变化结果及2名医师测得ADC值变化结果()Tab.1 The changes of M-proteins and ADC value measured by two physicians before and after induction chemotherapy in 54 patients ()
项目 化疗前 四周期诱导化疗后 变化量 变化率(%)M蛋白(g/L) 37.60±24.19 4.55±7.44 33.05±24.05 84.92±36.85 ADC值(10-3 mm2/s)医师1 0.649±0.179 1.177±0.503 0.527±0.390 79.71±50.15医师2 0.662±0.183 1.222±0.544 0.560±0.441 83.92±64.38
2.4 ADC值变化率对患者疗效评定的诊断学价值
根据实际治疗效果与治疗前后ADC值变化率疗效评定结果进行比较,绘制ROC曲线对疗效诊断效能进行评估。所得曲线下面积AUC为0.929,ADC值变化率最佳诊断临界点为58.42%,具有较高的敏感度及特异度,分别约91.4%、89.5%(图4)。
表2 不同治疗疗效的多发性骨髓瘤患者在2名医师所测得ADC值的差异()Tab.2 Comparison of ADC value measured by two physicians between MM patients with different chemotherapy effections ()

表2 不同治疗疗效的多发性骨髓瘤患者在2名医师所测得ADC值的差异()Tab.2 Comparison of ADC value measured by two physicians between MM patients with different chemotherapy effections ()
组别 例数 化疗前ADC值(10-3 mm2/s) 四周期诱导化疗后ADC值(10-3 mm2/s) 变化量 ADC值(10-3 mm2/s) 变化率(10-3 mm2/s,%)医师1 医师2 医师1 医师2 医师1 医师2 医师1 医师2深度缓解组 35 0.66±0.20 0.67±0.20 1.34±0.53 1.41±0.57 0.68±0.39 0.73±0.45 101.63±46.28 108.79±65.97非深度缓解组 19 0.63±0.13 0.64±0.14 0.87±0.24 0.88±0.25 0.24±0.17 0.24±0.16 39.32±26.50 38.10±23.78 t值 0.707 0.673 4.503 4.692 5.778 5.813 6.290 5.694 P值 0.483 0.504 0.01 0.01 0.01 0.01 0.01 0.01

图2,3 MM患者,男,63岁,四周期诱导治疗后取得完全缓解(CR),诱导治疗前后的WB-DWI表现。图2 A~D:诱导治疗前,全身诸骨见明显扩散受限。图3 A~D:诱导治疗后,全身诸骨扩散受限信号明显消失Fig.2, 3 Comparison of WB DWI-MRI images before and after four courses of induction chemotherapy in a 63-year-old man with multiple myeloma (MM) who achieved complete response (CR).Fig.2 A—D, images before induction chemotherapy demonstrated multiple lesions with restricted diffusion in all body regions.Fig.3 A—D, images after induction chemotherapy demonstrated a complete decrease of the extent of restricted diffusion in all body regions.

图4 ADC值变化率鉴别诱导治疗后深度缓解与非深度缓解的ROC曲线Fig.4 ROC curve of ADC percent change for the discrimination of deep response in induction chemotherapy phase.
3 讨论
3.1 多发性骨髓瘤的常规检查手段
多发性骨髓瘤是一种以单克隆浆细胞恶性增殖为特征的一种血液系统恶性疾病,由于骨髓中恶性浆细胞大量扩增,导致血清或尿液中出现克隆性免疫球蛋白及其片段,即M蛋白及游离轻链(free light chain,FLC)。目前,对多发性骨髓瘤的疗效评估仍缺乏完全统一的标准,血清或者尿液中M蛋白及游离轻链的检测是相对简单宜行的评估方法,但是对不分泌或者寡分泌型多发性骨髓瘤疗效评估缺乏可靠性及稳定性,并且缺乏对髓外病灶及局灶性损害的监测,造成假阴性的结果[9]。骨髓瘤细胞比例量化在多发性骨髓瘤的诊断和疗效评估中具有重要价值,但骨髓穿刺或活检是可能引起局部感染和出血的有创性检查手段,同时由于多发性骨髓瘤髓内瘤细胞分布的不均匀性,可能会引起抽样误差[10-11]。
因此,非侵入性影像学技术在多发性骨髓瘤的诊断和疗效评估中有重要意义。X线平片及CT检查已经广泛应用于多发性骨髓瘤的诊断,但是当骨髓瘤细胞仅累计骨髓而没有明显骨小梁破坏时,X线平片及CT检查很难发现,同时,多发性骨髓瘤溶骨性骨病变很少会于治疗后发生改变[12],病程中新发生的椎体压缩性骨质破坏也并不一定表明病情的进展,可能是由于骨质进行性的丢失或者支撑骨皮质的肿瘤细胞的减少[13],因此X线平片及CT检查对多发性骨髓瘤疗效评估价值有限。PET-CT由于其价格高昂以及较高的辐射暴露,在临床上的应用受到限制。
3.2 WB-DWI的基本原理及应用
DWI是目前唯一能够观察活体水分子微观扩散运动的成像方法[6],其成像是以水分子随机、无规则的布朗运动为原理,采用两个大小相同、方向相反的扩散敏感梯度磁场探测人体组织细胞间隙内水分子的不规则扩散运动的信号强弱,来反映局部组织水分子含量及扩散能力。WB-DWI是一种新的非侵入性疗效监测方法之一,是由传统DWI衍生而来,与局部DWI原理相同。WB-DWI采用STIR-EPI-DWI序列,在自由呼吸状态下进行全身大范围信号采集,并抑制正常组织如肝脏、脂肪、肌肉等背景信号,使病变区域的扩散加权对比得到突出显示,从而提高全身病灶的检出率。由于该技术能够一次性全身范围扫描成像,在3D最大密度投影(maximal intensity projection,MIP)重组及黑白反转后可以得到与PET相似的成像效果,因此又被称为MR“类PET”技术[14]。WB-DWI可以通过表观扩散系数(apparent diffusion coefficient,ADC)值来量化细胞内外水分子的扩散程度。多发性骨髓瘤系浆细胞恶性克隆性增殖,组织细胞排列紧密,细胞核浆比增高,引起细胞内外水分子扩散间隙减少,DWI呈现高信号,ADC值减低。化疗前后ADC值变化反映了肿瘤细胞活性的变化,可用于判断病灶内部组织结构变化。
3.3 WB-DWI定量参数ADC值对多发性骨髓瘤化疗疗效评估的意义
国外研究通过观察ADC值与多发性骨髓瘤化疗缓解反应之间的关系,表明WB-DWI在多发性骨髓瘤疗效评估中具有可行性[15-17],但是关于ADC值与多发性骨髓瘤深度缓解反应之间关系的报道很少。本研究将诱导治疗后的多发性骨髓瘤患者分为深度缓解组(完全缓解及非常好的部分缓解)与非深度缓解组(部分缓解、最小缓解、疾病稳定及疾病进展),因文献报道多发性骨髓瘤诱导治疗后的缓解程度与患者预后及生存相关,疗效达到完全缓解和非常好的部分缓解是影响多发性骨髓瘤患者总体生存(overall survival,OS)率的独立预后良好因素[3-5]。本次研究中,我们发现四周期诱导治疗结束时ADC值较化疗前ADC值升高,且差异具有统计学意义,这表明诱导治疗有效,化疗引起病变区域骨髓瘤细胞坏死,细胞密度减低,血管堵塞以及骨髓水肿,水分子扩散受限程度减低,ADC值随之升高。笔者还发现,深度缓解组诱导治疗前后的ADC值变化量及ADC值变化率显著明显高于非深度缓解组,差异具有显著统计学意义,故我们认为诱导治疗前后ADC值的变化对多发性骨髓瘤疗效评估具有重要价值。诱导治疗后深度缓解组骨髓瘤细胞坏死、吸收相比非深度缓解组更明显,病灶区瘤细胞降低程度更明显,更有利于水分子扩散,故深度缓解组ADC值升高程度较非深度缓解组更显著。
本研究的不足:(1)样本量相对较少,以后可扩大各组样本量进一步研究;(2)本研究以手动勾画感兴趣区进行各参数测量,可能并不能完全代表病灶的整体情况。
综上所述,我们的研究表明通过量化治疗前后ADC值及其变化,MRI全身扩散加权成像在评估多发性骨髓瘤诱导治疗疗效上具有很高的价值,临床可联合实验室检查如M蛋白、游离轻链等与MRI全身扩散加权成像结果及ADC值评估多发性骨髓瘤患者治疗缓解程度,为下一阶段治疗方案的选择提供指导。
利益冲突:无。

