聚乙烯亚胺磁性改性对刚果红染料废水的吸附
计海峰,穆彦同,何雨诺,郑娣莲
(吉林化工学院 石油化工学院,吉林 吉林 132022)
纺织印染废水具有水量大、有机污染物含量高、碱性大、水质变化大等特点,属难处理的工业废水之一,废水中含有染料、浆料、助剂、油剂、酸碱、纤维杂质、砂类物质、无机盐等[1-3]。刚果红是一种典型的联苯胺类直接偶氮的阴离子染料,其在生产和使用过程中流失率高,易进入水体,对生态环境具有破坏作用。刚果红染料废水具有水质变化大、色度和COD高等特点,是染料废水中常见的污染物之一[4-5]。目前用于印染废水处理的主要方法有吸附法、化学法、生物降解法等,其中,化学法和生物降解法流程较为复杂,成本较高,而吸附法用于废水的处理具有较好的应用前景。为了不造成二次污染,吸附剂应具有生态、无毒、高效等特点。聚乙烯亚胺(PEI),是一种水溶性高分子聚合物,结构单元中含有大量的伯胺、仲胺、叔胺等基团,具有很高的化学活性,可以中和、吸附所有阴离子物质及螯化重金属离子[6]。因此,可以作为生物吸附剂用于染料废水的吸附处理。但聚乙烯亚胺无法从处理后的溶液中分离出来,会造成废水的二次污染。
Fe3O4磁性粒子具有制备简单、分离快速、稳定性高等优点,但其在水溶液中容易发生团聚,极大限制了其在水处理领域的应用[7]。通过SiO2对其包裹改性,使磁性粒子具有高分散性、高比表面积、高顺磁性等特点,同时表面具有丰富的羟基能用于交联吸附剂,可以作为吸附剂的良好载体[8]。因此,本文研究以具有磁分离特性的Fe3O4@SiO2粒子为载体,制备Fe3O4@SiO2@PEI磁性吸附剂,并以刚果红染料为吸附质,研究pH值、吸附剂用量、吸附时间和初始质量浓度等因素对吸附性能的影响[9-11]。
1 实验部分
1.1 试剂与仪器
乙醇、氨水(质量分数为25%)、盐酸(质量分数为38%)、十二烷基苯硫酸钠、PEI(分子量 1 800)、正硅酸乙酯、冰醋酸、3-氯丙基三甲氧基硅烷(KH-570)、氯化亚铁、三氯化铁、刚果红。所用试剂均为分析纯。
HH-M2F型恒温水浴锅(巩义予华仪器有限公司)、UV-CRT765型紫外可见分光光度计(上海精密仪器有限公司)、DZF6020型真空干燥箱(上海一恒仪器有限公司)、PHSJ-6 L型pH计(上海仪电有限公司)、FA1204B型电子天平(上海精科仪器有限公司)、NA2000型氮气发生器(德州昊诚设备有限公司)。
1.2 磁性吸附剂的制备
1.2.1 Fe3O4@SiO2粒子的制备
称取6 g FeCl2·4H2O(0.003 mol)、16 g FeCl3·6H2O(0.01 mol)和0.444 g十二烷基苯硫酸钠加入到乙醇和水(体积比5∶1)组成300 mL的混合溶液中;将上述溶液注入三口烧瓶中,机械搅拌,N2保护,滴加一定量的氨水,控制反应液的pH值为7~10;氨水滴加完成后,继续恒温搅拌45 min,使之充分反应; 升温至75 ℃,保温熟化1 h;将溶液冷却至室温,依次往溶液中滴加30 mL的氨水和50 mL的正硅酸乙酯,在室温下封闭搅拌12 h[12];反应完成后,磁力分离,并用去离子水和无水乙醇洗涤3~5次,直至溶液不再浑浊,无刺激性气味;60 ℃真空干燥4 h,得到Fe3O4@SiO2磁性粒子。
1.2.2 磁性Fe3O4@SiO2@PEI吸附剂的制备
称量1 g Fe3O4@SiO2加入到三口瓶中,加入45 mL C2H5OH和15 mL H2O,超声处理10 min后缓慢加入2 mL 3-氯丙基三甲氧基硅烷,用CH3COOH调节pH值至5,在70 ℃下反应6 h;加入2.5 g PEI,搅拌反应24 h,冷却至室温,磁性分离,产物用去离子水和无水乙醇依次洗涤数次,50 ℃真空干燥,得到磁性吸附剂Fe3O4@SiO2@PEI。制备流程如图1所示。
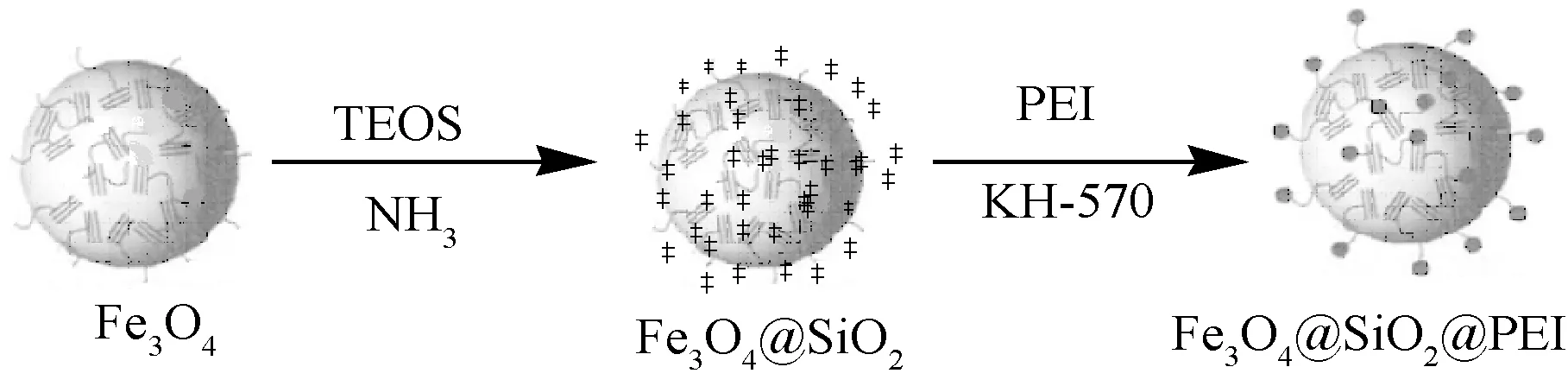
图1 Fe3O4@SiO2@ PEI的制备流程图
1.3 刚果红废水吸附实验
1.3.1 刚果红标准溶液的测定
称取 0.5 g 刚果红,加入一定量去离子水,配置成质量浓度分别为 5、10、15、20、25 和30 mg/L 的刚果红标准溶液。以水作为空白对比样,采用紫外可见分光光度计在波长为500 nm处测定标准溶液的吸光度,拟合得到刚果红标准溶液浓度C与吸光度A的表达式,相关系数为R2=0.999 8。
C=61.652A-0.2836
(1)
式中:A为刚果红溶液的吸光度;C为刚果红溶液的质量浓度,mg/L。
1.3.2 吸附实验
量取50 mL的一定质量浓度(20~70 mg/L)的刚果红溶液,并用0.1 mol/L的HCl或NaOH调节溶液pH 值(3~10),向溶液中投加一定质量(10~60 mg)的吸附剂,室温振荡吸附一定时间(10~240 min),磁性分离吸附剂后取上层清液。含刚果红上层清液采用离心处理,用紫外可见分光光度计(λ=500 nm)测定刚果红的质量浓度,每组重复测定2次,取其平均值作记录。
Fe3O4@SiO2@PEI吸附剂对刚果红废水的吸附率D(%)和吸附量qt(mg/g)用如下公式计算:
(2)
(3)
式中:A0和At分别为刚果红溶液吸附前后的吸光度;C0和Ct分别为刚果红溶液吸附前后的质量浓度,mg/L;V为含刚果红溶液的体积,L;m为吸附剂的加入量,g。
1.3.3 吸附剂再生实验
将吸附后的Fe3O4@SiO2@PEI吸附剂用去离子水洗涤数次,去除未吸附刚果红溶液,然后加入到浓度为0.1 mol/L 的盐酸溶液中,室温下搅拌20 min,磁性分离,去离子水洗涤去除多余盐酸溶液,真空干燥至恒质量[13]。
2 结果与讨论
2.1 吸附时间的影响
量取50 mL、初始质量浓度为40 mg/L的刚果红溶液,调节pH值为4,加入40 mg Fe3O4@SiO2@PEI吸附剂,室温振荡吸附。按照时间间隔 10、20、30、40、60、90、120、180、240 min,取样分析,计算样品中刚果红的质量浓度,结果如图2所示。
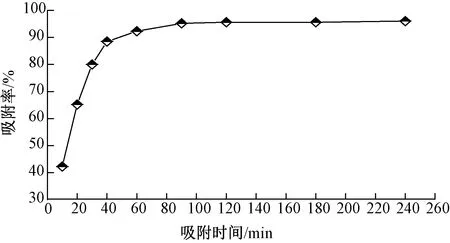
图2 吸附时间对吸附效果的影响
由图2可知,在90 min内,磁性吸附剂对刚果红的吸附速率较大,吸附率逐渐增加;之后吸附速率减小,吸附率趋于恒定。在吸附进行到90 min 时,刚果红的吸附率达到了95.52%,吸附剂表面—NH2吸附位点达到饱和状态。因此,可认为吸附剂对刚果红的去除在90 min时达到吸附平衡。
2.2 刚果红溶液pH值的影响
刚果红是一种典型的阴离子染料,与磁性吸附剂表面的活性位点依靠静电作用相互吸附,因此 pH值的变化会对吸附效果产生很大影响。取50 mL、初始质量浓度为40 mg/L 的刚果红溶液,分别调节pH值至3~10,加入40 mg Fe3O4@SiO2@PEI吸附剂,室温振荡吸附90 min,磁分离上层清液并离心,测定溶液中刚果红的质量浓度,pH值对吸附效果的影响如图3所示。
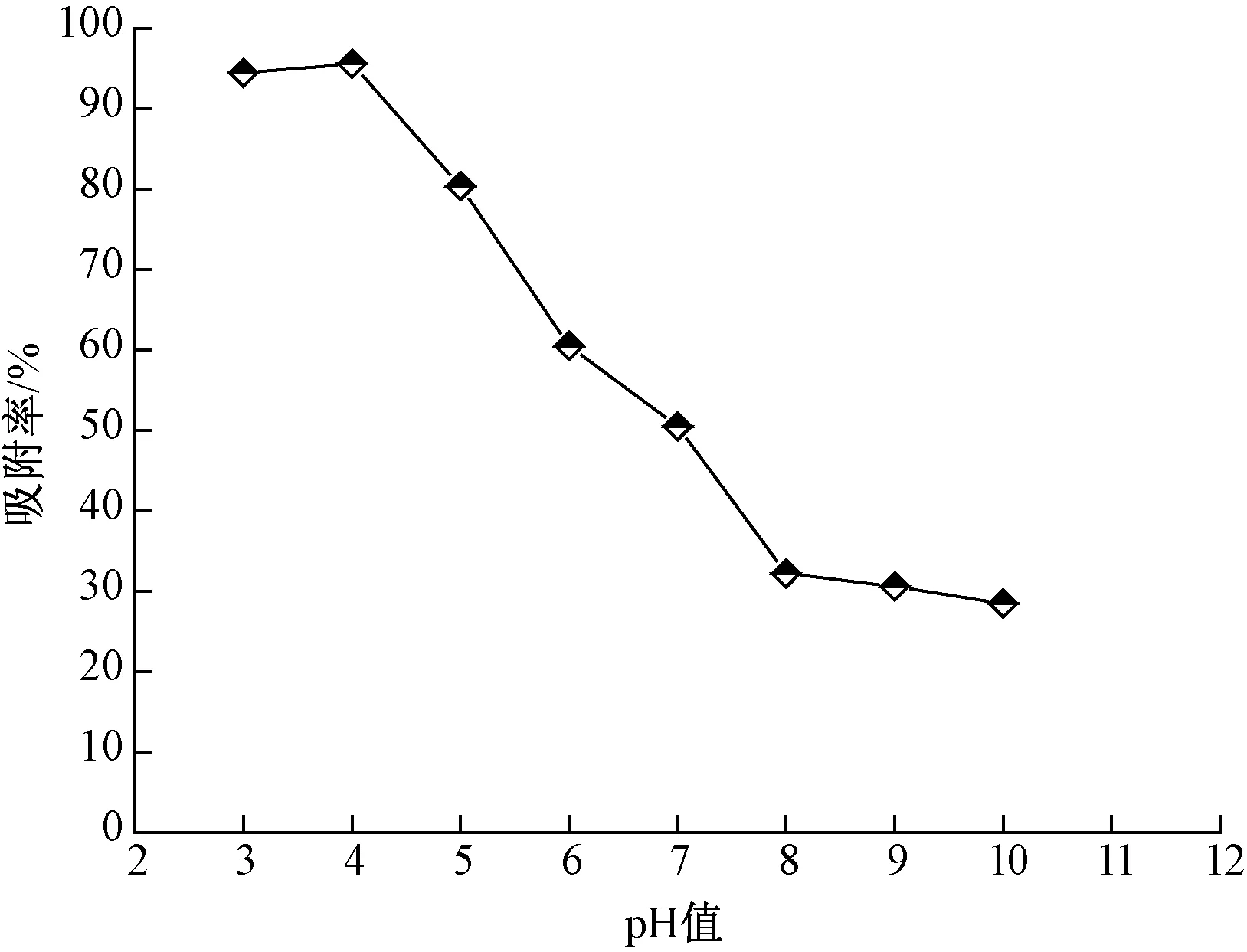
图3 pH值对吸附效果的影响
由图3可知,吸附率随溶液中pH值的增大而减小。当溶液为强酸性时,磁性吸附剂对刚果红的吸附率较高,pH值为4时,吸附率达到95.6%;此时磁性吸附剂表面—NH2质子化,呈正电特性,与溶液中带负电的阴离子静电作用强烈,吸附效果明显。当溶液pH值大于7为碱性时,磁性吸附剂表面—NH2质子化降低,活性位点减少;同时OH-会和刚果红离子竞争吸附剂表面的活性位点,造成吸附率降低。
2.3 吸附剂用量的影响
为探究吸附剂的适合加入量,在50 mL、pH值为4、初始质量浓度为40 mg/L的刚果红溶液中,加入不同用量的吸附剂,室温振荡吸附90 min,磁分离上层清液并离心,测定溶液中刚果红的质量浓度,吸附剂用量对吸附效果的影响如图4所示。
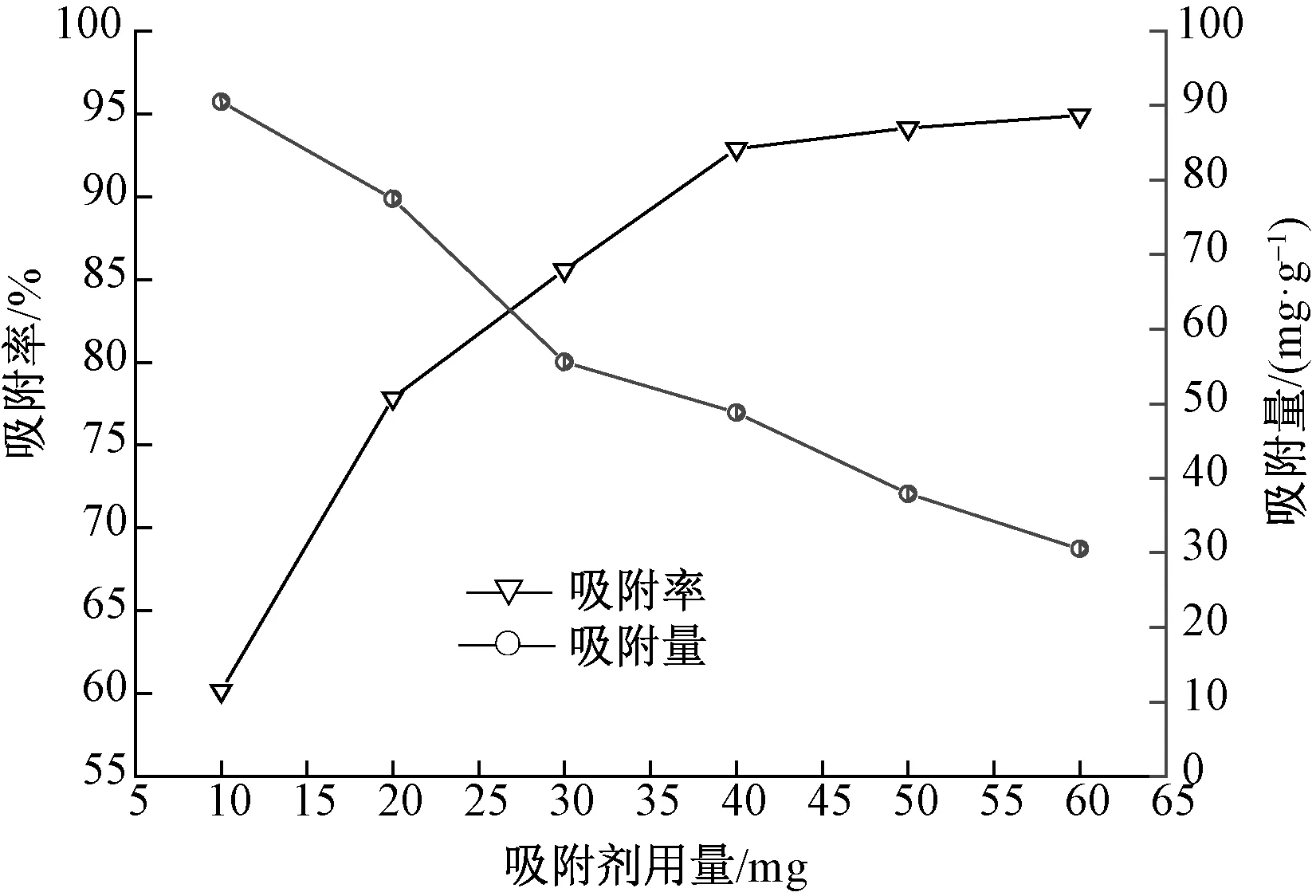
图4 吸附剂用量对吸附效果的影响
由图4可以看出,随着吸附剂用量逐渐增加,吸附率由60.2%升高到94.5%,而吸附量由90.45 mg/g降低到31.51 mg/g。对于一定浓度的吸附质,吸附剂的添加量过少,吸附不完全,吸附率较低;添加量过多,吸附剂表面吸附位点过剩,吸附不能达到饱和,吸附量较低。因此,需要在较高吸附率和吸附量的情况下选择合适的吸附剂用量。
2.4 刚果红初始质量浓度的影响
为探究刚果红初始质量浓度与吸附率及吸附量的关系,在50 mL、pH值为4的不同初始质量浓度的刚果红溶液中,加入40 mg吸附剂,室温振荡吸附90 min,磁分离上层清液并离心,测定溶液中刚果红的质量浓度,结果如图5所示。
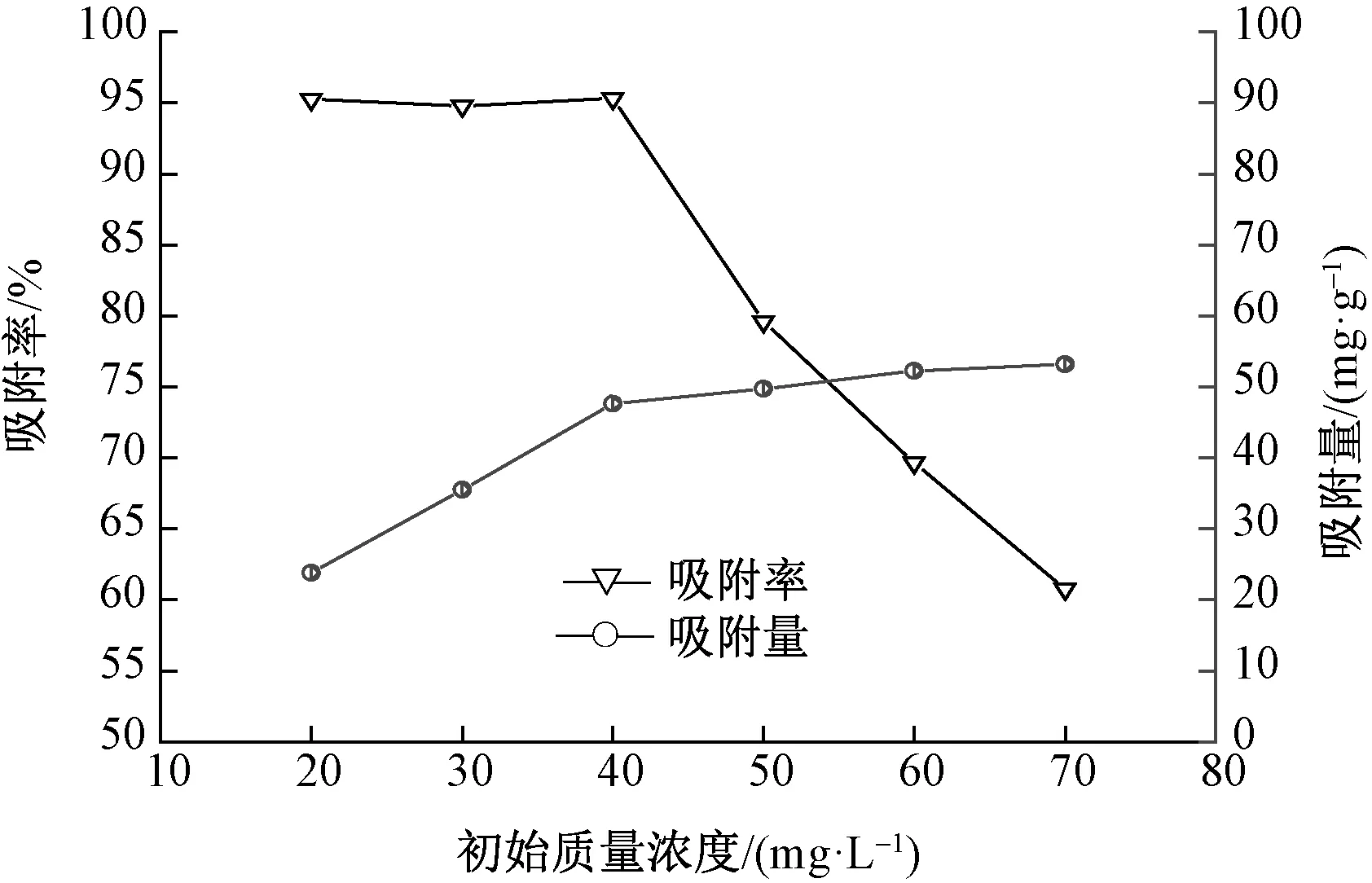
图5 初始质量浓度对吸附效果的影响
由图5可以看出,随着溶液中刚果红含量逐渐增加,吸附率呈现由平衡到减小的趋势,而吸附量则呈现增加到平衡的趋势。当初始质量浓度由20 mg/L变化到40 mg/L时,吸附率维持在95%左右,吸附量由28.3 mg/g增加到47.6 mg/g;初始质量浓度再增大时,吸收率显著下降,而吸附量则增加不明显。说明在吸附剂质量为40 mg时,吸附质量浓度为40 mg/L的溶液刚好达到饱和状态。
2.5 再生吸附剂的吸附效果
图6为Fe3O4@SiO2@PEI吸附剂解吸后,循环使用5次后的吸附效果。

图6 吸附剂循环再生对吸附的影响
从图6可以看出,磁性吸附剂在吸附/解吸循环使用5次后,对刚果红溶液的吸收率仍在90%以上。说明0.1 mol/L 的盐酸溶液能用于磁性吸附剂的再生,并有效地脱除刚果红;同时吸附剂在循环使用过程中,对刚果红的吸收率没有显著降低,表明吸附剂具有良好的稳定性、再生性和重复利用性。
3 结 论
采用交联法制备磁性Fe3O4@SiO2@ PEI吸附剂,可以有效吸附刚果红染料废水。当pH值为4、吸附剂用量为40 mg、吸附时间为90 min时,对刚果红废水的吸附率达到95.6%;同时循环使用5次后,吸收率仍在90%以上,具有良好的稳定性、再生性和重复利用性。

