赤霉素抑制剂对马铃薯离体块茎形成和发育的影响
梁力力,程鑫,崔丹丹,杨巧玲,张俊莲,王玉萍,
(1.甘肃农业大学生命科学技术学院,甘肃 兰州 730070;2.甘肃农业大学园艺学院,甘肃 兰州 730070)
赤霉素(GA)是高等植物中普遍存在的一类生长调节剂,比如,诱导细胞伸长、种子萌发、促进茎的伸长和叶片扩大、花粉成熟和果实生长、以及开花等[1-4].在植物体内GA的生物合成途径较为复杂,且种类较多,第1阶段是从异戊烯焦磷酸到贝壳杉烯,在质体中进行[7];第2阶段是从贝壳杉烯到GA12醛,在内质网中进行[1];第3阶段是由GA12醛转化成其它GA的阶段,在细胞质中进行.研究发现,植物体内GA只有少数具有生物活性[5-6]
研究发现,GA3含量的变化显著影响马铃薯匍匐茎伸长和膨大,,高水平GA3促进细胞的纵向伸长,只有低浓度GA3才能促进块茎膨大[9].很多研究表明,GA抑制剂主要分为3类,第1类是鎓类化合物,主要有矮壮素(CCC)、缩节安、氯化磷等;第2类是含氮杂环化合物,主要有多效唑(MET)、烯效唑等;第3类是酰基环己二酮类生长延缓剂,主要有调环酸钙(Pc)、抗倒酯、丁酰肼等[15].MET通过抑制贝壳杉烯到贝壳杉烯醇的氧化方式来减少GA的生物合成,外源施加MET能促进了马铃薯试管苗提早结薯,使平均直径和单薯鲜质量都显著增加,同时降低了畸形薯的概率[16];CCC通过抑制贝壳杉烯酶和焦磷酸合酶的活性来抑制GA合成的,CCC有促进马铃薯块茎提前形成的作用,外源施加CCC后,促进了马铃薯块茎增大,个数增加,提高产量等[17];Pc通过抑制α-酮戊二酸依赖性双加氧酶的活性,抑制GA的生物合成,目前没有Pc对马铃薯块茎的作用的报道[18].
目前国内外关于GA及其抑制剂的的研究主要采用的是室外浇灌或者田间喷洒,作物集中在棉花、大豆、花生等植物,一般是单独施加GA或者只施加其中一类抑制剂,而对于马铃薯离体块茎的研究甚少.前人研究表明,单独施加多效唑或矮壮素时,促进了块茎单薯鲜质量的增加,有研究表明多效唑使用浓度仅为矮壮素的1/5 000,就能使块茎单薯鲜质量增加,而对于调环酸钙在马铃薯块茎上的施用效果和生理特性的研究很少.本试验的创新之处在于对马铃薯匍匐茎同时施加GA3和3类抑制剂,分析3类抑制剂作用下的GA3对马铃薯离体块茎的影响和3类抑制剂对GA3的抑制效果.本研究主要通过探讨不同浓度的GA3和抑制剂共同作用对马铃薯试管薯离体诱导效果,通过外源生物合成抑制剂的使用,可以深入分析GA3对马铃薯块茎形成和发育造成的影响,进而为阐明GA3在马铃薯块茎发育过程中的作用机理提供理论依据.
1 材料与方法
1.1 试验材料
以马铃薯(SolanumtuberosumL.)品种“大西洋”试管苗(由甘肃省作物遗传改良与种质创新重点实验室提供)为供试材料.将试管苗接种到MS液体培养基中.培养温度(22±1)℃,光照时间16 h/d,光照强度2 000 lx,30 d后转入诱导培养基中,黑暗诱导产生匍匐茎.将匍匐茎接入含有不同浓度GA3与MET、CCC和Pc的1/10 MS液体培养基中,对照不加GA3和抑制剂,每个处理5次重复.培养40 d后,采集诱导形成的马铃薯块茎,液氮速冻,-80 ℃保存.
1.2 试验方法
1.2.1 培养基浓度设置 试验中GA3与MET、CCC与Pc的浓度设置见表1.
1.2.2 形态观察 在块茎生长发育期间,记录不同浓度的GA3与MET、CCC和Pc的处理下块茎开始形成的时间.
1.2.3 块茎直径、鲜质量、干质量和结薯率测定培养40 d后,测量不同浓度的GA3与MET、CCC和Pc处理下块茎的直径、结薯率和鲜质量、干质量.
1.3 数据处理
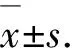
2 结果与分析
2.1 多效唑作用下赤霉素对试管薯形成的影响
结果显示,当GA3浓度为0 μmol/L和0.1 μmol/L时,单薯鲜质量、块茎平均直径和结薯率近似于正态分布,均呈现出先升高后降低的变化.MET调控的0 μmol/L的GA3在10 mg/L时达到最大值128.6 mg、4.5 mm和97.5 %,当浓度介于0.1~10 mg/L时,MET调控下的GA3促进块茎的发育,当浓度介于10~100 mg/L时对块茎发育起抑制作用,而MET浓度超过100 mg/L时,已经完全抑制了块茎的形成,块茎发育起始时间则与之相反,在10 mg/L时到达最低点,在浓度为0.1~10 mg/L时,发育起始时间逐渐降低,超过10 mg/L时,发育起始时间逐渐升高;MET调控的0.01 μmol/L的GA3在40 mg/L时达到最大值98.9 mg、4.1 mm和91.7 %,当浓度介于5~40 mg/L时,MET调控下的GA3促进块茎的发育,当浓度介于40~100 mg/L时,对块茎发育起抑制作用,而MET浓度超过100 mg/L时,块茎完全不结薯.块茎发育起始时间在40 mg/L时有一个最低点,在浓度为5~40 mg/L时,发育起始时间降低,在MET浓度介于40~100 mg/L时,起始时间稍有上升的趋势(图1),图2为GA和MET共同处理下
最佳浓度下马铃薯块茎的表型特征.
2.2 CCC作用下的GA3对离体块茎发育的影响
CCC作用下的GA3诱导出块茎的单薯鲜质量、块茎平均直径和结薯率与MET相同,近似于正态分布.0 μmol/L的GA3在CCC浓度为60 mg/L时达到最大值40.8 mg、3.47 mm和94.9%,当浓度为0.1~60 mg/L时,CCC调控下的GA3促进块茎的发育,当浓度介于60~150 mg/L时对块茎发育起抑制作用,而CCC浓度超过150 mg/L时,已经完全抑制了块茎的形成,块茎发育起始时间则与之相反,在60 mg/L时到达最低点,在浓度为0.1 ~60 mg/L时,发育起始时间逐渐降低,超过60 mg/L时,发育起始时间逐渐升高;CCC调控的0.01 μmol/L的GA3在10 mg/L时达到最大值72.5 mg、3.9 mm、87 %,当浓度介于0.1 ~10 mg/L时,CCC调控下的GA3促进块茎的发育,当浓度介于10~100 mg/L时,对块茎发育起抑制作用,而CCC浓度超过100 mg/L时,块茎完全不结薯.块茎发育起始时间在10 mg/L时有一个最低点,在浓度为0.1~10 mg/L时,发育起始时间降低,在CCC浓度介于10 ~100 mg/L时,起始时间稍有上升的趋势(图3),图4为GA和CCC共同处理下最佳浓度下马铃薯块茎的表型特征.
2.3 Pc作用下的GA3对离体块茎发育的影响
Pc作用下的GA3诱导出块茎的单薯鲜质量、块茎平均直径和结薯率与MET、CCC相似,趋于正态分布.0 μmol/L的GA3在Pc浓度为5 μg/L时达到最大值175.6 mg、5.5 mm、98.9 %,当浓度为0.1~5 μg/L时,Pc作用下的GA3促进块茎的发育,当浓度介于5~50 μg/L时对块茎发育起抑制作用,而Pc浓度超过50 μg/L时,已经完全抑制了块茎的形成,块茎发育起始时间则与之相反,在5 μg/L时到达最低点,在浓度为0.1~5 μg/L时,发育起始时间逐渐降低,超过5 μg/L时,发育起始时间逐渐升高;Pc调控的0.01 μmol/L的GA3在5 μg/L时达到最大值105.2 mg、4.3 mm、89.8 %,当浓度介于0.5~5 μg/L时,Pc调控下的GA3促进块茎的发育,当浓度介于5 μg/L~40 μg/L时,对块茎发育起抑制作用,而Pc浓度超过40 μg/L时,块茎完全不结薯.块茎发育起始时间在5 μg/L时有一个最低点,在浓度为0.5~5 μg/L时,发育起始时间降低,在Pc浓度介于5~40 μg/L 时,起始时间稍有上升的趋势(图5).图6为GA和Pc共同处理下最佳浓度下马铃薯块茎的表型特征.
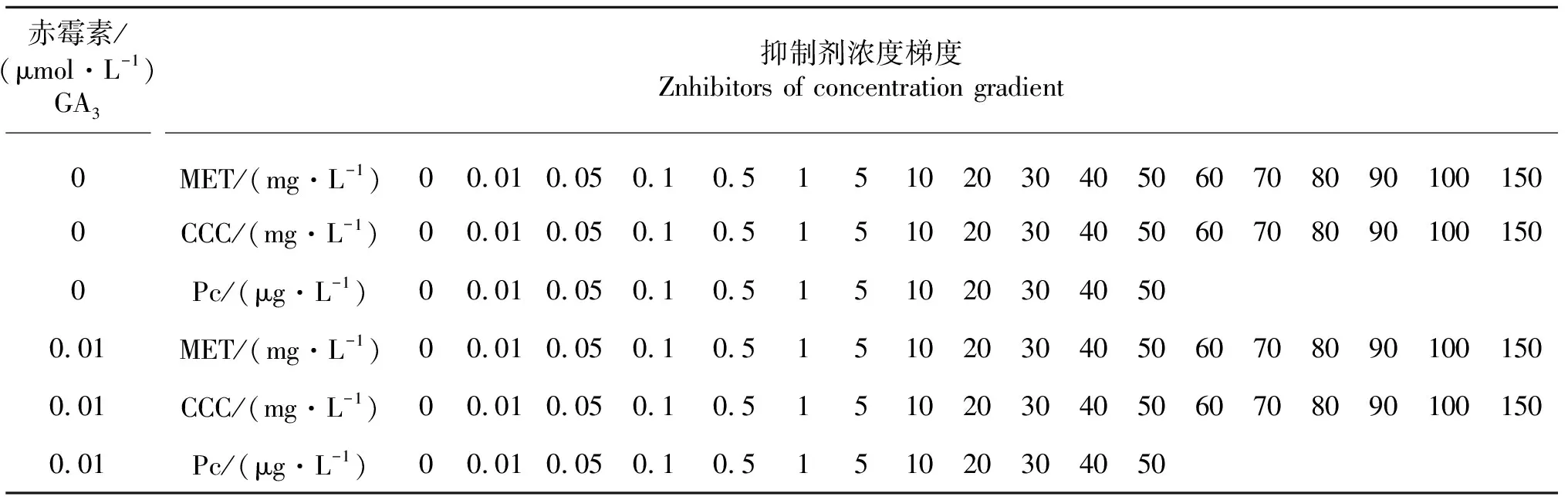
表1 赤霉素和不同抑制剂的浓度

同色柱不同字母表示同一浓度间不同处理差异显著(P<0.05),GA表示赤霉素,P表示多效唑.Different letters on the same color column indicate significant differences between treatments in the same concentration (P<0.05).GA indicates gibberellin,P indicates paclobutrarol.图1 外源赤霉素(0 μmol/L、0.01 μmol/L)以及不同浓度的多效唑处理下离体块茎下的单薯鲜质量(A)、单薯干质量(B)、块茎直径(C)、结薯率(D)和发育起始时间(E)Figure 1 The fresh weight per microtuber (A),dry weight per microtuber (B),mean diameter (C)、percentage of tuberization (D) and tuberization beginning time (E) of tubersin vitrounder exogenous GA3(0 μmol/L、 0.01 μmol/L) and different MET concentration treatments

图2 赤霉素(0 μmol/L、0.01 μmol/L)和多效唑共同处理下马铃薯离体块茎的形态特征Figure 2 The phenotypic characteristic of potato tuberin vitrounder GA3(0 μmol/L、0.01 μmol/L) and MET
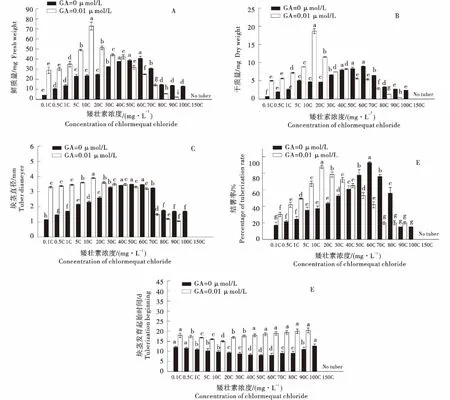
同色柱不同字母表示同一浓度间不同处理差异显著(P<0.05),GA表示赤霉素,C表示矮壮素.Different letters on the same color column indicate significant differences between treatments in the same concentration (P<0.05).GA indicates gibberellin,C indicates chlormequat chloride.图3 外源赤霉素(0 μmol/L、0.01 μmol/L)以及不同浓度的矮壮素处理下离体块茎的单薯鲜质量(A)、单薯干质量(B)、块茎直径(C)、结薯率(D)和发育起始时间(E)Figure 3 The fresh weight per microtuber (A)、dry weight per microtuber (B)、mean diameter (C)、percentage of tuberization (D) and tuberization beginning time (E) of tubersin vitrounder exogenous GA3(0 μmol/L、 0.01 μmol/L) and different CCC concentration treatments
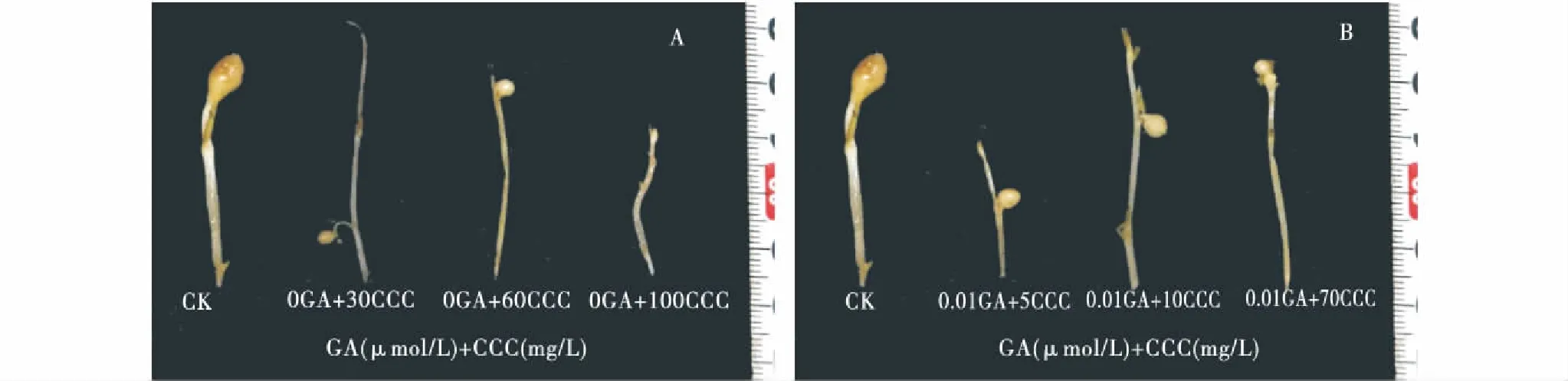
图4 赤霉素(0 μmol/L、0.01 μmol/L)和矮壮素共同处理下马铃薯离体块茎的形态特征Figure 4 The phenotypic characteristic of potato tuberin vitrounder GA3(0 μmol/L、0.01 μmol/L) and CCC
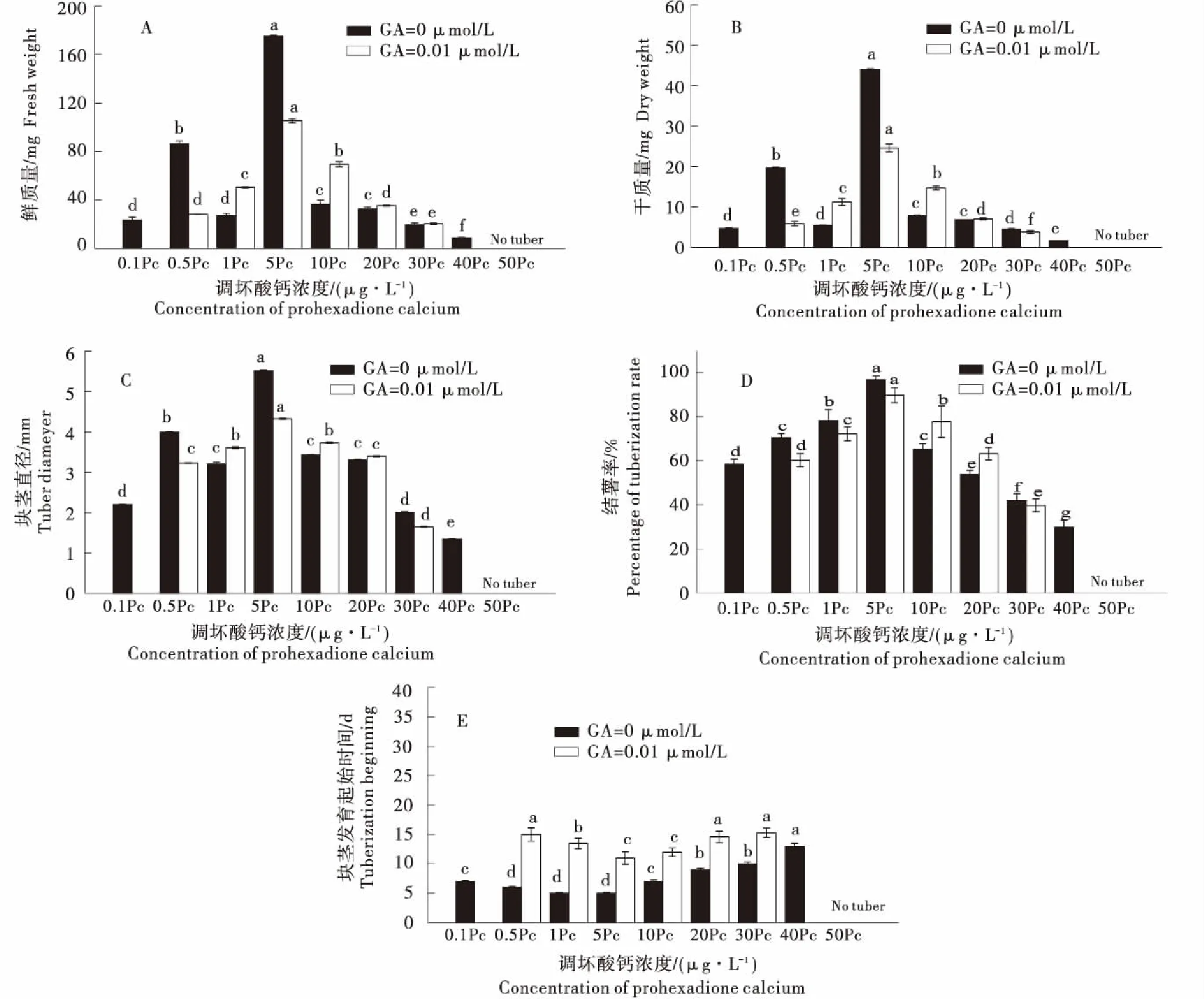
同色柱不同字母表示同一浓度间不同处理差异显著(P<0.05),GA表示赤霉素,Pc表示调环酸钙.Different letters on the same color column indicate significant differences between treatments in the same concentration (P<0.05).GA indicates gibberellin,Pc indicates prohexadione calcium.图5 外源赤霉素(0 μmol/L、0.01 μmol/L)以及不同浓度的调环酸钙处理下离体块茎的单薯鲜质量(A)、单薯干质量(B)、块茎直径(C)、结薯率(D)和发育起始时间(E)Figure 5 The fresh weight per microtuber (A)、dry weight per microtuber (B)、mean diameter (C)、percentage of tuberization (D) and tuberization beginning time (E) of tubersin vitrounder exogenous GA3(0 μmol/L、 0.01 μmol/L) and different Pc concentration treatments

同色柱不同字母表示同一浓度间不同处理差异显著(P<0.05),GA表示赤霉素,Pc表示调环酸钙.Different letters on the same color column indicate significant differences between treatments in the same concentration(P<0.05).GA indicates gibberellin,Pc indicates prohexadione calcium.图6 赤霉素(0 μmol/L、0.01 μmol/L)和调环酸钙共同处理下马铃薯离体块茎的形态特征Figure 6 The phenotypic characteristic of potato tuberin vitrounder GA3(0 μmol/L、0.01 μmol/L) and Pc
3 讨论
MET、CCC和Pc作为GA的抑制剂,分别抑制GA合成的不同阶段.GA对3类抑制剂具有一定的拮抗作用,3类抑制剂在减弱GA对马铃薯块茎的抑制效应时,产生的效果不同.离体培养条件下,外源施加GA后,促进了匍匐茎的形成和伸长,但延迟或抑制了块茎的形成.有研究表明,低浓度的GA促进花粉萌发,高浓度的GA则对花粉萌发起抑制作用[21].
MET主要通过阻止贝壳杉烯氧化为内根-异贝壳杉烯酸,从而抑制GA的生物合成[14].前人研究表明,离体培养条件下,单独外源施加GA后,促进了匍匐茎的形成和伸长,但却延迟或抑制了块茎的形成[11-14].本研究结果发现,赤霉素在多效唑的调控下,随着多效唑浓度的升高,块茎鲜质量、直径和结薯率等逐渐升高,说明多效唑能减缓GA对块茎的发育影响,但随着赤霉素浓度的升高,这种影响逐渐减弱,甚至消失,GA作为植物必不可少的激素,对植物的生长发育是非常重要的,多效唑对GA的抑制作用促进了块茎的发育,当多效唑浓度超过一定范围时,对GA的抑制作用超过了植物正常发育所需要的GA,GA含量过低导致植物不能正常发育.
CCC通过阻断焦磷酸合酶和贝杉烯合酶参与GA代谢的早期步骤,从而阻止GA的生物合成[14].前人研究表明,MET使用浓度仅为CCC的1/5 000,就能使块茎单薯鲜重量增加[16].本研究结果发现,CCC作用下的GA对马铃薯块茎发育的影响较多效唑弱,矮壮素较多效唑一边降低游离态GA的合成,一边加速结合态GA的合成,故同浓度的多效唑比矮壮素更能促进块茎的发育.
Pc在马铃薯块茎上的施用效果和生理特性的研究很少,MET和Pc可提高植物POD的活性,且Pc的作用更明显[19-20].本试验研究结果发现,较于MET和CCC,微量的Pc作用下的GA对马铃薯发育的影响更大.
4 结论
综上所述,外源施加GA和MET、CCC和Pc 3类抑制剂时,块茎的形成和发育明显受到影响;MET、CCC和Pc的浓度超过一定浓度后,匍匐茎死亡,说明GA含量过低,以至于不能满足匍匐茎生长条件,故而表明GA在植物生长过程中占据重要作用,低于一定浓度时,对马铃薯的正常发育起阻碍作用,高浓度的多效唑、矮壮素和调环酸钙可能不利于块茎的发育;三类抑制剂对赤霉素抑制的最佳浓度不同,当GA浓度分别为0 μM和0.01 μmol/L时,MET对GA抑制的最佳浓度是10 mg/L和40 mg/L,CCC对GA抑制的最佳浓度是60 mg/L和10 mg/L,Pc对GA抑制的最佳浓度均是5 μg/L;5 μg/L的Pc可能诱导出最大的单薯鲜干质量和块茎直径,说明调环酸钙对GA的抑制效果可能更好.

