五味子及其炮制品对肾精亏虚大鼠的治疗作用
赵芷含, 王馨雅, 王晓婷, 孙冬月, 高 慧
(辽宁中医药大学药学院, 辽宁 大连 116600)
五味子是木兰科植物五味子Schisandra chinensis(Turcz.) Baill. 的干燥成熟果实, 具有收敛固涩、 益气生津、 补肾宁心功效, 主治梦遗滑精、 遗尿尿频、 久嗽虚喘等症状[1]。 传统中医理论记载, 五味子“入嗽药生用, 入补药熟用”[2], 即生熟异用, 但“入补药熟用” 指的是五味子哪种炮制品尚未见明确记载, 1963 年版《中国药典》中收录的是五味子和酒五味子, 而1977 年版及以后几版变更为五味子和醋五味子。 前期课题组进行药效实验, 在一定程度上证明了五味子生熟的差异, 认为治疗肾阳虚、 肾阴虚时应选酒五味子[3-4]; 本实验建立大鼠肾精亏虚模型,研究五味子及其炮制品对肾精亏虚大鼠附睾、 肾、 睾丸组织的影响, 为酒五味子“入补药熟用” 的传统理论提供现代药理学依据。
1 材料
1.1 试药 雷公藤多苷片(10 mg/片, 批号Z43020138,湖南千金协力药业有限公司); 血清INH-B 试剂盒(批号BPE30393)、 血清FSH 试剂盒(批号BPE30597) (上海朗顿生物科技有限公司)。 五味子购于辽宁省丹东市五味子GAP 基地, 经辽宁中医药大学尹海波教授鉴定为木兰科植物五味子Schisandra chinensis (Turcz.) Baill. 的干燥成熟果实。
1.2 仪器 数控超声波清洗器(KQ-250DB 型, 昆山市超声仪器有限公司); 电子分析天平 (万分之一, Acculab型; 十万分之一, CP225D 型, 德国Sartorius 公司); 移液器、 MultiskanMK3 酶标仪(美国Thermo 公司); 卧式超低温保存箱(DW-86W100 型, 青岛海尔电器有限公司); 生物显微镜(BX51 型)、 光学显微镜(BX60 型) (日本奥林巴斯公司); 电热恒温水浴锅(DZKW-D-2 型, 北京永光明医疗仪器有限公司); 病理组织包埋机; 组织切片机。
1.3 动物 SD 大鼠, 雄性, 体质量180~220 g, 由辽宁长生生物技术有限公司提供, 动物生产许可证号SCXK (辽)2010-0001, 室温(25 ℃)、 相对湿度50%条件下适应性饲养1 周。
2 方法
2.1 样品制备
2.1.1 造模药物 将雷公藤多苷片研磨后, 加入0.5%羧甲基纤维素钠(CMC-Na) 溶液, 超声溶解, 即得(3 g/L)。
2.1.2 酒五味子、 醋五味子 参照前期确定的炮制工艺自行制备[5]。
2.1.3 样品水煎液 取适量生、 酒、 醋五味子, 10 倍量水回流提取3 次, 每次1 h, 合并滤液并浓缩, 即得(280 g/L)。
2.2 造模与给药 连续灌胃雷公藤多苷水溶液(10 mg/kg) 30 d[3-4]以建立肾精亏虚大鼠模型, 大鼠皮毛体毛松懈、 少有光泽、 行为迟缓、 精神状态不佳、 畏寒聚堆、 体质量下降时可认为造模成功。 将大鼠随机分成模型组、 生五味子组、 酒五味子组、 醋五味子组, 另设空白对照组, 每组10 只, 给药组大鼠按2.8 g/kg 剂量灌胃给药,模型组、 空白组大鼠给予等体积生理盐水, 连续30 d, 最后1 次给药后30 min 处死大鼠, 取出肾脏、 睾丸、 附睾组织进行相关检测。
2.3 检测指标
2.3.1 附睾、 肾组织质量 取大鼠新鲜附睾、 肾组织, 精密称定质量。
2.3.2 睾丸组织病理学检查 取新鲜大鼠单侧睾丸组织,4%多聚甲醛溶液固定, 常规石蜡包埋, 苏木精-伊红染色后在光学显微镜下进行检查。
2.3.3 血清INH-B、 FSH 水平测定 按试剂盒说明书操作步骤进行测定。
2.3.4 生精细胞病理学检查 取大鼠单侧睾丸, Bouins 溶液固定, 酒精脱水, 石蜡包埋, HE 染色, 在光学显微镜下观察生精细胞凋亡, Cosentino 法对睾丸组织结构进行4 分制评分[正常睾丸组织, 生精上皮排列规则, 计为1 分;生精上皮排列不规则, 结构松散(彼此间无黏附), 紧贴精细小管排列, 计为2 分; 生精上皮排列更加不规则, 而且有脱落、 缺失, 可见核固缩现象, 精细小管边界模糊不清, 计为3 分; 紧贴精细小管的生殖细胞出现明显凝固性坏死, 计为4 分], Johnson 法[6]评估精子发生和障碍程度[生精功能正常, 计为10 分; 各阶段都存在生精细胞, 但其布列紊乱, 计为9 分; 生精小管中含精子量5 ~10 个,计为8 分; 无精子, 但有许多精子细胞, 计为7 分; 无精子, 仅有少量精子细胞(5 ~10 个), 计为6 分; 无精子,但有许多精母细胞, 计为5 分; 无精子, 仅有少量精母细胞(<5 个), 计为4 分; 仅有精原细胞, 计为3 分; 没有生精细胞, 只有支持细胞, 计为2 分; 管腔内无细胞, 计为1 分]。
2.3.5 生精细胞凋亡率测定 采用原位末端标记法(TUNEL 法), 严格按照试剂盒说明书操作步骤进行, 每张病理切片在光学显微镜下随机拨取10 个生精小管, 读取数量后, 计算生精细胞凋亡率。
2.4 统计学分析 通过SPSS 17.0 软件进行处理, 数据以±s) 表示。 以P<0.05 为具有显著性差异。
3 结果
3.1 五味子对大鼠附睾、 肾组织质量的影响 表1 显示,与模型组比较, 给药组大鼠附睾、 肾组织质量显著增加(P<0.01), 以酒五味子组更明显(P<0.01)。
表1 五味子对大鼠附睾、 肾组织质量及INH-B、 FSH 水平的影响s, n=10)

表1 五味子对大鼠附睾、 肾组织质量及INH-B、 FSH 水平的影响s, n=10)
注:与模型组比较,∗∗P<0.01;与生五味子组比较,△P<0.05,△△P<0.01
空白对照组 — 0.78±0.10∗∗ 0.46±0.05 0.80±0.01∗∗ 0.85±0.09∗∗模型组 — 0.62±0.02 0.28±0.02 0.36±0.03 0.37±0.02生五味子组 2.8 0.69±0.02∗∗ 0.34±0.01∗∗ 0.53±0.02∗∗ 0.44±0.02∗∗酒五味子组 2.8 0.76±0.09∗∗△△ 0.41±0.04∗∗△△ 0.76±0.01∗∗△△ 0.75±0.02∗∗△△醋五味子组 2.8 0.73±0.07∗∗△ 0.37±0.03∗∗△ 0.63±0.02∗∗△△ 0.64±0.03∗∗△△
3.2 五味子对大鼠INH-B、 FSH 水平的影响 表1 显示,与模型组比较, 给药组大鼠INH-B、 FSH 水平显著升高(P<0.01), 以酒五味子组更明显(P<0.01)。
3.3 五味子对大鼠睾丸组织病理形态学的影响 图1 显示, 空白对照组大鼠睾丸生精小管呈卵圆形或圆形, 形态圆而规则, 含有大量生殖细胞, 精原细胞紧密黏附在精小管的基底膜上, 呈圆形或扁圆形, 生精细胞在不同时期排列整齐, 紧密, 有序, 层次分明; 模型组大鼠睾丸生精小管的生精上皮明显变薄, 细胞层次杂乱, 一些生精细胞脱落, 并出现轻微聚团现象, 管腔内充满各级生精细胞, 精母、 精原细胞数减少, 精子细胞、 精子减少量更明显, 细胞体积明显缩小, 睾丸间质细胞出现轻度肿大, 间质细胞减少, 出现较大空隙; 生五味子组大鼠睾丸生精小管呈近椭圆形或圆形, 生精小管含有大量精子, 生精细胞排布较疏松, 细胞层次减少; 酒、 醋五味子组大鼠睾丸生精小管呈卵圆形或圆形, 细胞排布紧密, 并与生精小管基底膜紧密连接, 生精细胞数略有减少, 部分区域可见脱落的小量生精细胞, 但结构清楚, 层次较分明。
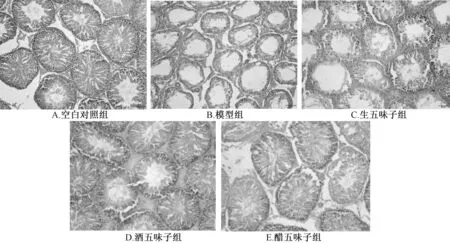
图1 五味子对大鼠睾丸组织病理形态学的影响(HE 染色, ×200)
3.4 五味子对大鼠生精细胞的影响 图2 显示, 空白对照组大鼠生精细胞排列致密紧凑, 数量较多; 模型组大鼠生精细胞明显减少, 布列紊乱无序; 生、 酒、 醋五味子组大鼠生精细胞数目明显高于模型组, 数量多, 排列致密紧凑。
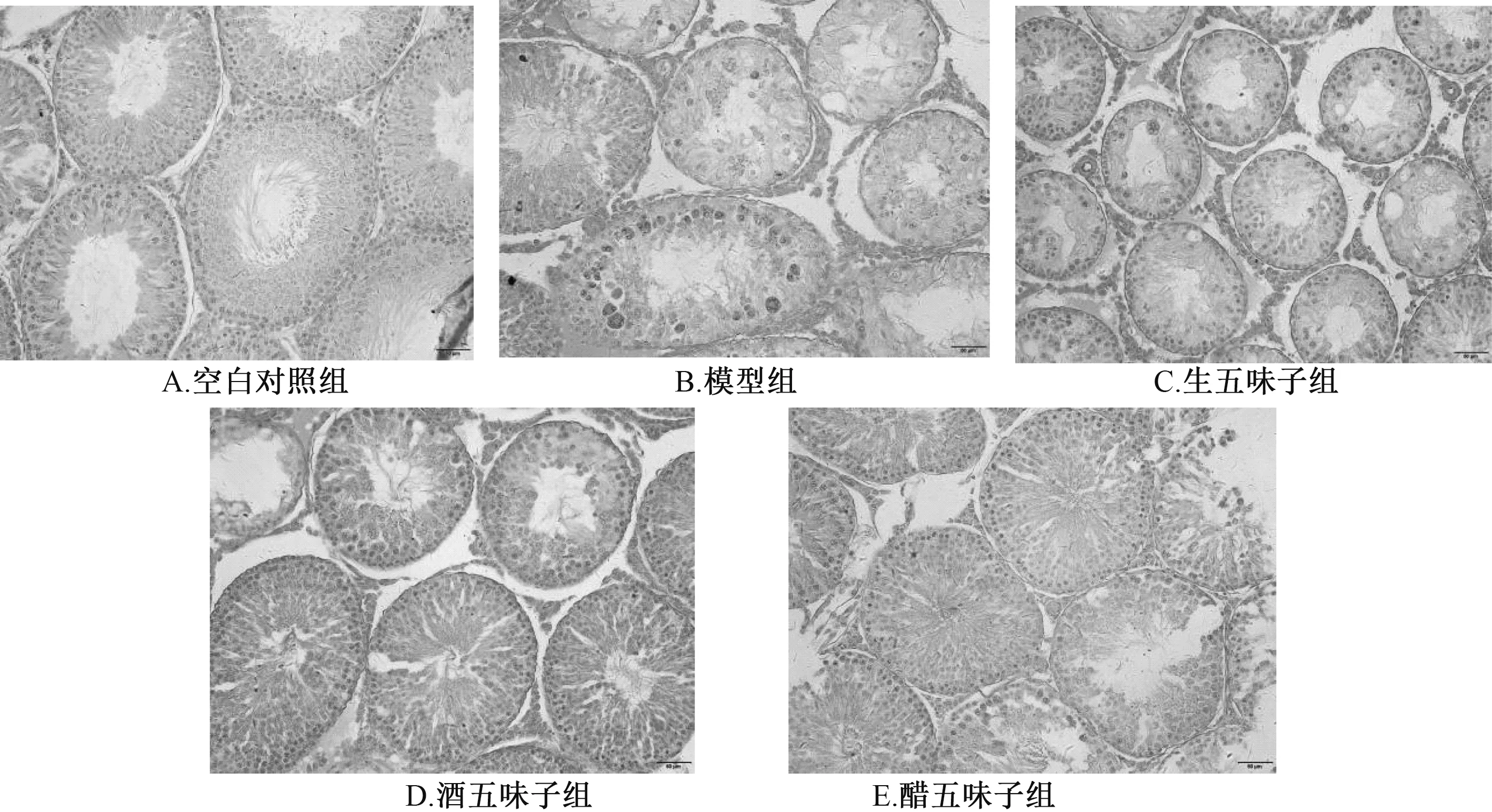
图2 五味子对大鼠生精细胞的影响(HE 染色, ×400)
3.5 五味子对大鼠Cosentino 评分、 Johnson 评分、 凋亡率的影响 表2 显示, 与模型组比较, 生五味子组大鼠仅Cosentino 评分显著降低(P<0.01), 而酒、 醋五味子组大鼠Cosentino 评分、 凋亡率显著降低(P<0.01), Johnson 评分显著升高(P<0.01), 以酒五味子组更明显(P<0.01)。
表2 五味子对大鼠Cosentino 评分、 Johnson 评分、 凋亡率的影响s, n=10)

表2 五味子对大鼠Cosentino 评分、 Johnson 评分、 凋亡率的影响s, n=10)
注:与模型组比较,∗∗P<0.01;与生五味子组比较,△P<0.05,△△P<0.01
空白对照组 — 1.01±0.01∗∗ 9.78±0.21∗∗ 10.51±4.09∗∗模型组 — 3.31±0.16 8.36±0.35 31.37±6.02生五味子组 2.8 2.00±0.07∗∗ 8.53±0.42 25.44±8.72酒五味子组 2.8 1.35±0.09∗∗△△ 9.56±0.81∗∗△△ 15.75±5.06∗∗△△醋五味子组 2.8 1.84±0.15∗∗△ 9.23±0.62∗∗△ 20.64±4.73∗∗△
4 讨论
抑制素B (INH-B) 参与精子发生, 对预测不育患者无精子症和精子获得率具有重要意义, 它主要由睾丸支持细胞合成, 是评估精子发生的直接有效内分泌指标[7], 当睾丸生精功能受损时, 血清中其水平有所降低[8]; 卵泡刺激素(FSH) 也称为精子生成素[9], 主要作用于睾丸支持细胞, 促进睾丸曲细精管精子生成[9], 在支持细胞增殖、分化、 成熟、 分泌中起着关键作用, 当它与支持细胞膜上其受体结合后, 可使支持细胞内环腺嘌呤核苷酸(cAMP)水平升高, 从而促使其合成并分泌多种物质[10], 可直接或者间接介入生精细胞的发育成熟, 促进睾丸曲精管生产精子。 另外, 精子本身在发生过程中就存在生精细胞凋亡现象, 机体可通过凋亡来维持精子数量动态平衡, 在一些特殊情况下可诱导生殖细胞凋亡增长[10-11], 一旦生精细胞过度凋亡, 将会影响精子产生量, 导致各种生精阻滞。
雷公藤多苷等多种药物和化学毒物对支持细胞有生殖毒性作用, 可损害生精功能[11-14]。 本实验发现, 肾精亏虚模型大鼠附睾、 肾组织质量明显减少, 而给药后其质量明显增加, 其中酒、 醋五味子效果优于生五味子, 又以前者更强; 模型大鼠血清INH-B、 FSH 水平及生精功能明显下降, 而给药后可明显改善两者水平, 减少生精细胞脱落,从而提高大鼠生精功能, 其中酒、 醋五味子效果优于生五味子, 又以前者更强。
综上所述, 五味子炮制后能增强对肾精亏虚大鼠的治疗作用, 以酒五味子更明显, 故临床上“入补药熟用” 时宜选用该炮制品。

