低温胁迫下6种木兰科植物的生理响应及抗寒相关基因差异表达
李瑞雪,金晓玲,胡希军,汪结明,罗 峰,张方静
1 中南林业科技大学,长沙 410004 2 湖南科技大学,湘潭 411201 3 中南林业科技大学湖南省环境资源植物开发与利用工程技术研究中心,长沙 410004
木兰科(Magnoliaceae)植物花色艳丽,花香袭人, 树姿优美,是珍贵的园林绿化树种。木兰科植物喜温暖湿润的气候,耐寒性较差,主要集中分布于我国东南至西南部,向东北及西北地区逐渐减少,其“抗寒不常绿,常绿不抗寒”的特点极大地限制了这一珍贵的树种在我国北方城市中的应用,北方高寒地区引种的木兰科树种常遭受到严重冻害[1- 3]。因此,筛选抗寒性强的常绿木兰科树种,研究低温条件下其耐寒生理和分子机制,对提高木兰科植物的耐寒适应性,并将该物种向高寒地区成功引种栽培,丰富改善我国北方城市冬季萧条的园林景观,推进城市园林建设具有重要意义。
低温限制植物的生长、发育和地理分布,对植物的影响显著大于其他环境胁迫因素[4- 6]。低温胁迫不但影响植物生物量、叶、茎等形态指标的变化,而且引起植物新陈代谢紊乱,严重低温胁迫下甚至导致植株死亡[7- 9]。研究表明,植物感受到低温信号后,启动防御机制,细胞膜透性增加,活性氧产生,保护酶活性增强,渗透调节物质如可溶性蛋白(SP)、可溶性糖(SS)和游离脯氨酸(Pro)[10- 11]和膜脂相变及膜脂过氧化产物丙二醛(MDA)含量积累[12- 14],而与代谢相关的生化途径会被抑制[15- 16]。在植物抗寒性研究中,低温半致死温度(LT50)及相关生理指标常被作为评价植物抗寒性的重要参考指标[17- 20]。植物的抗寒性是由多因素联合控制的综合性数量性状,而仅依据单一的生理指标难以准确全面地反映出植物抗寒性的强弱,对植物抗寒性的评价应选取若干具有代表性的生理生化指标进行综合评价[21]。隶属函数法作为抗性综合评价的科学方法,能比较准确地筛选出与抗寒性密切相关的典型指标,反映植物之间抗寒性的差异,该方法已应用于柑橘(Citrusreticulata)[22]、冬青(lexchinensis)[23]、黄梁木(Neolamarckiacadamba)[24]、苔草 (Carextristachya)[25]、小麦(Triticumaestivum)[26]、苜蓿草(Lotuscorniculatus)[27]等植物的抗寒性研究中,但在木兰科植物中却鲜见报道。低温环境下植物的生理生化机能受多种基因的相互调节而发生变化,并进一步诱导特定基因的表达以抵御逆境[28- 29]。第二代高通量测序技术能够对大规模转录本进行快速鉴定和功能分析,检测基因的表达差异,较全面地揭示逆境胁迫下整个基因组水平的表达情况,作为研究植物基因功能的重要手段,已经在低温响应机制、关键基因挖掘等方面取得了较大进展,被广泛应用于拟南芥(Arabidopsisthaliana)[30]、小麦[31- 32]、桉树(Eucalyptusrobusta)[33]、橄榄树(Oleaeuropaea)[34]等植物冷适应和低温响应机制的研究中。目前已发现数百个基因参与到植物对冷胁迫的应答反应[35],XU等[36]通过对野生山葡萄(Vitisamurensis)应对冷胁迫的转录组进行分析,发现野生山葡萄是通过控制一些基因的差异表达来响应冷胁迫。目前,国内外对木兰科植物的研究多集中在杂交育种及无性系繁植方面[37- 40],对其抗寒性的研究非常匮乏,偶见抗寒生理指标的比较分析[41- 43],从分子水平上对木兰科植物抗寒机制的研究更是鲜见报道,仅见鹅掌楸(Liriodendronchinense)的相关报道[44]。
为解析木兰科植物的抗寒机制,本研究选用乐东拟单性木兰(Parakmerialotungensis)、六瓣含笑(Micheliamartinii‘Tiny’)、阔瓣含笑(M.platypetala)、峨眉含笑(M.wilsonii)、杂交含笑(M.martinii‘Tiny’♀×M.shiluensis♂)、红花深山含笑(M.maudiaevar. rubicunda) 为材料,测定其在不同低温下的相对电导率(REC),拟合Logistic方程计算各树种的低温半致死温度(LT50),依据各相关生理指标的差异,将其与LT50进行相关性分析, 运用隶属函数法计算相关生理指标的隶属函数值,按平均隶属度大小对6种木兰科植物进行抗寒性排序,建立科学的木兰科植物抗寒性评价体系。本课题组前期研究中从乐东拟单性木兰无性系抗寒转录组测序中发现2个抗寒相关调控基因HSP90热激蛋白基因(GenBank登陆号MG932087)和WRKY33转录因子(GenBank登陆号MG932087)在响应低温胁迫过程中显著上调或下调表达。另外其他研究亦表明,HSP热激蛋白和WRKY转录因子家族基因在植物响应非生物胁迫中具有重要的转录调控功能[45- 47]。为进一步分析低温胁迫过程中这2个抗寒差异基因在6种木兰科植物中的表达规律, 以HSP90和WRKY33基因的 EST保守序列设计特异引物,通过实时荧光定量PCR(quantitative Real-Time PCR,qPCR)技术分析了HSP90和WRKY33基因在6个木兰科树种之间的表达差异,为揭示木兰科植物的抗寒机理和抗寒品种选育提供理论和实践依据。
1 材料与方法
1.1 材料及处理
以乐东拟单性木兰、六瓣含笑、阔瓣含笑、峨眉含笑、杂交含笑和红花深山含笑6种木兰科植物的无性系盆栽苗为供试材料。2016年12月3日分别选取各树种生长良好,长势一致的扦插栽苗各54株移栽到花盆并置于温室(温度:25℃,湿度65%:光强:200 uEm;光周期:14 h光照/10 h黑暗)中培养2周。试验共设6个处理,每个处理3株,3次重复。以0℃处理为对照,分别在人工低温气候箱进行0℃、-5℃,-10℃、-15℃、-20℃和-25℃低温下胁迫2 h,从各树种各处理植株选取当年生侧枝的成熟叶片,用于电导率和各相关生理指标的测定。同时迅速取各植株顶端幼嫩叶片装入到离心管中立即投入到液氮中速冻,以并置于-80℃冰箱中保存,用于RNA 的提取和qPCR试验。以上试验重复3次。
1.2 试验方法
1.2.1电导率及生理生化指标的测定
参照朱海根[48]的电导法在DDS- 310 型电导仪上测定叶片相对电导率。参照陈建勋[49]的方法测定各项生理指标。丙二醛(MDA) 含量采用硫代巴比妥酸(TBA)显色法测定,游离脯氨酸(Pro)含量采用酸性茚三酮法测定,超氧化物歧化酶(SOD)活性采用NBT光还原法测定,愈创木酚法测定过氧化物歧化酶(POD)活性,考马斯亮蓝G- 250法测定可溶性蛋白(SP)含量,可溶性糖(SS)含量用蒽酮比色法测定。
1.2.2总RNA提取与cDNA合成
采用Trizol试剂盒(上海闪晶分子生物科技有限公司)提取各植株叶片的总RNA,参照试剂盒说明进行提取。利用1%琼脂糖电泳、QubitFluorometer检测样品RNA浓度,NanoDrop 2000检测样品RNA纯度,Agilent 2100检测样品RNA完整性及RIN值。采用qPCR逆转录专用试剂盒PrimeScript TMRT reagent Kit (Perfect Real Time)(大连TaKaRa公司)合成 cDNA,具体方法详见试剂盒说明书。
1.2.3qPCR 候选基因与引物设计
用于qPCR分析的2个差异表达基因及特异引物见(表1)。选择Beta Actin(β-Actin)作为内参基因。特异引物的设计使用Primer premier 6.0 软件。qPCR分析在Strata gene MX3000p(上海智岩科学仪器有限公司)上进行,每个样品3次重复,采用 EvaGreen2x qPCR MasterMix-Low ROX(abm,Canada)试剂盒进行qPCR检测,方法参照试剂盒的操作说明。具体为,热循环反应条件为95℃预热10 min,然后95℃15 s、55℃30 s及72℃30 s循环40次,在每个周期结束时测量荧光。扩增反应结束后利用熔解曲线检测产物特异性: 将该反应体系从60℃ 缓慢升温至97℃,每升高1℃采集5次荧光信号。

表1 候选抗寒基因及qPCR引物
R2表示标准曲线cDNA 模板浓度与CT 值的相关系数
1.3 数据处理与分析
参照张文娥[50]的方法计算抗寒隶属函数值。如植物的叶片生理指标与抗寒性呈正相关,则将其隶属值累加,取平均数以评定其抗寒性,公式如下:
R(Xi)=(Xi-Xmin)/(Xmax-Xmin)
如指标与抗寒力呈负相关,则用反隶属函数计算,公式如下:
R(Xi)=1-(Xi-Xmin)/(Xmax-Xmin)
式中,R为隶属函数值;Xi为某项指标测定值;Xmin、Xmax为所有参试材料中该项指标的最小值和最大值。
参照许瑛等[51]的方法,根据电导率拟合Logistic方程:y=K/(1+ae-bx),其中y代表不同低温处理下的相对电导率,K代表电导率的饱和值(最大值为100),x表示胁迫处理温度,a、b代表回归系数,将方程进行线性化处理求出a、b的值,计算半致死温度(LT 50): LT 50 =lna/b。
参照李楠[52]采用2-ΔΔC T法计算 qPCR 试验中的基因相对表达量,计算公式为:基因相对表达量= 2-ΔΔCT。其中,ΔΔCT计算公式为: ΔΔCT=ΔCT (试验组)-ΔCT(对照组); 试验组或对照组的ΔCT计算公式为:ΔCT=CT(目的基因)-CT(内参基因)。利用Excel 2016、 Originpro 2017、SPSS 21.0软件进行数据分析。
2 结果与分析
2.1 低温胁迫下叶片的相对电导率变化和半致死温度
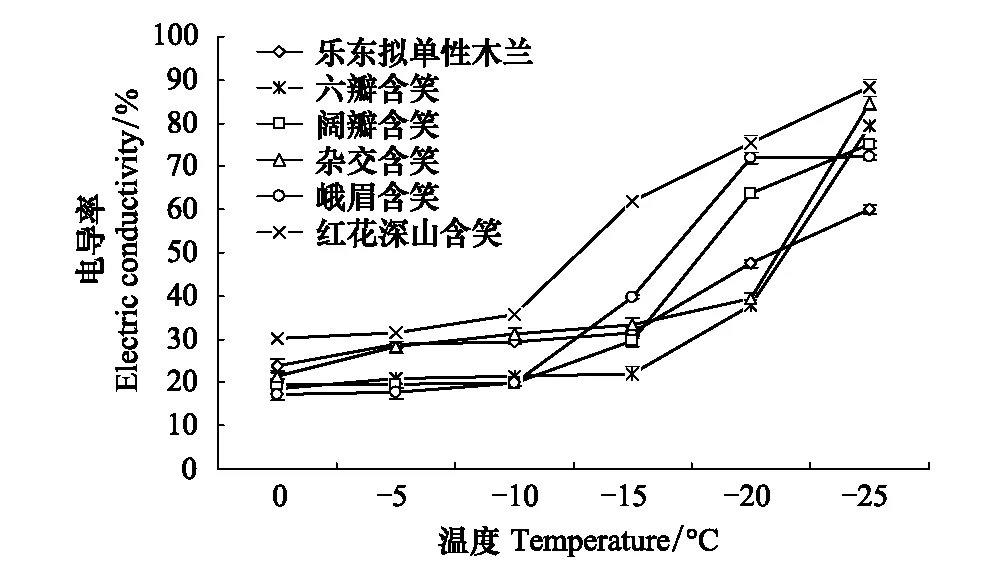
图1 不同低温下6种木兰科植物的相对电导率变化 Fig.1 Changes in relative electric conductivity of six varieties of Magnoliaceae under different low temperatures
由图1可知,随处理温度的下降,6个树种的相对电导率(REC)基本呈逐渐升高的趋势,当温度高于低温半致死温度(LT50)REC升高缓慢,低于LT50后REC则迅速升高。这说明随温度的降低,各树种叶片细胞膜受损愈加严重,膜透性也逐渐增大。整个低温过程中,红花深山含笑的REC都显著高于其余5个树种(P<0.05)。在0—-10℃,除了红花深山含笑外,其余5个树种的相对电导率差异不显著(P>0.05)。当温度低于-10℃时,红花深山含笑的REC开始迅速升高,-15℃时,阔瓣含笑、杂交含笑和峨眉含笑REC也迅速升高且处理间差异不显著(P>0.05),乐东拟单性木兰和六瓣含笑在-20℃后REC才开始迅速升高,这表明LT50出现越晚的树种越能抵御低温的伤害。
如表2所示,6个树种的相对电导率的R2均在0.9以上,说明各树种的REC与0—-25℃低温处理2 h的LT50之间呈极显著正相关。6种木兰科植物的LT50在-22.06—-10.64℃,其中乐东拟单性木兰和六瓣含笑的LT50低于-20℃,峨眉含笑、杂交含笑和阔瓣含笑的在-20—-15℃,而红花深山含笑的LT50为-10.64℃。6种木兰科植物的LT50从低到高的顺序为:乐东拟单性木兰<六瓣含笑<阔瓣含笑<杂交含笑<峨眉含笑<红花深山含笑。
表2 6种木兰科植物相对电导率的Logistics方程及低温半致死温度(LT50)
Table 2 Logistics equation of the relative electric conductivity and the median lethal temperature(LT50)of six varieties of Magnoliaceae under different low temperatures

品种VarietyLogistics方程Logistics equation半致死温度/℃ Median lethal temperature R2乐东拟单性木兰P. lotungensisy=100/(1+3.69e-0.059x)-22.06 0.930六瓣含笑M. martinii‘Tiny’ y=100/(1+6.237e-0.091x)-20.120.919阔瓣含笑M. wilsonii y=100/(1+6.01e-0.102x)-17.510.942杂交含笑M. platypetalay=100(1+3.829e-0.079x)-16.790.962峨眉含笑M. martinii‘Tiny’ ♀×M. shiluensis ♂y=100/(1+7.44e-0.120x)-16.680.937红花深山含笑M. maudiae var. rubicunday=100/(1+2.80e-0.097x)-10.640.968
R2为相关性大小,0.7—0.9表示相关性显著,0.9以上表示相关性极显著
2.2 对可溶性蛋白含量的影响
如图2所示,在0℃低温处理下,6种木兰科植物叶片可溶性蛋白(SP)含量除了红花深山含笑外,其余5个树种间差异不显著且随温度的降低呈先升后降的单峰变化。乐东拟单性木兰和六瓣含笑的峰值在-20℃,阔瓣含笑、杂交含笑、峨眉含笑的峰值均在-15℃,而红花深山含笑至-10℃达到峰值,峰值时,SP含量和增幅从高到低依次为乐东拟单性木兰>六瓣含笑>阔瓣含笑>峨眉含笑>杂交含笑>红花深山含笑,分别比0℃时增加了的123.66%、96.65%、96.43%、73.97%、52.74%和46.85%。可见,LT50越低的树种其峰值出现得越晚,SP含量增幅越高。峰值之后,LT50越低的树种可溶性蛋白含量下降幅度越大,到了-25℃,可溶性蛋白含量较其峰值时下降幅度最大的是乐东拟单性木兰,下降了3.43 μg/g,其次为六瓣含笑,下降了2.97 μg/g,下降幅度最小的是红花深山含笑,仅下降了1.69 μg/g。
2.3 对可溶性糖含量的影响
如图3所示,6种木兰科植物叶片SS含量随温度的降低逐渐升高。0℃处理下,各树种叶片的SS含量差异不显著(P>0.05),低于0℃后,乐东拟单性叶片的SS含量始终保持最高水平,其次为六瓣含笑,红花深山含笑叶片的SS含量始终处于最低水平。-25℃时,6种木兰科植物叶片的SS含量从高到低依次为乐东拟单性木兰>六瓣含笑>阔瓣含笑>杂交含笑>峨眉含笑>红花深山含笑,分别比0℃时增加了451.35%、328.31%、265.25%、280.00%、240.98%和174.154%。可见,LT50越低的树种在低温下积累的SS越多。
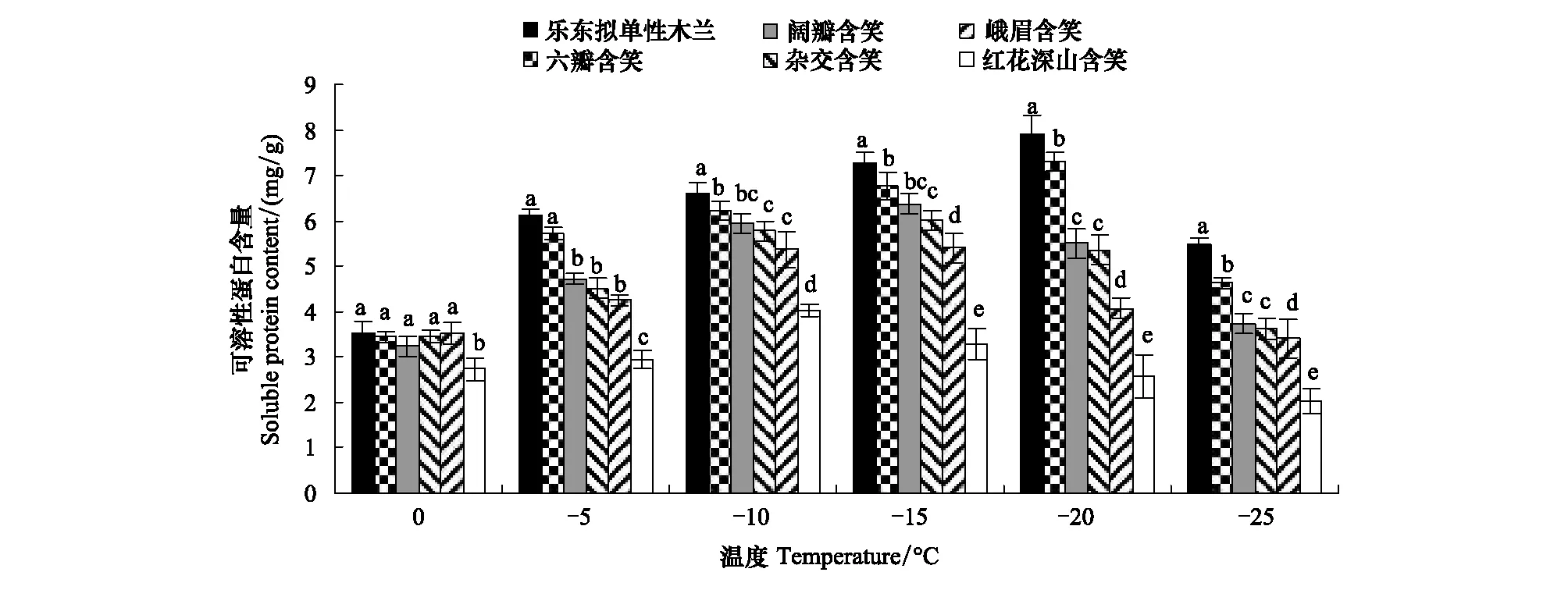
图2 不同低温下6种木兰科植物可溶性蛋白含量的变化Fig.2 Changes in soluble protein content of six varieties of Magnoliaceae under different low temperatures

图3 不同低温下6种木兰科植物可溶性糖含量的变化Fig.3 Changes in soluble sugar content of six varieties of Magnoliaceae under different low temperatures
2.4 对游离脯氨酸含量的影响
在低温胁迫过程中, 6种木兰科植物叶片Pro含量呈先升后降的趋势(图4)。乐东拟单性木兰和六瓣含笑叶片Pro含量的峰值在-20℃,阔瓣含笑、杂交含笑、峨眉含笑的峰值在-15℃,红花深山含笑的峰值在-10℃。至峰值时6种木兰科植物叶片的Pro含量从高到低依次为乐东拟单性木兰>六瓣含笑>峨眉含笑>杂交含笑>阔瓣含笑>红花深山含笑, 分别比0℃时增加了374.28%、366.91%、339.87%、319.04%、307.36%和165.78%。峰值之后,5个树种的Pro含量呈现不同程度的下降,但各处理的Pro含量仍高于对照。-25℃时,6种木兰科植物Pro含量从高到低依次为乐东拟单性木兰>六瓣含笑>峨眉含笑>阔瓣含笑>杂交含笑>红花深山含笑, 分别比0℃时升高了410.55%、320.47%、186.47%、212.65%、195.20%和7.40%。
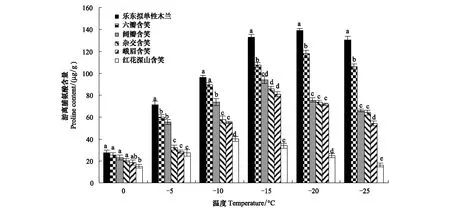
图4 不同低温下6种木兰科植物游离脯氨酸含量的变化Fig.4 Changes in proline content of six varieties of Magnoliaceae under different low temperatures
2.5 对丙二醛含量的影响
对丙二醛(MDA)含量的检测发现各树种叶片的MDA含量总体上呈不断上升的趋势(图5)。各低温处理下,LT50越低的树种其叶片MDA含量越低。6个树种在0℃时差异不显著(P>0.05),红花深山含笑随着处理温度的降低叶片MDA含量不断增加,至-15℃后逐渐趋于平稳。其余5个树种在0—-10℃时叶片MDA含量升高缓慢,-15℃时MDA大量积累,-20℃后逐渐趋于平稳。由此可见,LT50越高的木兰科植物在低温胁迫后其膜脂过氧化水平越高,在低温过程中积累越多的MDA。在整个低温过程中,MDA含量从低到高的树种依次为乐东拟单性木兰<六瓣含笑<阔瓣含笑<杂交含笑<峨眉含笑<红花深山含笑。
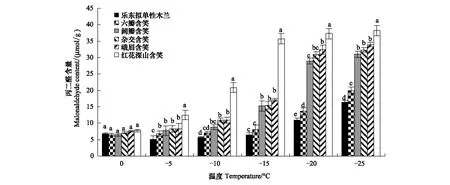
图5 不同低温下6种木兰科植物丙二醛含量的变化Fig.5 Changes in MDA content of six varieties of Magnoliaceae under different low temperatures
2.6 对SOD和POD活性的影响
从图6和图7可以看出,在低温胁迫过程中,6种木兰科植物叶片SOD和POD活性的变化趋势基本相似,即均呈先升高后降低的趋势且各树种叶片SOD和POD活性在临近LT50节点温度时显著下降(P<0.05)。0℃—-5℃下,乐东拟单性木兰和六瓣含笑叶片SOD和POD活性显著低于其他4个树种(P<0.05);至-10℃时,乐东拟单性木兰和六瓣含笑叶片SOD和POD活性显著升高(P<0.05),-20℃时达到峰值,SOD活性分别比0℃时增加了159.83%和81.65%,POD活性分别比0℃时增加了542.93%和127.87%,阔瓣含笑、杂交含笑、峨眉含笑叶片SOD和POD在-10℃仍保持较高活性,深山含笑叶片中SOD和POD活性此时却显著下降(P<0.05);当温度降至-25℃时,乐东拟单性木兰叶片SOD活性较0℃时差异不显著(P>0.05),六瓣含笑、阔瓣含笑、杂交含笑、峨眉含笑和红花深山含笑的SOD活性分别比0℃时下降了31.33%、73.39%、74.98%、83.73%和96.22%;乐东拟单性木兰和六瓣含笑的POD活性仍比0℃时增加了147.08%和16.77%,阔瓣含笑、杂交含笑、峨眉含笑和红花深山含笑的POD活性较0℃时显著降低(P<0.05),分别下降了71.28%、81.89%、86.94%和98.74%。

图6 不同低温下6种木兰科植物超氧化物歧化酶活性的变化Fig.6 Changes in superoxide activities of six varieties of Magnoliaceae under different low temperatures

图7 不同低温下6种木兰科植物过氧化物歧化酶活性的变化Fig.7 Changes in peroxide activities of six varieties of Magnoliaceae under different low temperatures
2.7 6种木兰科植物的抗寒性评价
2.7.1各生理指标与LT50之间的相关性分析及抗寒关键生理指标的筛选
采用相关分析法计算了各生理指标(REC、SP、 SS、Pro、MDA、SOD、POD)与低温半致死温度(LT50)的相关系数(表3)。从表3可以看出,各指标间存在不同程度的相关性,其中LT50与REC和MDA呈极显著正相关(P<0.01),与SP、SS和Pro极显著负相关(P<0.01),而与SOD和POD不相关。因此,REC、SP、 SS、Pro、MDA可作为判断6种木兰科植物抗寒性的关键性指标。REC与SP、Pro显著负相关,与MDA显著正相关;SP与SS、Pro极显著正相关,与MDA极显著负相关,Pro与MDA极显著负相关。

表3 6种木兰科植物各生理指标与LT50之间的相关性
“*”表示显著相关,P<0.05 ;“**”表示极显著相关,P<0.01
2.7.26种木兰科植物的抗寒性评价及聚类分析
根据相关性分析结果,将与抗寒性极显著相关的REC、SP、SS、Pro、MDA作为抗寒性综合评价的指标,运用隶属函数法,计算6种木兰科植物的隶属函数值,按照平均隶属度大小进行排序(表4)。6种木兰科植物的抗寒性强弱依次为:乐东拟单性木兰>六瓣含笑>阔瓣含笑>杂交含笑>峨眉含笑>红花深山含笑。

表4 6种木兰科植物抗寒性综合评价
对6种木兰科植物的抗寒平均隶属函数值进行聚类分析(图8),可将6种木兰科植物的抗寒性分为三类。乐东拟单性木兰和六瓣含笑为第一类,抗寒性强;阔瓣含笑、杂交含笑和峨眉含笑为第二类,抗寒性中等;红花深山含笑为第三类,抗寒性弱,这与采用电导法计算的的LT50结果基本一致。

图8 6种木兰科植物的抗寒性的聚类分析 Fig.8 Cold resistances variable cluster analysis of six varieties of Magnoliaceae
2.8 低温胁迫下HSP90和WRKY33基因的差异表达分析
图9和图10为在连续低温胁迫下耐寒相关基因HSP90、WRKY33在6个树种叶片中的表达均呈先升高后降低的趋势。0℃时,2个基因在6种木兰科植物间的相对表达量差异不显著(P>0.05);-5℃时,6种木兰科植物为了抵御和适应低温胁迫造成的伤害,启动低温应答机制,激活了耐寒相关基因的表达;临近-10℃时,2个基因在耐寒性最差的红花深山含笑叶片中的表达被强烈抑制且后期表达量不可逆,而在其他5个树种中的表达被进一步激活;-15℃时,2个基因在抗寒性中等的阔瓣含笑、杂交含笑、峨眉含笑中亦被强烈抑制,在抗寒性强的乐东拟单性木兰和六瓣含笑中的表达仍被进一步激活;-20℃以后,2个基因在6个树种中的表达均被抑制,表达量降低,各树种所受伤害达不可逆转的状态。各树种在LT50低温之前,2个耐寒基因在叶片中的相对表达量呈上升趋势,当温度临近其LT50时,2个基因的表达被强烈抑制。-5℃—-25℃之间,HSP90、WRKY33基因在乐东拟单性木兰中的相对表达量最高,其次为六瓣含笑,红花深山含笑的相对表达量最低,说明6种木兰科植物可通过HSP90、WRKY33基因的增强表达来适应低温逆境,低温激活了耐寒树种中抗寒基因的表达,抑制了不耐寒树种中抗寒基因的表达,在LT50节点温度之前,HSP90、WRKY33基因的相对表达量越高的树种耐寒性越强。

图9 低温下HSP90基因的在6种木兰科植物中的表达模式Fig.9 The expression ofHSP90 gene in six varieties of Magnoliaceae under low temperature conditions
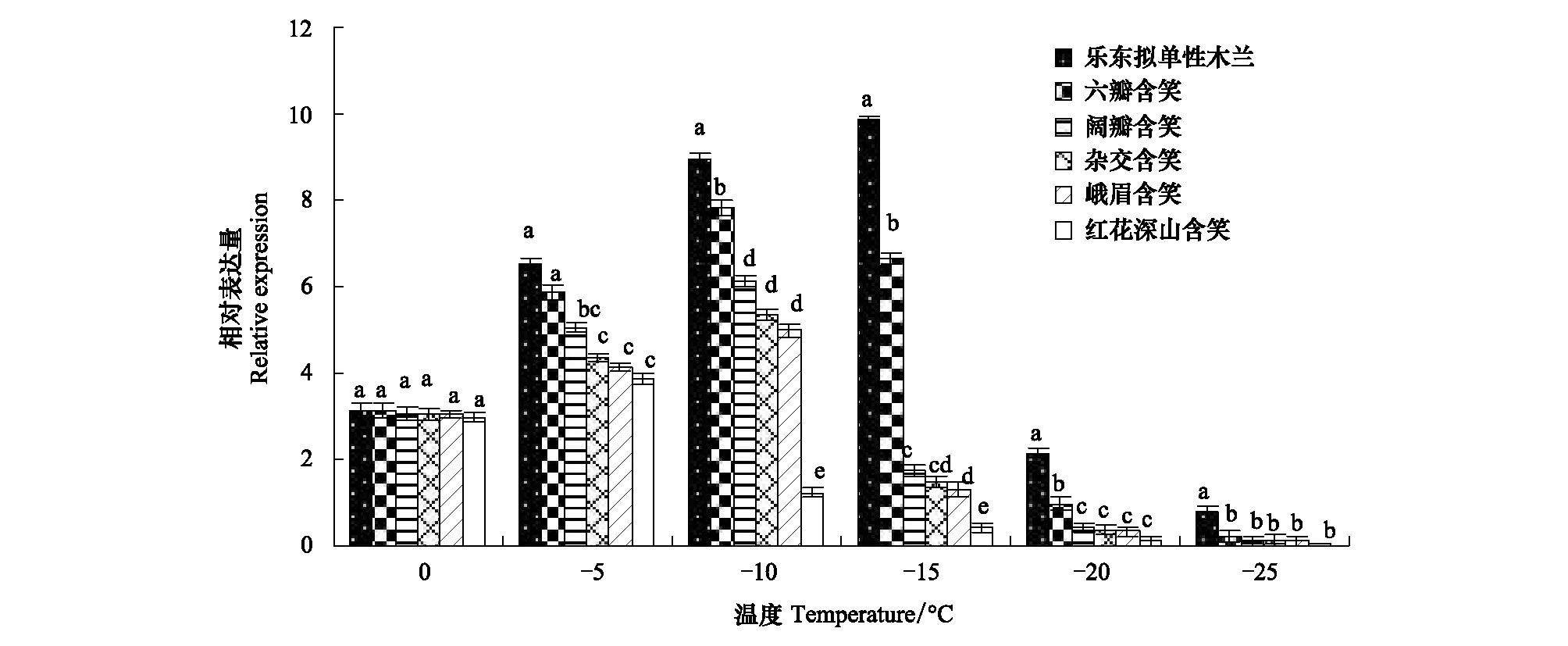
图10 低温下WRKY33基因的在6种木兰科植物中的表达模式Fig.10 The expression ofWRKY33 gene in six varieties of Magnoliaceae under low temperature conditions
3 讨论
3.1 叶片相对电导率及其低温半致死温度与抗寒性
低温胁迫下,植物发生一系列生理生化变化以适应低温逆境[53- 54]。生物膜是植物细胞与外界环境之间发生物质交换的通道,细胞膜系统是植物受低温伤害的原发部位[55]。相对电导率(REC)的变化反映细胞膜透性的改变,植物在逆境条件下细胞膜透性增大,胞内电解质外渗,电导率也随之增大。因此,叶片相对电导率常作为鉴定植物细胞膜破坏程度的重要参考指标[56- 57]。本研究表明, 6种木兰科植物叶片相对电导率随温度的降低基本呈逐渐升高的趋势。可见,低温胁迫使6种木兰科植物叶片生物膜透性增大并且膜受损程度加重。低温半致死温度(LT50)能较直观准确地反映植物的抗寒力和耐低温极限的高低,LT50越低,植物的抗寒性越强[58- 59]。当温度低于LT 50时,植物细胞组织将迅速结冰,生理代谢改变,冻害发生,植物本身所受到的伤害也将不能恢复[60- 61]。因此,认为 LT 50是植物组织所受伤害不可逆转时的转折温度。本研究表明,6种木兰科植物的LT50在-22.06—-10.64℃,从低到高的顺序为:乐东拟单性木兰<六瓣含笑<阔瓣含笑<杂交含笑<峨眉含笑<红花深山含笑。研究植物在低温胁迫下尤其是在LT 50 温度前后生理变化及耐寒相关调控基因的差异表达对于揭示其抗寒生理和分子机理具有重要意义。
3.2 叶片渗透调节物质含量与抗寒性
可溶性蛋白(SP)是植物重要的渗透调节物质,与植物耐寒性密切相关[62]。研究表明,受与冷胁迫且与能量代谢相关的差异表达蛋白基因,如苹果酸脱氢酶、Hsp家族热激蛋白和ATP蛋白酶等的诱导,可溶性蛋白会发生变化,在植物响应低温胁迫信号途径中发挥重要作用,参与到植物响应胁迫中的初生代谢和次生代谢过程中[63]。可溶性蛋白含量的升高,会促进下游物质合成,为植物响应低温胁迫提供必需的物质和能量,同时可以促进细胞外代谢活动的变化,从而恢复生物合成和碳水化合物代谢的平衡,并提高在低温环境中存活率[64]。植物在低温环境下,糖类代谢主要是调节生物合成和蛋白质分解之间的平衡,可溶性蛋白的水解需要大量的相关蛋白水解酶如Clp蛋白酶和ATP蛋白酶使多肽不可逆转地合成可溶性糖[65- 66]。在王晶懋[67]对野生百合卷丹(Liliumlancifolium)的转录组测序中,发现相关的蛋白水解酶,如ATP蛋白酶(ATP-dependent Clp protease proteolytic subunit, Contig24056-All)在4℃胁迫2—16 h时表达量上调了1.28倍,Clp-Hke energy-dependent蛋白酶(Congtig7878-All)上调了1.56倍,并且蔗糖磷酸合成酶和葡萄糖磷酸脱氢酶(Contig7878-AU,Contig3504)分别上调了1.67倍和1.12倍。本研究在生理指标测定中发现,可溶性蛋白含量呈现先升高后降低的单峰变化趋势,抗寒性越强的树种在受到外界冷剌激后的蛋白质增加幅度和降解成糖的速度比抗寒性越弱的树种越快,这说明抗寒性越强的树种在接到冷信号后能增加的细胞液浓度和降低冰点,并快速积累蛋白质将其转换成糖,通过可溶性蛋白引发了一系列的生理生化反应,可溶性蛋白的转移对其他代谢物质合成至关重要,使植物能快速做出冷应激反应,并很好的适应于低温环境,这与前人在杜鹃(Rhododendronsimsii)[68]、结缕草(Zoysiajaponica)[69]、鸢尾(Iristectorum)[70]上的研究结果一致。
植物在低温下可通过增加游离Pro含量降低渗透势来增强自身的抗寒能力[71- 72]。植物受到低温胁迫时, 游离Pro通过对蛋白质的水合作用, 保护植物细胞的空间结构不被伤害, 起到了对植物的保护作用[73]。Xin对拟南芥(Arabidopsisthalianal)的研究表明, 高浓度的脯氨酸是抗冻性提高的重要原因之一[74]。本研究表明,从6种木兰科植物的Pro含量随温度的降低呈现先升高后降低的单峰变化趋势,LT50最低的乐东拟单性木兰和六瓣含笑其Pro峰值在-20℃出现,且整个低温过程中其游离脯氨酸含量显著高于其他4个树种,这与李轶冰[75]对低温处理下不同禾本科牧草的生理变化中的研究结论一致,说明LT50出现得越晚,植物积累的Pro越多,耐寒性越强,随着低温胁迫程度的加剧,酶系统受到损害,叶片Pro合成减弱或降解速率上升,Pro含量下降。
植物在低温环境下,通过积累可溶性糖含量来提高细胞的渗透势,降低细胞液的结冰点,防止过度脱水,保护植物组织免受低温伤害[76]。本研究表明, 随着处理温度的降低, 6种木兰科植物叶片中的SS含量呈逐渐增加并趋于平稳的态势,这与在玉米(Zeamays)、番茄(Lycopersiconesculentum)[77]和甘蔗(Saccharumofficinarum)[78]上的结果一致。LT50最低的乐东拟单性木兰其SS含量均显著高于其他 5个树种,抗寒性最强,其次为六瓣含笑,红花深山含笑SS含量最低,这说明LT50越低的树种在低温下积累的SS越多,抗寒性越强,这与 Yang等[79]在红花玉兰(Magnoliawufengensis)上的研究结果一致。
3.3 叶片丙二醛含量和抗氧化酶活性与抗寒性
低温胁迫会促进胞内活性氧(ROS)的产生,过多的ROS易诱发膜脂过氧化,进而导致膜脂过氧化产物丙二醛(MDA)的大量积累[80- 81]。Campos等[82]认为可利用MDA含量的高低来反映膜脂过氧化的水平,细胞膜质受损的程度以及植物抵御逆境能力的强弱。因此,MDA含量可作为判断植物受低温伤害高低的指标之一[25]。本研究中,6种木兰科植物的叶片MDA含量随低温胁迫的增强总体呈上升趋势,说明随温度的不断降低,植物膜质过氧化程度逐渐加重,LT50越低的树种其叶片MDA含量上升的幅度越小,峰值之后,由于细胞大量死亡,MDA含量增加缓慢,曲线趋于缓和,这与在柑橘(Citrusreticulata)[83]和水稻(Oryzasativa)[84]上的研究结果一致。LT50最低的乐东拟单性木兰叶片在处理间一直保持较低水平MDA,这表明乐东拟单性木兰在低温胁迫下膜脂过氧化程度弱,表现出高效清除ROS的能力和很强的抗寒能力。MDA增幅的大小顺序与6种木兰科植物抗寒性强弱的排列顺序相反,这与陈洁[85],邓仁菊等[86],Wang等[87]和张艳侠等[88]的研究结果一致。SOD和POD作为抗氧化防御系统可以清除氧自由基,对保护植物正常生理功能、增强植物抵御逆境等具有重要作用[89]。本研究中,6种木兰科植物叶片总体呈现先升高再降低的趋势,SOD活性和POD活性的增加可以减轻低温对生物膜的迫害,说明植株对低温产生了一定的响应。但是MDA 含量的增加显示随温度的降低的叶片膜脂过氧化程度仍不断加剧。在0—-5℃下,LT50低的乐东拟单性木兰和六瓣含笑叶片SOD、POD活性却较其他4个树种低,可能因为树种本身具有抵抗低温的能力,并不依赖于激活叶片中保护酶活性来增强对树体的保护,随着温度的进一步降低,乐东拟单性木兰和六瓣含笑叶片中SOD、POD活性被激活来抵御低温的伤害,这也可能影响并导致了在相关性分析中SOD、POD活性与LT50不相关,但这一结论并不与SOD、POD酶具有增强植物抵御逆境能力相矛盾,只是由于树种本身抗寒性的差异。在0—-10℃环境下SOD、POD酶活与6种木兰科植物的抗寒性不相关,不能作为判断其抗寒性的关键指标,这与陈洁[90]在3种含笑属植物和周建等[91]在广玉兰(Magnoliagrandiflora)上的研究结论一致。6种木兰科植物在临近其LT50节点温度时SOD和POD活性均显著下降,说明LT50的重度低温胁迫会抑制其体内的抗氧化酶活性,从而对细胞造成伤害,在树种LT50范围内SOD和POD活性的增强可以抵御低温对细胞造成的氧化伤害。
3.4 抗寒相关调节基因HSP90和WRKY33与抗寒性
低温是影响植物生长发育的关键环境因素之一,植物启动了多种防御性机制适应冷应力[87]。由转录因子介导的信号传导是最为快速有效的防御应答反应之一,构成了植物复杂调控网络的重要组成部分[92- 93]。大量的研究表明,各种热休克蛋白HSPs和WRKY转录因子在温度感知和信号处理中起着核心作用。热激转录因子HSP在逆境胁迫下与热激元件(heat shock element,HSE)识别并特异结合,从而激活下游基因HSP的转录和表达[94],对植物抵抗逆境伤害和其他生命活动具有关键作用[95]。HSP90属于HSPs的家族成员,是类固醇受体和激酶信号通路的组成部分,能够促进目标蛋白积累和激酶激活,整合植物的昼夜节律和质体信号通路,调控CBF和COR表达[96- 97]。WRKY33是WRKY家族的一员,是植物特异性重要的转录因子,参与植物众多生理过程并在植物低温防御应答中发挥重要作用。研究表明,低温下,能够诱导HSP90和WRKY33基因的表达,进而调节拟南芥幼苗的生长[87]。低温胁迫下,通过诱导HSP和WRKY基因过量表达来清除植物体内的活性氧,以抵御氧化胁迫导致的伤害[98]。本研究中,HSP90、WRKY33基因总体呈现先升高后降低的趋势,这种表达模式与SP、Pro、SOD、POD在6个树种中的变化相似,说明HSP90、WRKY33可能参与到目标蛋白的积累和激酶的激活。0℃时,HSP90和WRKY33基因在6个树种间的表达量差异都不显著,到了临近各树种的LT50时,2个基因在各树种叶片中的表达被强烈抑制,后期表达量不可逆且随温度降低逐渐下降,这说明低温胁迫导致细胞质膜的结构和功能受到破坏,细胞内电解质的外渗量增多,相对电导率迅速升高,进而导致相关生理生化活动发生改变,使其对低温胁迫的应答调控机制受到影响,耐寒调控基因的表达受到抑制。低温过程中,耐寒种质乐东拟单性木兰和六瓣含笑中HSP90和WRKY33的表达量始终高于其他树种。这表明6种木兰科植物在耐寒生理响应和相关调控基因的表达水平上,树种抗寒性强度不同对低温的应答机制也存在差异,耐寒性越强的树种为了抵御和适应低温胁迫造成的伤害,越会快速启动低温应答机制,激活HSP90和WRKY33基因的表达,进而启动下游与耐寒相关基因的表达来调整植物体内的生理生化活动,增强ROS清除能力,减轻氧化胁迫造成的伤害,尤其在临近叶片组织受到不可逆转伤害的温度节点,这种由调控基因介导的耐寒调节机制被充分调动,以提高自身的抗寒能力,而后期表达量下降的原因,可能与对低温环境的适应有关,低温已经不再诱导HSP90和WRKY33基因的表达,也可能说明HSP90和WRKY33基因的诱导受胁迫温度的限制,低于一定的低温耐寒基因的表达将逐渐受到抑制,对低温的耐受性也不断降低[99],这种随低温胁迫时间的持续,转录因子先升高后下降的表达模式也在对水稻耐低温[100]和短枝木麻黄(Casuarinaequisetifolia)[52]等的研究上得到了相似结果。
4 结论
平均隶属函数法可以用于木兰科抗寒种质资源的鉴定和抗寒新品种的选育。
6种木兰科植物的LT50在-10.64℃—-22.06℃,从低到高的顺序为:乐东拟单性木兰<六瓣含笑<阔瓣含笑<杂交含笑<峨眉含笑<红花深山含笑。低温过程中,SP、Pro呈先升高后降低的变化趋势,SS、MDA则不断积累。相关分析表明, LT50与REC和MDA呈极显著正相关(P<0.01),与SP、SS和Pro极显著负相关(P<0.01),而与SOD和POD不相关。因此,REC、MDA、SP、SS和Pro可作为6种木兰科植物抗寒性评价的关键性指标,POD、SOD酶活性则不建议作为判断植物抗寒性的主要依据。
6种木兰科植物的抗寒性从强到弱依次为:乐东拟单性木兰>六瓣含笑>阔瓣含笑>杂交含笑>峨眉含笑>红花深山含笑。聚类分析表明,乐东拟单性木兰和六瓣含笑抗寒性强,阔瓣含笑、杂交含笑和峨眉含笑抗寒性中等,红花深山含笑抗寒性弱。
在抗寒相关调控基因的表达水平上,6种木兰科植物对低温的应答机制明显不同。低温激活了抗寒种质中HSP、WRKY基因的增强表达以抵御和适应逆境胁迫,但抑制了在不抗寒种质中的表达,显著降低了不抗寒种质对低温逆境的耐受能力。
本研究在一定程度上对于丰富木兰科植物适应低温的分子和生理机制,以及抗寒无性系的分子选育都具有一定的参考价值。然而要全面深入解析木兰科植物抗寒的分子机制,还需要增加更多抗寒相关候选基因的表达模式研究,并进一步开展功能分析。因此,克隆基因全长、构建抗寒木兰科植物功能基因超表达载体、建立遗传转化体系等将是未来工作重点。

