氧化应激诱导的自噬与隐睾症及畸形精子症的相关性研究
王妍妍,段红艳,刘晓雯,闵子谦,李 丹
(湖南大学生物学院,中国湖南长沙410082)
多种因素会诱发男性生殖系统障碍,使得精子发生异常,最终严重影响男性的生育能力。研究表明,患有隐睾症、畸形精子症、精索静脉曲张、睾丸扭转等疾病的男性,其睾丸组织常伴随高水平的活性氧(reactive oxygen species,ROS),而高浓度的ROS也会影响男性生殖系统的正常运作[1]。以隐睾症为例,男性睾丸中的生殖细胞需要在温度略低于体温的阴囊内才可以正常发育,而隐睾症患者睾丸被滞留在腹股沟管内或腹腔内,使睾丸处于相对高温环境,诱导细胞内ROS水平增加,导致精子发生受阻,以致患者生育力降低甚至失去生育能力[2~4]。再如,在畸形精子症患者的睾丸组织中,高水平的ROS所诱导的氧化应激导致脂质过氧化物等不断积累,抗氧化系统受损,进而导致精子畸形,阻碍精子发生过程[5]。以上研究事实表明,ROS可能对睾丸生殖疾病的发生发展过程起到一定的促进作用。
精子发生是精原干细胞的增殖与分化过程,该过程依赖于生精小管内的支持细胞以及周围的间质细胞的共同协作[6]。其中,睾丸支持细胞是精子发生过程中的一种重要细胞,既可以分泌乳酸为精子细胞提供物质支持,又可以通过细胞间相互连接形成血睾屏障为精子发生提供结构保障。支持细胞的损伤会导致精子发生异常[7~8]。研究表明,ROS不仅影响精子细胞,也影响睾丸微环境中的其他类型细胞,例如支持细胞[9]。
近年来大量研究证明,氧化应激中产生的ROS能诱导自噬发生[10]。自噬普遍存在于真核生物细胞内,一般情况下处于较低水平,主要维持细胞的自我更新;当受到外界环境刺激(如饥饿、营养缺乏、氧胁迫等)时,自噬水平升高,使细胞在应激条件下能循环利用营养物质,利于细胞存活。但是自噬水平过高时,会因过度“吞噬”胞内物而造成细胞死亡[11~13]。研究证实,隐睾症患者睾丸组织表现出生精细胞凋亡增加[14],而细胞自噬作为程序性细胞死亡的另一种类型,与细胞凋亡在功能上存在联系。例如:凋亡途径Fas相关死亡区域蛋白质(Fas-associated protein with death domain,FADD)可以与自噬相关蛋白ATG5(autophagy-related protein 5)相互作用诱导细胞死亡;凋亡调控蛋白FLICE样抑制蛋白质(Fas-associated deathlike IL-1β -convening enzyme inhibitory protein,FLIP)既可与ATG3蛋白结合抑制自噬形成,也可抑制死亡受体5/6(death receptor 5/6,DR5/6)而抑制凋亡[15~16]。这揭示自噬与凋亡有共同的调节因素和信号调控交汇点,同时参与一些生理与病理过程。因此,探讨自噬在隐睾症以及畸形精子症等不育疾病中的作用机制具有重要的意义。
本研究利用高通量的qPCR array技术,筛选了可能参与隐睾性不育的自噬相关基因,并分别以小鼠支持细胞系TM4和精原细胞系GC-1 spg为实验材料,经过氧化氢(H2O2)处理后,通过噻唑蓝(MTT)、实时荧光定量PCR技术检测自噬相关基因的表达变化,最后利用GEO数据库分析自噬相关基因与其他不育症例如畸形精子症的关系。通过综合比较,最终筛选出BCL2L1、EIF2AK3基因可能与男性不育相关。
1 材料与方法
1.1 临床组织样本和细胞系
5例隐睾症患者及5例正常人的睾丸组织的石蜡包埋切片样品来自中南大学湘雅医院病理科。实验经过湖南大学生物学院伦理委员会的认可。
小鼠睾丸支持细胞系TM4(ATCC®CRL-1715)和小鼠精原细胞系GC-1 spg(ATCC®CRL-2053)由本实验室保存。两种细胞系均在含10%胎牛血清(Gibco BRL,美国)的DMEM培养基(Gibco BRL,美国)中进行常规培养。
1.2 主要试剂
噻唑蓝(MTT)(沈阳万类生物科技有限公司);RNAiso Plus总RNA抽提试剂(TaKaRa公司,日本);PrimeScriptTMRT Reagent Kit with gDNA Eraser(TaKaRa公司,日本);Recover AllTMTotal Nucleic Acid Isolation(Invitrogen 公司,美国);TransScript®Fly First-Strand cDNA Synthesis SuperMix(北京全式金生物技术有限公司);AceQ®SYBR®Green Master Mix(南京诺唯赞生物科技有限公司);H2O2(Sigma公司,美国);SYBR®Premix Ex TaqTMⅡ(TaKaRa公司,日本)。
1.3 石蜡包埋组织切片样品总RNA的抽提以及逆转录
将总厚度约80 μm的石蜡组织切片置于1.5 mL离心管中,加入1 mL 100%二甲苯,50℃水浴加热3 min,然后离心弃二甲苯。按照Recover AllTMTotal Nucleic Acid Isolation说明书提取石蜡包埋组织切片样本中的总RNA,利用核酸蛋白质检测仪测定RNA浓度,并注意RNA纯度(1.7<OD260/OD280<2.0 即认为 RNA 纯度良好)。按照TransScript®Fly First-Strand cDNA Synthesis SuperMix说明书进行逆转录反应操作。
1.4 qPCR array筛选
qPCR array是运用高通量荧光定量PCR进行差异表达基因筛选的技术。在本实验中,将逆转录好的cDNA分批次进行96孔qPCR array实验,检测44种自噬相关基因在隐睾症患者睾丸组织和正常睾丸组织中的表达差异。以人源管家基因 β-actin 为内参,sense:5′GCACCACACCTTCTACAATGAG3′;antisense:5′ACAGCCTGGATGGCTACGT3′。使用Primer Premier 5.0设计引物,所有基因引物由生工生物工程(上海)股份有限公司合成,各自噬相关基因引物序列如表1所示。反应体系如下:AceQ®SYBR®Green Master Mix(Low ROX Premixed)5 μL;正向引物(10 μmol/L)0.2 μL;反向引物(10 μmol/L)0.2 μL;模版 cDNA 1 μL;灭菌水3.6 μL。反应程序设置:95℃ 5 min;95℃ 5 s,60℃ 30 s;95℃ 15 s,60℃ 60 s,95℃ 15 s。实验结果利用MxPro QPCR、Minitab 17软件进行分析。
1.5 细胞氧化应激处理及MTT检测
每孔100 μL细胞悬液接种于96孔板中培养过夜;采用不同浓度(0 μmol/L、20 μmol/L、40 μmol/L、60 μmol/L、80 μmol/L、100 μmol/L)的 H2O2处理细胞8 h。小心吸弃上清,每孔加入10 μL MTT溶液(5 mg/mL),避光条件下37℃孵育4 h;吸弃MTT培养液,每孔加入150 μL二甲基亚砜(dimethyl sulfoxide,DMSO),摇床中速振荡 15 min;酶标仪570 nm波长下检测样品OD值,记录OD值并重复实验(单个实验组有5个复孔;单个实验进行生物学重复3次)[17]。根据下面公式计算细胞存活率:存活率(%)=OD实验组/OD对照组×100%。
1.6 细胞内总RNA提取及逆转录
将细胞接种于6孔板,37℃培养过夜,待细胞融合度达到80%~90%,分别用不同浓度H2O2(0 μmol/L、20 μmol/L、40 μmol/L、60 μmol/L、80 μmol/L、100 μmol/L)处理 TM4 细胞和 GC-1 spg细胞8 h。小心吸弃培养液,每孔加入1 mL Trizol试剂裂解细胞,然后吹打数次,最后收集至1.5 mL离心管中。按照RNAiso Plus总RNA抽提试剂说明书进行细胞内RNA的提取;按照PrimeScriptTMRT Reagent Kit with gDNA Eraser说明书进行逆转录操作。
1.7 实时荧光定量PCR检测
采用日本TaKaRa公司的SrBR®Premix Ex TaqTMⅡ进行实验操作:cDNA 1 μL;SYBR®PremixEx TaqTMⅡ12 μL;ROXⅡ 0.5 μL;上下游引物各1 μL,最后加灭菌蒸馏水补足至25 μL。反应程序设置:95℃,30 s;95℃,5 s;58℃,30 s;72℃,30 s,循环数40。以小鼠的管家基因GAPDH为内参,sense:5′AGGTCGGTGTGAACGGATTTG3′;antisense:5′CCGTGAGTGGAGTCATACTGGAA3′。使用Primer Premier 5.0设计引物,11个差异表达的鼠源自噬相关基因引物序列如表2所示,引物由生工生物工程(上海)股份有限公司合成。
1.8 生物信息学分析
进入GEO DataSets(https://www.ncbi.nlm.nih.gov/gds),以“畸形精子症(teratozoospermia)”为关键词,以“expression profiling by array”为条件,检索与男性畸形精子症相关的数据集,得到GDS2697 DateSets;然后在该数据库中检索11个差异表达基因的mRNA表达数据,并通过制图软件GraphPad Prism 6绘制成箱线图。所有数据做3次以上的平行操作。
1.9 统计学分析
所有数据均源自3次生物学重复实验,实验结果以平均值±标准差(±s)表示,利用t-检验进行数据分析。**P<0.01,表示与对照组比较结果具有极显著性差异;*P<0.05,表示与对照组比较结果具有显著性差异,P>0.05表示统计结果没有显著性差异。
2 结果
2.1 qPCR array方法筛选与隐睾性不育症相关的自噬相关基因
采用高通量的qPCR array方法,分别检测44个自噬相关基因在5例正常人睾丸组织和5例隐睾组织标本中的表达水平,热图结果如图1A所示。图1B为筛选出的11个差异表达基因的箱线分布图,其中表达上调的基因共有7个:ATG2A、BAK1、BCL2L1、BID、EIF2AK3、BNIP3、mTOR; 表 达 下 调的基因有 4 个:TRAF6、ATG2B、BAX、Casp3。
2.2 GC-1 spg细胞中H2O2氧化应激对自噬相关基因表达的影响
为了探讨氧化应激对精原细胞活性的影响,采用不同浓度(0 μmol/L、20 μmol/L、40 μmol/L、60 μmol/L、80 μmol/L、100 μmol/L)的 H2O2处理小鼠精原细胞GC-1 spg 8 h。MTT实验结果显示,与0 μmol/L H2O2组相比,细胞存活率随处理浓度的增加而呈现依赖性降低,当H2O2浓度为80 μmol/L、100 μmol/L时,细胞存活率分别降至62%、58%(图2A),表明细胞生长受到抑制。基于此,我们选取 0 μmol/L、20 μmol/L、40 μmol/L、60 μmol/L、80 μmol/L的H2O2开展后续实验。

表1 44个自噬相关基因的引物序列(人源)Table 1 Primer sequences of 44 autophagy-related genes(human)
提取氧化处理后GC-1 spg细胞的RNA,然后逆转录,通过实时荧光定量PCR技术,检测上述11种差异表达基因在H2O2处理后的表达水平。结果如图2B~D所示,不同浓度的H2O2处理GC-1 spg后,表达下调的基因有:ATG2A、BID、BAK1、mTOR、Casp3;表达上调的基因有:EIF2AK3、TRAF6、BNIP3;在低浓度H2O2处理时上调而高浓度H2O2处理时表达下调的基因有:ATG2B、BCL2L1;没有明显变化的基因有:BAX。

表2 11个自噬相关基因的引物序列(鼠源)Table 2 Primer sequences of 11 autophagy-related genes(mouse)

图1 44个自噬相关基因在人正常睾丸组织和隐睾组织标本中的表达水平分析(A)qPCR array检测44个自噬相关基因表达水平的热图分析;(B)11个差异基因在隐睾组织和正常睾丸组织中表达水平的箱线图。S:样本;N:正常睾丸组织,C:隐睾组织;*P<0.05。Fig.1 The expression of 44 autophagy-related genes in testicular tissues of patients with cryptorchidism and healthy fertile men(A)The hot graph analysis of 44 autophagy-related genes detected by qPCR array;(B)Box plot of 11 differentially expressed genes in cryptorchidism and normal testicular tissue.S:Sample.N:Normal testicular tissue;C:Testicular tissue of cryptorchidism.*P<0.05.
2.3 TM4细胞中H2O2氧化应激对自噬相关基因表达的影响
为了进一步探讨氧化应激对睾丸支持细胞活性的影响,本实验采用不同浓度(0 μmol/L、20 μmol/L、40 μmol/L、60 μmol/L、80 μmol/L、100 μmol/L)的H2O2处理小鼠TM4支持细胞8 h。MTT实验结果显示,与0 μmol/L H2O2组比较,细胞存活率随处理浓度的增加而呈现依赖性降低,当H2O2浓度为80 μmol/L、100 μmol/L 时,细胞存活率降至 20%左右(图3A),说明细胞生长受到明显抑制。基于此,选取 0 μmol/L、20 μmol/L、40 μmol/L、60 μmol/L、80 μmol/L的H2O2开展后续实验。
提取氧化处理后TM4细胞的RNA,然后逆转录,随后通过实时荧光定量PCR技术,检测外源性H2O2处理TM4细胞后11个自噬相关基因的表达水平。结果如图3B~D所示,表达下调的基因有:ATG2A、BAK1、BID、BNIP3、BAX;随着处理浓度增加而上调的基因有:EIF2AK3、Casp3、mTOR、BCL2L1、TRAF6、ATG2B。
2.4 GEO数据库检索分析自噬相关基因与畸形精子症发生的相关性
GDS2697是关于男性畸形精子症的数据分析集组,共21个样本,包括正常男性精子细胞样本13个,男性不育的畸形精子细胞样本8个。通过对该数据库中11个差异表达基因的分析发现,在畸形精子细胞中表达下调的基因有:ATG2A、ATG2B、mTOR、Casp3;表达上调的自噬相关基因有:BNIP3、BAX、BCL2L1、BID、EIF2AK3;TRAF6、BAK1无明显变化(图4)。
表3综合显示了11个差异表达基因在隐睾组织、畸形精子细胞以及两种氧化应激细胞系中(此处选取 0 μmol/L、20 μmol/L、40 μmol/L、60 μmol/L H2O2处理后的基因表达水平进行总体比较)的表达情况。通过比较自噬相关基因在隐睾症、畸形精子症和H2O2处理的GC-1 spg细胞系中的表达水平,发现表达下调的基因有Casp3;表达上调的基因有 BNIP3、EIF2AK3、BCL2L1。而在隐睾症、畸形精子症和H2O2处理的TM4细胞系中,表达上调的基因有:EIF2AK3、BCL2L1。综合以上分析可知,EIF2AK3、BCL2L1在两种病理状态下以及氧化应激过程中均表达上调。
3 讨论
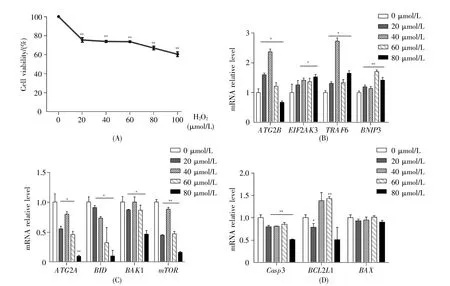
图2 GC-1 spg细胞中氧化应激对11个自噬相关基因表达水平的影响(A)MTT检测细胞存活率;(B~D)实时荧光定量PCR检测11个自噬相关基因的表达水平。*P<0.05;**P<0.01。Fig.2 The effect of oxidative stress on the expression of 11 autophagy-related genes in GC-1 spg cells(A)CellsurvivalratedetectedbyMTT;(B~D)The expression of11 autophagy-related genesdetectedbyqRT-PCR.*P<0.05;**P<0.01.

图3 TM4细胞中氧化应激对11个自噬相关基因表达水平的影响(A)MTT检测细胞存活率;(B~D)实时荧光定量PCR检测11个自噬相关基因的表达水平。*P<0.05;**P<0.01。Fig.3 The effect of oxidative stress on the expression of 11 autophagy-related genes in TM4 cells(A)Cell survival rate detected by MTT;(B~D)The mRNA expression of 11 autophagy-related genes detected by qRT-PCR.*P<0.05;**P<0.01.

图4 11个自噬相关基因与畸形精子症发生的相关性分析Fig.4 The correlation analysis between 11 autophagy-related genes and teratozoospermia
隐睾症是常见的先天性发育畸形性疾病,未降入阴囊的睾丸受激素、温度和基因等因素的影响,出现精子发生受阻和生殖细胞凋亡,是导致男性不育常见的病因[18]。Wei等[19]在氟他胺(flutamide)诱导的大鼠隐睾模型中发现,药物诱导的隐睾动物的生育能力显著下降,精子数量明显减少,精子畸形率增加,睾酮减少,睾丸组织形态严重损伤。在本研究中,我们通过高通量qPCR array方法,检测了44个自噬相关基因在隐睾症患者和生育力正常人睾丸组织中的表达差异,共筛选出差异表达基因11个,其中表达上调的自噬相关基因共 7 个:ATG2A、BAK1、BCL2L1、BID、EIF2AK3、BNIP3、mTOR;表达下调的基因有4个:TRAF6、ATG2B、BAX、Casp3(图 1)。该结果表明,隐睾症患者的生殖细胞在凋亡过程中存在着自噬相关基因的表达异常。

表3 11个自噬相关基因在两种病理和细胞氧化应激状况下的表达趋势Table 3 Expression of 11 autophagy-related genes under two pathological conditions and cellular oxidative stress
研究表明,隐睾症患者体内常常伴随较高的ROS水平,使睾丸处于氧化应激状态,从而引起睾丸生精功能障碍[18~20]。本研究通过外源H2O2诱导小鼠睾丸支持细胞系TM4和精原细胞系GC-1 spg发生氧化应激后,采用实时荧光定量PCR技术从细胞水平检测了11个差异基因的表达水平,其中表达上调的基因有4个:ATG2B、BCL2L1、EIF2AK3、TRAF6;表达下调的基因有3个:ATG2A、BID、BAK1(表3)。结果表明在氧化应激状况下,各自噬相关基因对氧化应激的反应不同。
近年有研究发现,自噬在支持细胞中参与了外质特化结构的组装,支持细胞中自噬相关基因的缺失会引起外质特化结构组装异常,从而使精子头部不能正确塑形,最终导致畸形精子症的发生[21~22]。本研究通过GEO数据库分析了11个差异表达的自噬相关基因与畸形精子症的关系,发现有5个基因在畸形精子症中表达上调,4个下调,该结果表明畸形精子症中存在自噬相关基因的表达异常。通过综合分析,我们发现BCL2L1、EIF2AK3在隐睾症、畸形精子症和氧化应激条件下GC-1 spg和TM4细胞中的表达趋势一致,均表现为上调,提示这两个基因在精子发生与睾丸病理改变过程中扮演重要的角色。
BCL2L1,又被称为BCL-X,是BCL2家族成员,具有抗凋亡作用。在早期的神经发育过程中,BCL-X基因编码的蛋白质作为神经元存活率的调节因子而发挥作用[23]。BCL-X对雄性小鼠生育力具有重要作用,在BCL-X基因敲除的杂合子雄性小鼠中,其生殖细胞受到严重损伤,导致睾丸发育不全,生殖能力下调;而BCL-X敲除后的雌性小鼠的生殖力却无显著变化[24],提示BCL-X在两种性别中调节生殖细胞凋亡的能力是不同的。在本研究结果中,BCL2L1在隐睾症、畸形精子细胞以及两种氧化应激细胞系中均表达上调,提示该基因可能参与调控生殖细胞的凋亡过程。
EIF2AK3,又被称为PERK,编码一种位于内质网膜上的I型跨膜蛋白质,该蛋白质属于elF2α上游激酶家族中的一个成员。EIF2AK3蛋白作为一种激酶,可以通过磷酸化eIF2α来阻止蛋白质合成,也可调节应激反应相关基因表达。研究发现,Nrf2是PERK蛋白的作用底物,在氧化应激条件下,细胞可以通过PERK/Nrf2相互作用通路发挥抗氧化功能[25]。越来越多的研究表明,内质网应激反应过程会刺激自噬发生,该应激反应中的EIF2AK3蛋白激酶信号通路可以促进自噬相关基因表达,激活细胞自噬,进而通过自噬过程降解一些受损的细胞器、蛋白质等,促进细胞存活[26~29]。
综上所述,本研究通过对临床标本以及氧化应激条件下小鼠精原细胞系GC-1 spg和支持细胞系TM4中自噬相关基因的筛选与分析,最终筛选出可能与男性不育相关的基因BCL2L1和EIF2AK3,为进一步探索氧化应激诱导下的自噬与睾丸生殖疾病发生之间的关系提供了一定的研究思路。

