白花兜兰的无菌播种和离体快速繁殖
张 梅,胡 瑾,周 艳,李君一2,冯佑鸿,李依蔓
(1.贵州省植物园,贵阳 550004; 2.贵州省林业科学研究院,贵阳 550005)
兜兰属(Paphiopedilum)隶属于兰科(Orchidaceae)植物,全世界有80~85种,以亚洲的亚热带和热带地区的分布为主,太平洋西南的大洋洲岛岭、南洋群岛、巴布亚新几内亚、东南亚等为分布中心[5,7-8,17]。我国拥有丰富的兜兰属植物资源,有30种以上,主要分布在我国西南部的亚热带地区和热带边缘地区,以广西、云南和贵州分布最多[9-11,28]。大部分种类的兜兰分布范围较狭窄,具有一定的区域特征,如白花兜兰仅产广西和贵州极其狭窄的喀斯特林下[22]。
白花兜兰(Paphiopedilumemersonii)是我国特有种,国家Ⅰ级保护植物,已被列入《野生动植物濒危物种国际贸易公约》(CITES)以及红色名录(IUCN Red List of Threatened Species)[4,6]。随着人口的迅速增长,人类活动和经济活动也不断的加剧,地球绿色植被覆盖面积在不断的减少,整个大生态系统每况愈下,白花兜兰的生长环境在不断的萎缩和消失。而白花兜兰生境主要是喀斯特林下,分布区域狭窄,且喀斯特地貌的气候异常。生境的特殊性和不可逆性,加上掠夺性采挖,导致种群数量迅速减少而濒临灭绝[6]。因此,探寻白花兜兰的快速繁殖方法和人工繁育途径对白花兜兰以及整个兜兰属的保护和开发具有重要的意义。
兜兰同其他大多数兰花一样,种子无胚乳,在自然环境中需要与真菌共生才能萌发,且萌发率极低,其传统繁殖为分株繁殖,繁殖系数低,速度慢,不能满足保护和开发的需求[23]。在前期的研究中,本项目组采用白花兜兰的叶片和茎尖作为外植体,通过常规消毒仍被大量的细菌、真菌和其他病源菌感染,而无污染的外植体启动增长速度慢。为了提高白花兜兰的繁殖能力,本实验拟用其种子和原球茎作为外植体,探索白花兜兰有效的繁殖方式,为白花兜兰的保护、利用和开发提供理论基础和科学依据。
1 材料与方法
1.1 实验材料
实验材料均取自贵州省植物园温室内的兰科植物,为授粉后结果180 d且未开裂的白花兜兰种子和在温室中健康茁壮的原球茎植株。
1.2 实验方法
1.2.1组培室的培养条件
组培室的培养温度控制在(24±1)℃,光照2 000 lx,光照时间12 h/d。培养基中含蔗糖3.0%,琼脂0.8%,pH值控制在5.6~6.0范围内。
1.2.2种子和原球茎的处理
将采收的未开裂蒴果和健康且茁壮生长植株的原球茎用自来水洗净,再用流水冲洗15 min,然后在超净工作台(超净工作台在操作前先开紫外灭菌灯灭菌15 min)上先用75%酒精浸泡30 s,转入0.1%升汞溶液中浸泡20 min,再用无菌蒸馏水清洗5~6遍,取出未开裂的蒴果和原球茎,用无菌滤纸吸干水分,用无菌剪刀和镊子剖开未开裂的蒴果和原球茎,均匀地播撒在培养基表面(注:操作过程要小心,避免被污染和升汞溶液撒落,操作完成后要妥善处理好升汞溶液)。
1.2.3有机物的处理
结合前人的研究结果以及前期的工作情况[1,3,12-15],选用香蕉和椰乳作为有机物进行对比实验,原因是香蕉和椰乳含有丰富的营养和生理活性物质,广泛地应用于植物原生质体培养和离体再生研究[12-16]。
香蕉的处理,称500 g去皮的香蕉,切成0.5 cm3左右的细块,放入500 mL的水中用小火慢煮,待细块变为汁即可;椰乳为市购椰子汁液。
1.2.4培养基的配置
种子萌发的培养基:
1) MS;
2) MS+100 mL/L香蕉汁;
3) MS+100 mL/L椰乳;
4) MS+6-BA 0.5 mg/L+NAA 0.05 mg/L;
5) MS+6-BA 0.5 mg/L+NAA 0.05 mg/L+100 mL/L香蕉汁;
6) MS+6-BA 0.5 mg/L+NAA 0.05 mg/L+100 mL/L椰乳。
原球茎增殖的培养基:
1) 1/2 MS+6-BA 1.0 mg/L+NAA 0.1 mg;
2) 1/2 MS+6-BA 1.0 mg/L+NAA 0.1 mg/L+100 mL/L香蕉汁;
3) 1/2 MS+6-BA 1.0 mg/L+NAA 0.1 mg/L+100 mL/L椰乳;
4) 1/2 MS+6-BA 1.0 mg/L+NAA 0.1 mg/L+100 mL/L香蕉汁+0.2 g/L活性炭;
5) 1/2 MS+6-BA 1.0 mg/L+NAA 0.1 mg/L+100 mL/L椰乳+0.2 g/L活性炭。
生根的培养基:
1) 1/2 MS+NAA 1.0 mg/L;
2) 1/2 MS+IBA 1.0 mg/L;
3) 1/2 MS+NAA 0.5 mg/L+IBA 1.0 mg/L;
4) 1/2 MS+NAA 0.5 mg/L+IBA 1.0 mg/L+1.0 g/L活性炭。
种子和原球茎在光照和黑暗均匀(光照12 h/d,黑暗12 h/d)的条件下培养4周后,用放大镜观察,以种子膨大形成白色原球茎为发芽标准[28],原球茎以生根和萌发幼芽为发芽标准进行萌发率统计。待原球茎转绿出芽后,将原球茎转入育苗培养基中培养。待小苗出现2片叶后,转接到壮苗培养基上培养,在培养期间不断观察和记录,待3~4个月后出瓶栽培。
表1 不同基质对种子萌发率的影响

实验组号培养基种子萌发率(%)培养4周培养6周培养8周1MS0072MS+100mL/L香蕉汁27133MS+100mL/L椰乳510204MS+6-BA0.5mg/L+NAA0.05mg/L02105MS+6-BA0.5mg/L+NAA0.05mg/L+100mL/L香蕉汁817306MS+6-BA0.5mg/L+NAA0.05mg/L+100mL/L椰乳122158
表2 原球茎增值培养

实验组号培养基分化情况增殖情况增殖倍数植株生长11/2MS+6-BA1.0mg/L+NAA0.1mg———21/2MS+6-BA1.0mg/L+NAA0.1mg/L+100mL/L香蕉汁转绿成苗1.3生长慢31/2MS+6-BA1.0mg/L+NAA0.1mg/L+100mL/L椰乳转绿成苗3.5生长健壮,叶浓绿,生长快41/2MS+6-BA1.0mg/L+NAA0.1mg/L+100mL/L香蕉汁+0.2g/L活性炭转绿成苗1.8生长健壮,长势慢51/2MS+6-BA1.0mg/L+NAA0.1mg/L+100mL/L椰乳+0.2g/L活性炭转绿成苗2.0长势一般
表3 不同的激素及浓度对白花兜兰生根的影响

实验组号基质培养时间(d)生根率(%)根的条数(条)11/2MS+NAA1.0mg/L———21/2MS+IBA1.0mg/L———31/2MS+NAA0.5mg/L+IBA1.0mg/L53322~341/2MS+NAA0.5mg/L+IBA1.0mg/L+1.0g/L 活性炭35654~5
1.2.5炼苗、移栽
把需要移栽的试管苗先放在培养室外3 d后打开试管盖,再在培养室外放5 d,然后移栽到配好的土壤基质中,分别测定其对白花兜兰移栽苗成活率的影响。试管生根苗移入栽培基质后,其相对湿度保持在85%以上,可选用雾状喷水的方式,无需设置保温保湿的小环境,培养1周后再喷施营养液。
2 结果与分析
2.1 不同基质对白花兜兰种子萌发的影响
为了探究不同有机物对白花兜兰种子萌发的影响,本试验设计了6组培养基(表1)。由表1可见,第6组培养基(MS+6-BA 0.5 mg/L+NAA 0.05 mg/L+100 mL/L椰乳)种子的发芽率最高,培养8周的发芽率为58%;其次是第5组培养基(MS+6-BA 0.5 mg/L+NAA 0.05 mg/L+100 mL/L香蕉汁)种子的发芽率。发芽率最低的是第1组培养基(MS),培养8周后的发芽率为7%。可见添加适量的生长元素和有机物质有利于促进白花兜兰种子萌发。结果表明,适宜白花兜兰种子无菌萌发最佳的培养配方组合为:MS+6-BA 0.5 mg/L+NAA 0.05 mg/L+100 mL/L椰乳。
2.2 不同培养基对白花兜兰原球茎的增殖培养
为了解不同培养基对白花兜兰原球茎增殖培养的影响,本实验设计了5组培养基来探究白花兜兰原球茎在不同培养基中的增殖发芽率。如表2所示,第3组培养基(1/2 MS+6-BA 1.0 mg/L+NAA 0.1 mg/L+100 mL/L椰乳)原球茎增殖最快,增值倍数为3.5;其次是第5组培养基(1/2 MS+6-BA 1.0 mg/L+NAA 0.1 mg/L+100 mL/L椰乳+0.2 g/L活性炭),增值倍数为2.0。第1组培养基原球茎没有分化,可见添加适量的有机物质能促进白花兜兰原球茎的分化。最佳增殖培养组合为:1/2 MS+6-BA 1.0 mg/L+NAA 0.1 mg/L+100 mL/L椰乳。
2.3 不同培养基对生根培养的影响
为了探究不同培养基对白花兜兰生根培养的影响,本实验设计了4组培养基,每组培养基分别培养100株无根苗。如表3所示,第1组和第2组培养基在60 d内均无生根,第3组培养基白花兜兰培养53 d时开始生根,生根率为32%,生根条数平均为2~3条。第4组培养基培养的白花兜兰在35 d时开始生根,生根率为65%,平均生根数为4~5条。表明白花兜兰最佳生根培养组合为1/2 MS+NAA 0.5 mg/L+IBA 1.0 mg/L+1.0 g/L活性炭。
2.4 炼苗时间与移栽基质对白花兜兰移栽苗成活率的影响
移栽前将生根瓶苗放入实验室中揭开封口膜炼苗。炼苗处理如表4,分别炼苗5、7 d和14 d,以不炼苗直接移栽为对照。结果表明,炼苗时间对缓苗期和移栽成活率有一定的影响。不炼苗处理的移栽成活率最低,移栽成活率为4%。以炼苗7 d的移栽成活率最高,为72%。
把炼好的健壮苗从培养基取出,洗净培养基,用0.1%多菌灵溶液浸泡根部4 min,清水洗去药液,自然风干2~4 h后栽入已灭菌的栽培基质中。栽培基质主要分为3组,1) 树皮∶火山石∶腐殖土(1∶1∶1)、 2) 树皮、 3) 树皮∶蛭石(2∶1),1个月后计数成活率(表5),培养基质为 1) 的小苗长势最好,成活率也最高,达76%;而栽培基质为 3) 的小苗长势最弱,成活率为41%。
实验结果(表4、表5)显示,炼苗的最佳时间为7 d。树皮∶火山石∶腐殖土(1∶1∶1)的栽培基质最适合白花兜兰的生长。
表4 移栽苗的成活率

炼苗天数(d)成活率(%)生长状况04根基本腐烂,缓苗时间长,长势弱56根部分腐烂,植株黄,长势弱772根不腐烂,根抓土性强,苗健壮,色绿,长势好1464根不腐烂,抓土性一般,苗健壮,色绿
表5 移栽基质对移栽苗成活率的影响
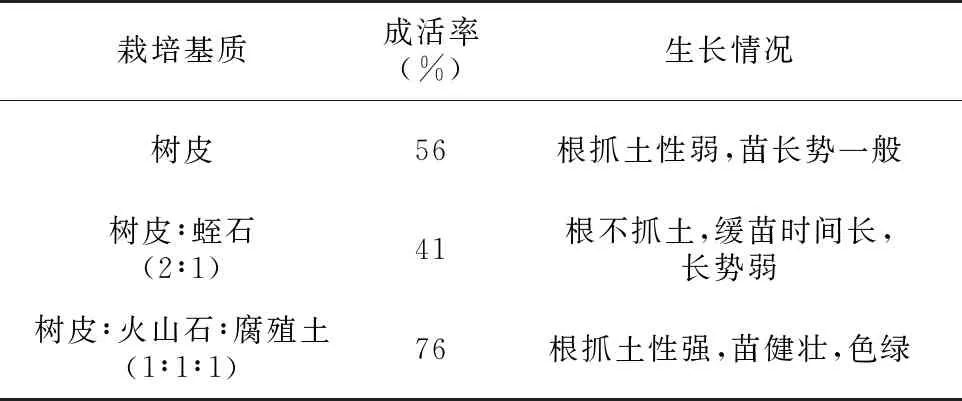
栽培基质成活率(%)生长情况树皮56根抓土性弱,苗长势一般树皮∶蛭石(2∶1)41根不抓土,缓苗时间长,长势弱树皮∶火山石∶腐殖土(1∶1∶1)76根抓土性强,苗健壮,色绿
3 结论与讨论
3.1 结 论
本实验结果表明,诱导白花兜兰种子萌发的最佳培养组合为MS+6-BA 0.5 mg/L+NAA 0.05 mg/L+100 mL/L椰乳;原球茎的诱导和增殖最佳的培养基配比为1/2 MS+6-BA 1.0 mg/L+NAA 0.1 mg/L+100 mL/L;有机添加物椰乳对白花兜兰种子的萌发和原球茎的诱导与分化有较好的促进作用。1/2 MS+NAA 0.5 mg/L+IBA 1.0 mg/L+1.0 g/L 活性炭对白花兜兰的根诱导效果最为理想;炼苗最佳时间为7 d,栽培基质为树皮∶火山石∶腐殖土(1∶1∶1)的移栽成活率达76%。
3.2 讨 论
兜兰是兰科植物中极具开发价值的重点保护类群之一[12-16],也是萌发较困难的种类之一[12]。本实验以成熟未开裂的种子和健康茁壮成长的原球茎为外植体,以MS和1/2 MS为基础培养基,添加不同激素配比[26]、不同的有机物、不同配比的活性炭等变量因素,研究其对白花兜兰的种子萌发,原球茎芽的增殖、分化和生根诱导的影响,从中筛选出各个培养阶段的最佳培养基配方。在成苗后对其进行炼苗,选出最佳的移栽基质[27],使白花兜兰能在无菌状态下播种和离体快速繁殖。
3.2.1影响白花兜兰种子无菌萌发的因素
培养基中盐分的组成和浓度是影响兜兰种子萌发的重要因素[24-25],且培养基中添加适当的有机物(如椰乳、香蕉和马铃薯)和活性炭均有利于兰科植物种子的萌发和生长[15]。实验显示,加入适量(10%)的椰乳对兜兰的种子萌发有促进作用,结果与前人的实验结果相符[15-16]。白花兜兰种子发芽后在MS的培养基内生长较好,与其他本属物种有很大的差异[12-16]。总之,影响种子发芽率的主要因素是激素的配比和有机物质的种类,除此之外,种子发芽率还与种子本身的基质有关,因此在选取实验种子时,要注意种子的成熟度以及状态、无菌操作等因素。
3.2.2有机物与白花兜兰原球茎分化增殖
通过对比白花兜兰原球茎在不同的培养基下分化和增殖的情况(表2),发现原球茎在添加椰乳的培养基上转绿成苗较快,且生长健壮,叶浓绿,生长快;培养基中适当添加有机物椰乳可提高原球茎的分化与增殖能力,与王莲辉等[14]的研究结果一致;主要原因在于有机物中含有丰富的营养和生理活性物质[16],而椰乳中含的营养物质和生理活性物质的配比与白花兜兰原球茎分化增殖所需的配比一致,因此加快了其生长速度,能够达到短期快速增殖的效果。
3.2.3活性炭与白花兜兰的生根
活性炭是组织培养工作中常用的物质之一,它具有大量的小孔,所以具有巨大的表面积,吸附能力强[19]。活性炭在组培培养中对苗的促进作用最早是1974年Anagnostakis在对烟草的研究中发现[18]。后来活性炭的其他作用陆续被报道,如能促进试管苗出芽,提高苗质量;能提高花粉愈伤组织的诱导率,促进愈伤组织的生长和胚状体的形成,显著提高成苗率[20-21];能吸附培养基中有害物质,还能模拟黑暗环境,促进试管苗的生根[20-21]等。本研究结果表明,活性炭对白花兜兰的生根具有良好的促进作用,在培养基中加入活性炭,苗生长快,且挺拔健壮,与刘燕等[19]的研究结论一致。

