PCPs污染物胁迫对禾花鲤不同组织抗氧化系统的影响
宋晓红,刘顺亮a,2,陈俊华a,李艳红,陈 璐a,黄亮亮,曾鸿鹄
(1.桂林理工大学 a.环境科学与工程学院; b.广西环境污染控制理论与技术重点实验室;c.岩溶地区水污染控制与用水安全保障协同创新中心, 广西 桂林 541006;2.东华理工大学 水资源与环境学院,南昌 330013)
0 引 言
个人护理用品PCPs(personal care products)是潜在的环境污染物,其种类繁多、结构复杂,由于大量生产和使用而不断地输入环境中,在水环境甚至水生生物体中频繁检出[1-2],具有潜在的生态毒性效应、生物累积效应、内分泌干扰效应和遗传毒性效应[3-5]。由于大多数PCPs极性强、易溶于水、挥发性较弱[6],所以水环境是PCPs的主要汇源地。鱼类作为水环境中食物链的重要环节,其生存与水环境息息相关,对污染物较为敏感,能有效地监测和指示水中化学物质的生物毒性。现有报道表明,PCPs会影响鱼类的正常代谢、行为、生长、繁殖和发育[7-9],但其生态毒理学效应与免疫机制方面还存在着较多未知。
当鱼体暴露到环境污染物中时,机体会产生大量活性氧自由基,活性氧自由基若不及时被清除,会引起脂质过氧化、DNA断裂、酶失活等损伤[10],导致过氧化胁迫反应和细胞氧化损伤,机体会启动抗氧化防御体系。鱼体的抗氧化体系包括多种活性氧清除物质,分为抗氧化酶类(如超氧化物歧化酶SOD、 过氧化氢酶CAT、 谷胱甘肽转移酶GST等抗氧化酶)和非酶类的抗氧化剂(如谷胱甘肽GSH等),通过检测相应的活性氧清除物质生化指标变化便可知道外源污染物对机体的毒副作用,所以活性氧清除物质是重要的分子生态毒理指标[11]。
禾花鲤(Procyprismera)属鲤科小型经济鱼类,是中国土著鱼类,在南方池塘、河道等水域均有分布和养殖。该鱼生长快、繁殖力强,是理想的水环境监测和毒理性试验的实验动物。目前,国内学者只开展了部分重金属离子对禾花鲤的胁迫作用与毒性研究[12-13],而关于PCPs污染物对禾花鲤的氧化胁迫效应还未见报道。且大部分PCPs类物质生物毒性实验只探讨了单一化学物质或几种混合化学物质对鱼类的毒性作用, 而研究混合物的联合毒性效应更具有现实意义,能更真实地反映污染物在环境中的综合毒性特征。洗发水和沐浴露作为高产量的生活用品,是PCPs的典型代表之一,含有表面活性剂、芳香剂、增稠剂、防腐剂等复杂成分,在日常生活中广泛使用并随着生活污水等进入环境,其潜在的生态效应有待研究。本研究以禾花鲤为研究对象,以大众品牌的沐浴露与洗发水1∶1混合液作为PCPs污染物代表,比较鱼体不同组织对PCPs污染物的氧化应激反应,并筛选特异敏感的生物标志物指示PCPs对禾花鲤的毒性水平,为水环境中PCPs的生物监测和生态环境效应评估提供参考。
1 材料与方法
1.1 实验材料
实验用禾花鲤购自广西农业科学院桂北分院渔场,实验用鱼体长(16.33±0.30) cm, 质量(105.22±0.05) g。实验前暂养7 d(死亡率不超过5%), 自然光照,水温23.4±0.2 ℃, 溶解氧6.0 mg/L以上, 每日定时定量投食1次(中海牌鲤鱼配合饲料),实验前停食1 d。选择健康、活力强、个体大小均匀的实验鱼开展实验。
1.2 实验方法
1.2.1 PCPs污染物24 h急性暴露实验 为贴近实际使用和环境污染情况,采用大众常用的SFJ沐浴露与PR洗发水1∶1混合配制,作为PCPs污染物试验液。采用水生动物体外试验方法开展预试验,确定PCPs污染物质量浓度范围,禾花鲤在PCPs污染物试验液胁迫下96 h全活质量浓度上限为32 mg/L。根据预实验结果,设置高(16 mg/L)、 中(8 mg/L)、 低(4 mg/L)3个浓度组及空白对照(充分曝气的过滤自来水),每个实验浓度组溶液均采用充分曝气的过滤自来水配制,于容积100 L的聚乙烯塑料水箱中开展24 h急性暴露实验,每个实验浓度组随机分配5尾禾花鲤,水温、溶解氧等实验条件与暂养时一致。
PCPs污染物暴露24 h后, 在各质量浓度组中分别随机取4尾鱼, 置于冰盘快速解剖, 取每尾鱼的肝胰脏、 肌肉、 鳃、 脾脏、 脑、 肾脏、 心脏等组织, 用置冷的生理盐水漂洗, 除去血液,滤纸拭干, 立刻置于-80 ℃超低温冰箱保存, 用于酶活测定。
1.2.2 酶液制备及酶活性的测定 准确称取待测组织, 按照样品质量∶生理盐水体积=1∶9加入预冷生理盐水, 冰浴匀浆, 用高速冷冻离心机于4 ℃、 2 500 r/min离心10 min, 取上清液用于酶活的测定。 超氧化物歧化酶(SOD)、 过氧化氢酶(CAT)、 总抗氧化能力(T-AOC)、 谷胱甘肽-S转移酶(GST)、 谷胱甘肽(GSH)、 丙二醛(MDA)和总蛋白含量的测定均采用试剂盒法(购自南京建成生物技术有限公司)。每个组织样品酶活的测定重复2次。
1.3 数据处理
实验数据采用平均值±标准差(mean±SD)(n=4)表示,运用SPSS Statistics 17.0 统计软件进行单因素方差分析(One-Way ANOVA),并用Duncan氏检验法进行多重比较,差异显著水平为P<0.05,极显著水平为P<0.01。
2 结果与讨论
禾花鲤暴露于不同浓度PCPs污染物24 h后,肝胰脏、鳃、脾脏、肾脏等组织T-AOC、SOD、CAT、MDA、GST、GSH的活性发生了不同程度的变化。
2.1 T-AOC的组织分布
禾花鲤在PCPs污染物胁迫24 h后, 各器官组织T-AOC活性变化如图1所示。 禾花鲤不同组织器官T-AOC活性不同, 脑组织中含量最高, 其次是鳃、 肾脏、 脾脏, 肝胰脏、 心脏和肌肉的T-AOC活性相对较低,具有组织分布特异性。质量浓度4 mg/L组中禾花鲤心脏T-AOC活性略微降低, 浓度增加到8 mg/L时呈现诱导现象, T-AOC活性极显著增加(P<0.01), 而当浓度继续增大时, 心脏的T-AOC活性又显著被抑制(P<0.05)。随浓度的增加,脑组织、肾脏、鳃组织和肌肉中T-AOC活性均呈现出不同程度的下降趋势,与空白组对比,抑制率介于9.84%~89.02%,说明PCPs污染物对T-AOC产生了抑制作用,可破坏组织的氧化还原状态,引起细胞功能的紊乱。谭树华等[14]、张春玲等[15]均报道了T-AOC与染毒剂量的负相关关系,与本文结果一致。
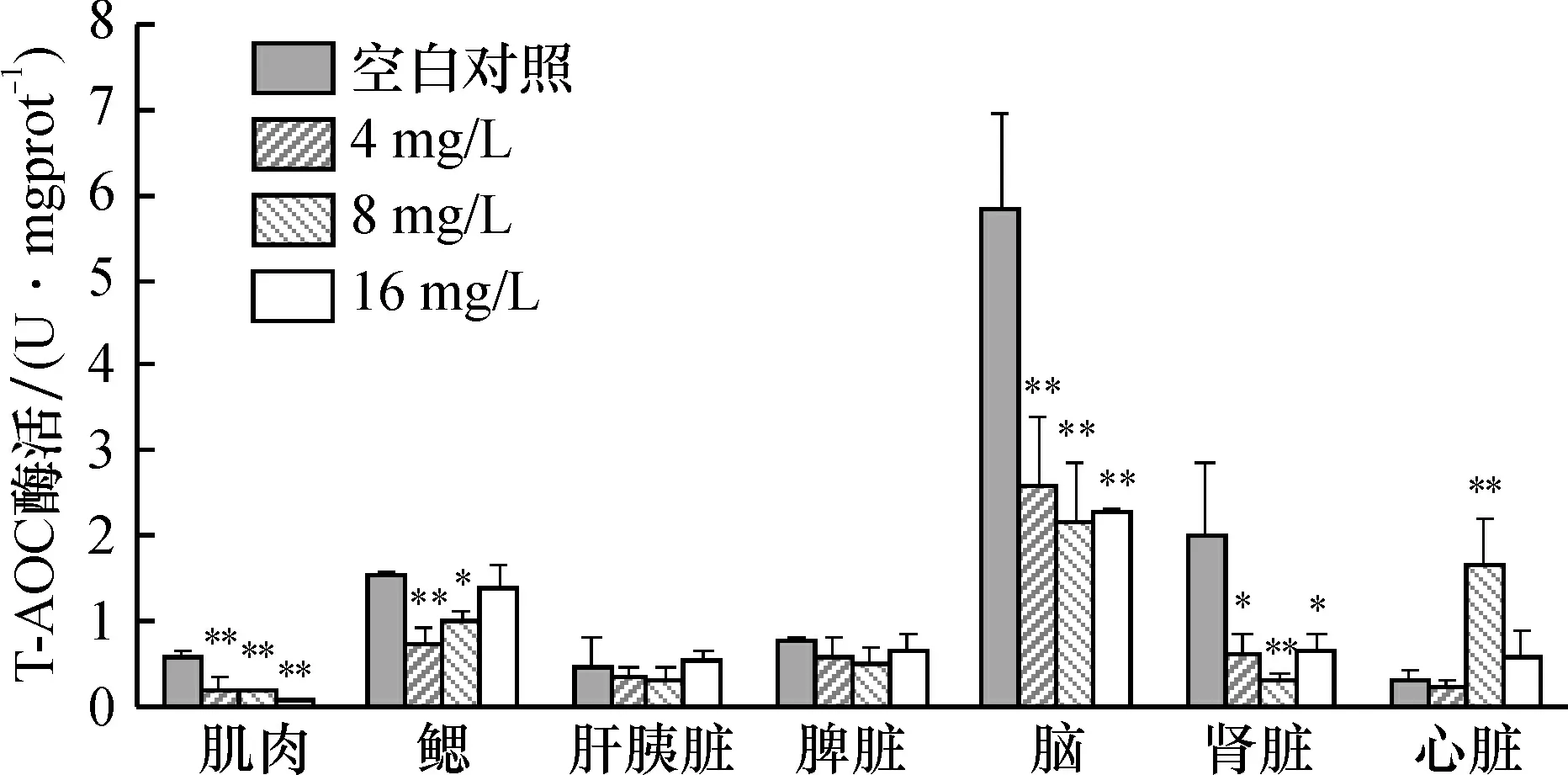
图1 PCPs胁迫24 h后禾花鲤不同组织的T-AOC活性Fig.1 T-AOC activity in different tissues of Procypris meraafter 24 h exposure to PCPs*P<0.05表示与空白对照组比较有显著性差异,**P<0.01表示与空白对照组比较有极显著差异(下同)
T-AOC包括抗氧化酶系统和非酶促系统,机体防御体系的T-AOC代表了体系内的各种抗氧化分子和酶的总水平,其强弱与健康程度存在密切联系。当禾花鲤接触到高剂量PCPs时,机体会产生大量活性氧,攻击鱼体和抗氧化酶,而其诱导产生的抗氧化酶活性增加不足以抵消抗氧化酶的严重损伤,导致酶活性降低[16],T-AOC活性的降低说明活性氧的产生已经超出抗氧化防御系统的能力,可能会对机体造成损伤。通过检测脑组织和肾脏中T-AOC活性的变化可有效指示PCPs污染物对鱼体的生理毒性。
2.2 SOD的组织分布

图2 PCPs胁迫24 h后禾花鲤不同组织的SOD活性Fig.2 SOD activity in different tissues of Procypris meraafter 24 h exposure to PCPs
2.3 CAT的组织分布
不同浓度PCPs污染物暴露后不同组织CAT活性的变化如图3所示。 在胁迫反应期间, 心脏和肌肉组织的CAT活性较低, 其余各器官组织中CAT活性介于2.46~31.74 U/mgprot, 不同器官组织CAT活性不同, 主要分布于肝胰脏, 存在集中表达的现象。CAT可催化H2O2分解为H2O与O2,降低H2O2反应生成有害的·OH的概率,在降低活性氧自由基对机体细胞的氧化损伤方面起着重要作用[18]。比较不同浓度污染物对肝胰脏、肾脏和鳃中CAT活性的影响发现,各浓度组CAT活性与空白对照组无显著性差异(P>0.05)。CAT只能在高H2O2情况下才发挥作用[19],说明鱼体没有产生大量H2O2,这也与SOD的活性变化相吻合。尽管CAT反应变化不强烈,但CAT活性依然受到了不同程度的诱导或抑制。在8 mg/L PCPs作用下,各组织CAT活性相比空白对照组均有所下降,说明该浓度PCPs暴露对CAT活性影响较大。在肝胰脏和脾脏中,低水平的PCPs消耗了机体中的CAT酶,CAT活性有所下降,而在高浓度组,机体本身的清除能力不足,需诱导CAT酶的表达和合成,所以16 mg/L浓度组CAT活性又有所增加。

图3 PCPs胁迫24 h后禾花鲤不同组织的CAT活性Fig.3 CAT activity in different tissues of Procypris mera after 24 h exposure to PCPs
2.4 MDA的组织分布
MDA是膜脂过氧化的终产物,可根据其含量高低评判细胞膜脂过氧化的程度,间接反映细胞损伤大小。PCPs胁迫24 h后,随污染物浓度增加,鰓组织和肝胰脏中的MDA含量呈下降趋势,但肝胰脏中差异不显著(P>0.05)(图4)。心脏和脑组织中MDA含量较低,肌肉和脾脏组织中呈现先下降后恢复的现象,而肾脏中MDA含量则先上升再下降,说明PCPs对不同组织细胞膜的破坏程度不同。8 mg/L PCPs作用下肾脏中MDA含量显著增加,说明该组织内有较多脂质过氧化产物丙二醛积累。鳃是鱼体重要的免疫器官,与PCPs直接接触,对鳃的影响更大, MDA含量随着剂量增加而下降, 可能是因为高质量浓度的PCPs对动物机体产生了大量活性氧, 过多的活性氧破坏了细胞内多种酶系统和功能膜, 导致MDA含量受到抑制而下降[20]。 禾花鲤鳃组织中MDA活性的变化可以反映出PCPs对鱼体鳃组织的损伤作用, 可将其作为PCPs污染的有效指标。
2.5 GST的组织分布
不同浓度的PCPs胁迫对禾花鲤各组织GST活性的影响如图5所示。GST广泛分布于各个组织。当PCPs浓度为8 mg/L时,禾花鲤鳃、肝胰脏、肾脏和脾脏4个免疫器官的GST活性显著升高,达到峰值,说明此时各组织受到的氧化损伤加剧,鱼体通过自身的抗氧化防御体系大量诱导GST表达以增强自身清除自由基的解毒能力,缓解细胞自身所受到的氧化损伤。PCPs浓度为16 mg/L时,GST活性下降。随着暴露浓度的增大,机体的抗氧化能力不足以应对更为严重的氧化胁迫,所以GST活性降低,机体受到了氧化损伤。这种低浓度诱导、高浓度抑制的现象与多篇报道一致,是典型的抛物线型剂量效应关系,即“毒物兴奋效应”[19,21-22]。谷胱甘肽转移酶(GST)能催化谷胱甘肽(GSH)与某些外源性或体内有害化学物质的亲电子基团相结合,最终形成硫醚氨酸排出体外,在消除生物体内过氧化物和解毒功能方面具有重要作用。GST活力的大小可以反映生物机体的抗氧化能力,可将GST活性的变化作为检测环境中PCPs污染的生化指标。

图5 PCPs胁迫24 h后禾花鲤不同组织的GST活性Fig.5 GST activity in different tissues of Procypris mera after 24 h exposure to PCPs
2.6 GSH的组织分布
不同浓度的PCPs胁迫24 h后,禾花鲤各组织GSH活性的变化如图6所示。禾花鲤不同器官组织GSH活性不同,存在组织特异性,主要分布于鳃组织和肝胰脏,且表达量较高,峰值达到114.46 mg/gprot,是其他组织含量的1.3~52.2倍。由此可知,鳃组织和肝胰脏是GSH的主要反应器官。

图6 PCPs胁迫24 h后禾花鲤不同组织的GSH活性Fig.6 GSH activity in different tissues of Procypris mera after 24 h exposure to PCPs
禾花鲤鳃组织和肝胰脏中GSH活性也呈现了“毒物兴奋效应”,当PCPs质量浓度为4 mg/L时,鳃组织的GSH活性急剧升高(P<0.01),肝胰脏GSH活性也有所增加,说明PCPs对鳃组织和肝胰脏中的GSH活性具有诱导作用;当PCPs质量浓度为8 mg/L时,其对鳃组织和肝胰脏中的GSH活性的抑制作用显著。当PCPs质量浓度为16 mg/L时,鳃组织和肝胰脏中GSH活性有所回升,但鳃组织中GSH活性依然显著小于空白对照组(P<0.05),抑制效应依然存在。机体受到低浓度胁迫时,活性升高,但受到重度胁迫时,活性降低,与亚硝态氮对草鱼肝细胞中GSH的影响变化一致[23]。
3 结 论
当生物体内活性氧与抗氧化防御系统之间不平衡时,会产生氧化应激反应。T-AOC、SOD、CAT、MDA、GST、GSH是机体内抗氧化防御系统的重要物质,在清除自由基中发挥重要的作用。本文研究了不同浓度PCPs污染物24 h胁迫对禾花鲤不同组织抗氧化系统的影响,结论如下:
(1)鱼类不同器官组织抗氧化活性不同,与器官组织的生理功能和代谢水平有关,T-AOC、CAT和GSH活性具有组织分布特异性。
(2)不同浓度PCPs污染物24 h胁迫后,鱼体抗氧化系统呈现不同程度的诱导或抑制现象,其中鳃组织和肝胰脏中GSH和GST均呈现了“毒物兴奋效应”,机体受到低浓度胁迫时活性升高,受到重度胁迫时活性降低。
(3)禾花鲤鳃组织中GST、GSH、MDA,肝胰脏中的GST,肾脏中T-AOC、GST和脑组织的T-AOC,对不同浓度PCPs污染物的反应比较灵敏,可作为生物标志物有效指示PCPs污染物胁迫对鱼体的生理毒性。

