急性淋巴细胞白血病患儿血清miR-17、miR-29c的表达及临床意义
赵丽颖 李慧霞 张红梅
急性白血病(acute leukemia,AL)是造血系统的恶性克隆性疾病,可分为急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)和急性髓细胞白血病(acute myelocytic leukemia,AML),ALL常见于儿童,是儿童最常见的恶性肿瘤[1]。ALL病因复杂尚未完全清楚,近年来随着联合化疗技术和造血干细胞移植技术发展应用,儿童ALL诱导缓解率大大提高,存活率显著改善,但仍有20%左右缓解患儿发生中枢神经系统、骨髓等复发,威胁患儿生命健康[2]。因此,进一步探究ALL的发病机制,发掘新的预后标志物和治疗靶点非常关键。miRNA作为一类小的非编码RNA调控转录后基因表达,在白血病发生、发展及预后中发挥重要作用[3]。研究表明,miRNAs在造血干细胞自我更新、衰老及向恶性肝细胞转变等过程中参与调控细胞信号转导途径及表观遗传机制,是白血病干细胞的重要调控因子[4]。本研究通过检测ALL患儿血清中miR-17、miR-29c表达水平,分析miR-17、miR-29c表达与患儿临床指标及预后的关系,旨在探讨miR-17、miR-29c在ALL进展中的临床意义。
资料与方法
1.一般资料:选择2010年9月~2013年2月在笔者医院初诊为ALL并住院治疗的43例患儿作为研究对象,其中男性26例,女性17例,患儿年龄1~14岁,平均年龄5.69±1.24岁。纳入标准:①经临床病理特征、细胞学、形态学、免疫学等检查符合《WHO造血与淋巴组织肿瘤分类(2016)》中急性白血病分类及诊断标准[5];②均为初诊,患儿家属知情并签署同意书;③临床资料完整便于预后判断;④经医院伦理学委员会批准。排除标准:①确诊前未进行相关治疗;②合并其他组织恶性肿瘤;③合并严重慢性消耗性疾病;④依从性差及不方便随访;⑤合并全身其他疾病患者。另选同时期体检健康儿童40例作为对照组,其中男性22例,女性18例,年龄1~15岁,平均年龄6.14±1.37岁。两组儿童性别、年龄等一般资料比较,差异无统计学意义(P>0.05)。
2.治疗方法:患儿全身化疗采用CCLG-2008方案,化疗分为诱导缓解、早期强化、巩固治疗、延迟强化、维持治疗5个阶段。疗效标准:①诱导缓解:诱导化疗35天,患儿贫血、出血等临床症状消失,白细胞(white blood cell,WBC)计数和血小板计数恢复正常,红细胞系及巨核细胞系正常,骨髓中早幼粒细胞及原粒细胞之和≤5%;②复发:诱导缓解后,骨髓中早幼粒细胞+原粒细胞>20%,或骨髓外、脑脊液中发现白血病细胞浸润。每例患儿随访0~5年。
3.观察指标:所有ALL患儿在入院当日抽取肘静脉血4ml,对照组儿童体检当日抽取肘静脉血4ml。采用试剂盒法提取血清总RNA,经反转录后,以U6为内参,RT-PCR检测两组儿童血清中miR-17、miR-29c相对表达量。实验用RNA提取试剂盒、反转录试剂盒及RT-PCR试剂盒均购于天根生化科技(北京)有限公司,操作方法严格按照说明书进行。
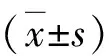
结 果
1.两组血清miR-17、miR-29c表达水平:病例组儿童血清中miR-17相对表达量高于对照组,miR-29c相对表达量低于对照组,两组儿童血清中miR-17、miR-29c相对表达量比较,差异有统计学意义(P<0.05),详见表1和图1。
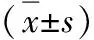
表1 两组儿童血清miR-17、miR-29c表达水平
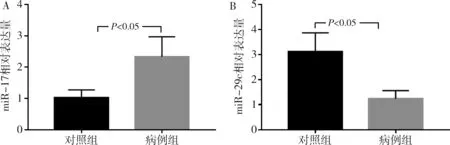
图1 两组儿童血清miR-17、miR-29c相对表达量A.miR-17;B.miR-29
2.miR-17、miR-29c与ALL患儿临床指标的关系:初诊WBC计数≥50×109/L患儿血清中miR-17表达水平显著高于初诊WBC计数<50×109/L患儿(P<0.05),miR-29c表达水平显著低于初诊WBC计数<50×109/L患儿(P<0.05);B-ALL患儿血清中miR-17表达水平显著低于T-ALL患儿(P<0.05),miR-29c表达水平显著高于T-ALL患儿(P<0.05);泼尼松诱导敏感患儿血清miR-29c表达水平显著高于不敏感患儿(P<0.05);患儿血清miR-17表达水平与性别、年龄、染色体异常及泼尼松诱导敏感度无关(P>0.05),miR-29c表达水平与性别、年龄、染色体异常无关(P>0.05),详见表2。
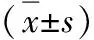
表2 miR-17、miR-29c与ALL患儿临床指标的关系
3.不同预后患儿血清miR-17、miR-29c表达水平:ALL患儿治疗过程中死亡4例,治疗后,诱导缓解39例,诱导缓解率90.70%,其中复发17例,复发率43.58%。诱导缓解后死亡8例,生存31例,5年总生存率72.09%,其中无事件生存22例,无事件生存率51.16%。生存组患儿血清miR-17相对表达量显著低于死亡组患儿(P<0.05),miR-29c相对表达量显著高于死亡组患儿(P<0.05),详见表3和图2。
表3 不同预后患儿血清miR-17、miR-29c表达水平
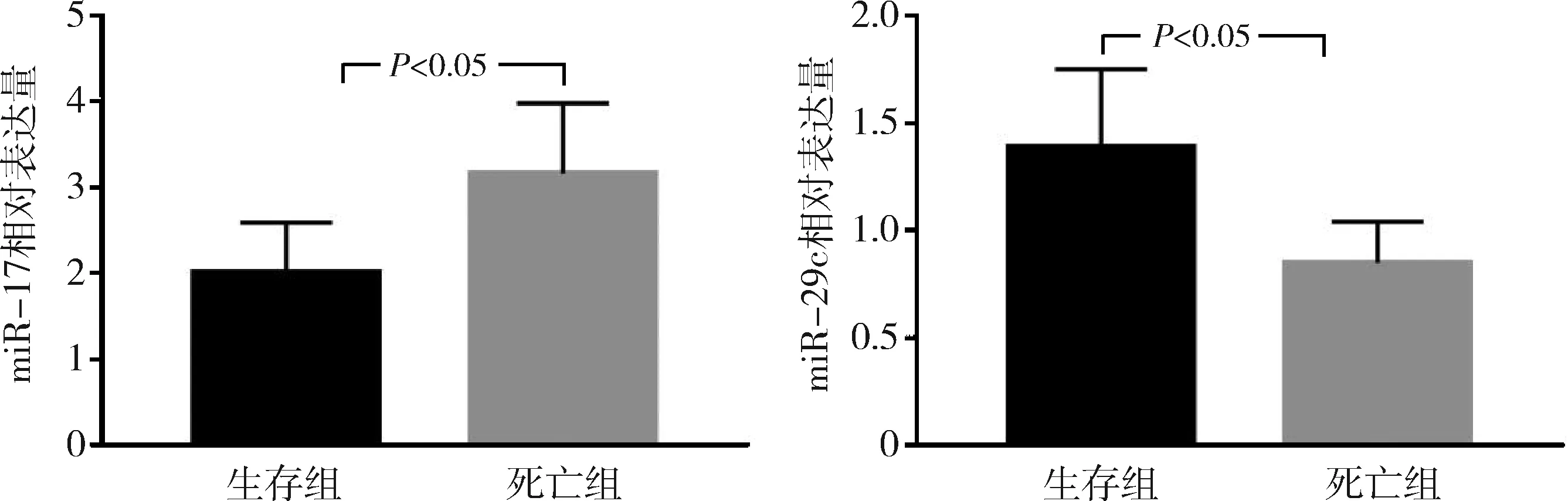
图2 不同预后患儿血清miR-17、miR-29c相对表达量
4.血清miR-17、miR-29c与患儿生存率的关系:根据患儿血清miR-17表达中位值2.45,将43例患儿分为两组:miR-17高表达组(≥2.45)20例,miR-17低表达组(<2.45)23例。miR-17高表达组患儿5年无事件生存率30%显著低于miR-17低表达组患儿69.57%(P<0.05),5年总生存率55%显著低于miR-17低表达组患儿86.96%(P<0.05);根据患儿血清miR-29c表达中位值1.25,将患儿分为两组:miR-29c高表达组(≥1.25)19例,miR-29c低表达组(<1.25)24例。miR-29c高表达组患儿5年无事件生存率73.68%显著高于miR-29c低表达组患儿33.33%(P<0.05),5年总生存率94.74%显著高于miR-29c低表达组患儿54.17%(P<0.05),详见表4和图3、图4。
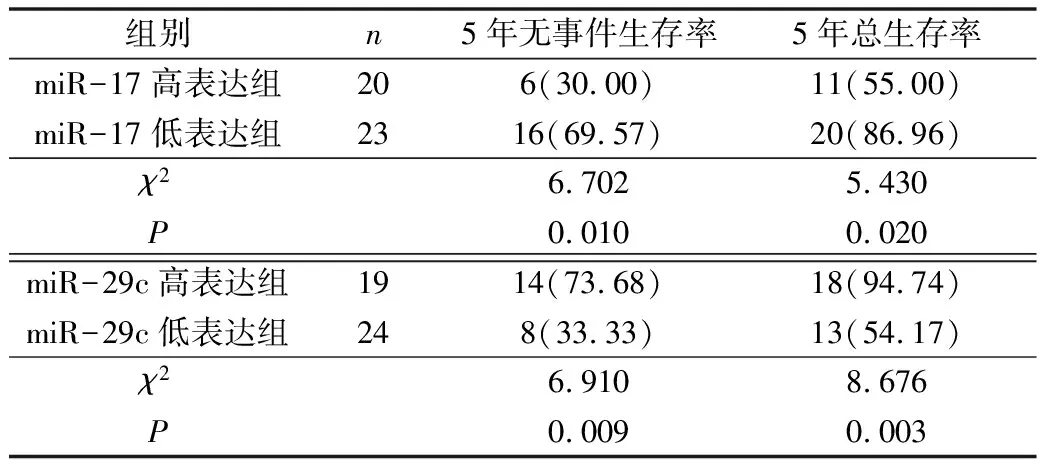
表4 血清miR-17、miR-29c与患儿生存率的关系[n(%)]
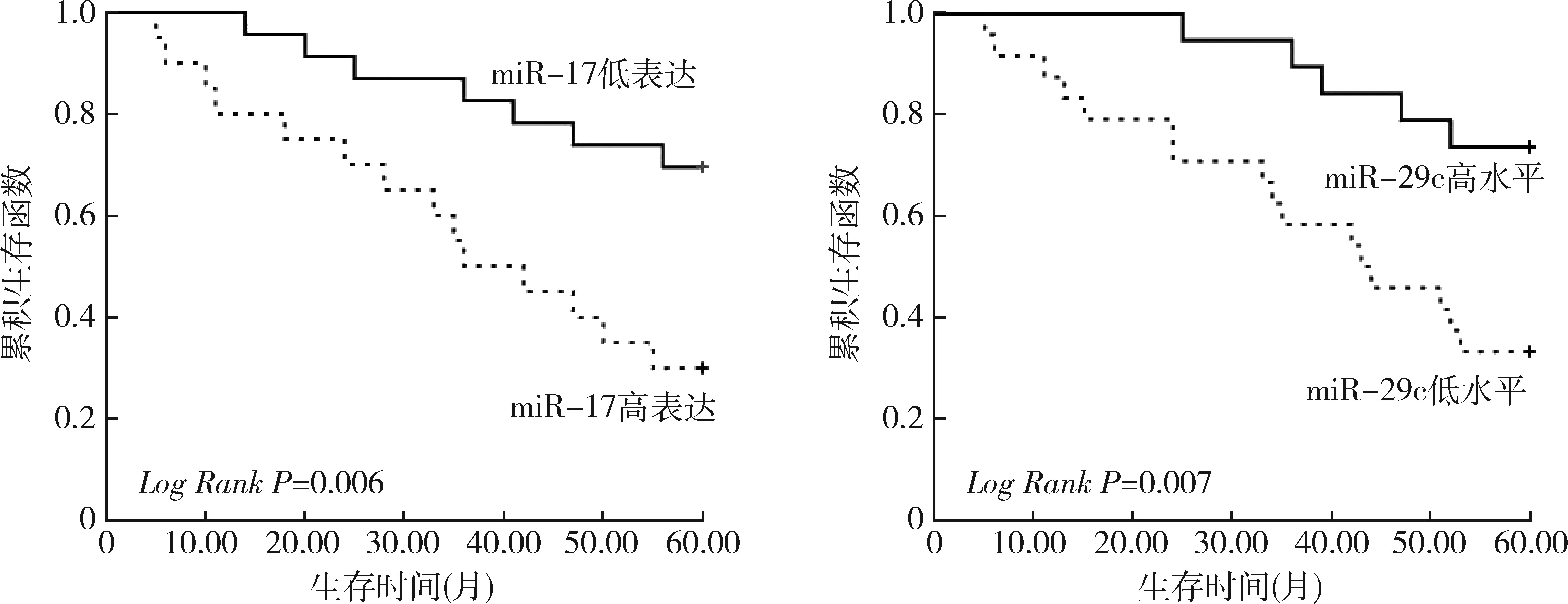
图3 ALL患儿5年无事件生存率K-M分析
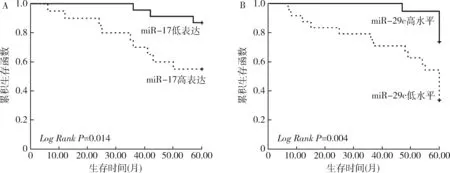
图4 ALL患儿5年总生存率K-M分析A.miR-17;B.miR-29c
讨 论
AL发病时骨髓中原始细胞及幼稚细胞异常大量增殖,在骨髓中积聚抑制正常造血,并浸润脾、淋巴结、肝脏等骨髓外脏器,临床表现为贫血、浸润、出血、感染等症状[6]。80%以上的AL儿童属于ALL,近年来,ALL患儿生存率得到很大提高,张钰等[7]采用CCLG-ALL-2008方案治疗ALL患儿,结果诱导缓解率96.3%,5年总生存率84.72%,5年无事件生存率81.53%。本研究采用CCLG-2008方案治疗ALL患儿,诱导缓解率90.70%,5年总生存率72.09%,无事件生存率51.16%,低于张钰等[7]研究结果,可能受样本量、患儿严重程度、复发等因素影响。研究表明,多种miRNAs影响造血细胞发育、分化,与白血病、淋巴瘤的发生及发展有关,此外,miRNAs异常表达可导致抑癌基因或致癌基因转录后调控失常,导致白血病发生[8]。
miR-17由miR-17-92编码,在血液系统肿瘤、胃癌、肺癌等多种肿瘤中过表达,发挥促癌作用。Shi等[9]研究表明,miR-17-92在难治性ALL中过表达,可能与患者多重抗药性发生、发展有关。Sharifi等[10]研究表明,抑制miR-17-92可通过调控p63的表达,诱导人急性早幼粒细胞白血病细胞凋亡并抑制细胞增殖,提示抑制miR-17-92可作为治疗白血病的新靶点。本研究结果表明,ALL患儿血清中miR-17相对表达量显著升高,与患儿初诊WBC计数、免疫分型有关。儿童ALL预后相关因素研究表明,初诊WBC计数≥50×109/L、泼尼松实验敏感度是导致患儿预后不良的独立危险因素[11]。说明血清miR-17表达水平可能与患儿预后不良有关。进一步分析死亡患儿和生存患儿血清miR-17表达水平发现,死亡患儿血清中miR-17表达水平显著高于生存患儿,K-M生存曲线分析显示,miR-17高表达患儿5年无事件生存率和总生存率均显著低于miR-17低表达患儿,证实miR-17高表达患儿预后较差。相关机制研究表明,BCR-ABL阳性ALL患者中抗凋亡蛋白BCL2是miR-17的直接靶点,体外实验证实,BCL2抑制可作为改善BCR-ABL阳性ALL患者治愈性治疗或长期疾病控制的新措施[12]。Mian等[13]研究表明,混合谱系白血病(MLL)中miR-17-92簇高表达,通过抗miR-17-92治疗显著降低MLL融合细胞系的集落形成能力,并证实PKNOX1是miR-17-92的作用靶点,提示miR-17-92在MEIS1/HOXA961介导的白血病细胞发育中发挥调控作用,可被用作新的治疗靶点。
miR-29c是miR-29家族成员之一,先前研究表明miR-29c是AML和骨髓分化的调控因子,在白血病中起肿瘤抑制剂作用。Gong等[14]研究表明,AML外周血单核细胞中miR-29表达降低,与信号分子Akt2、CCND2和c-Myc水平增加有关,动物实验表明,对AML小鼠注射miR-29c、miR-29a能够明显缓解白血病症状,提示挽救miR-29家族表达可能为AML治疗提供新策略。但miR-29c在儿童ALL中是否有相同的表达及意义尚未见报道。本研究结果,ALL患儿血清miR-29c相对表达量显著降低,与初诊WBC计数、免疫分型及泼尼松实验敏感度有关,进一步分析表明,死亡患儿血清miR-29c表达水平显著低于生存患儿,K-M生存曲线分析显示,miR-29c低表达患儿5年无事件生存率和总生存率均显著低于miR-29c高表达患儿,说明miR-29c在ALL患儿中低表达与患儿不良预后有关。
综上所述,miR-17和miR-29c在ALL患儿血清中异常表达,与患儿初诊WBC计数、免疫分型及泼尼松实验敏感度等临床指标有关,可能参与ALL发生、发展过程,对患儿预后产生不良影响。本研究初步说明miR-17和miR-29c可作为ALL患儿的预后标志物,提示miR-17和miR-29c可作为ALL患儿临床治疗的新靶点。今后会继续扩大样本量,探究miR-17和miR-29c在小儿ALL中的调控机制。

