新型蜂蜜敷料促创面愈合的动物实验研究
闵重函 周 瑛 钱 萍 陈平泉 严世贵 张洪美
中医学中蜂蜜作为一味古老的中药材,很早就被运用于临床,在很多典籍里都可以找到其身影,目前多作为内科汤剂的辅助用药。对于中医外科和骨伤科而言,其促进伤口愈合的治疗作用已经逐渐被发掘,但仍然缺乏系统细致的研究,而且目前临床上也缺少设计良好的成品蜂蜜敷料供换药直接使用,本研究将对比新型蜂蜜敷料和传统蜂蜜敷料促伤口愈合的效果,以及不同制剂浓度的蜂蜜对创面愈合的影响。
资料与方法
1.实验药物剂型:将蜂蜜(符合GB 14963—2011)经制药工艺浓缩制作为常温下的无菌实验制剂,一种是内含介于0.14~2.00mm的蜂蜜结晶的混悬液A;另一种是不含结晶颗粒的粘稠液B,外观类似于市售蜂蜜。
2.敷料的制作:传统蜂蜜敷料的制作方法类似于凡士林纱布。蜂蜜与石蜡油按100∶5的比例配制,加热溶解充分混合。将毛边撕掉后按临床需要制成不同规格的脱脂纱布放于密闭的不锈钢或铝储物盒内,厚度不超过1.3cm,用蜂蜜与石蜡油的混合液完全浸没。将储物盒放入160℃干热灭菌器进行2h灭菌,灭菌结束后,待温度降到40℃开箱,传统蜂蜜敷料即制备完成。新型蜂蜜敷料,也是本次研制的特殊结构敷料,由高吸水性树脂(由淀粉和聚丙烯酸盐组成)及多种材料制成的复合敷料,类似于大号创面敷贴外观,创面接触层直接涂抹蜂蜜约2~3mm(图1)。

图1 敷料截面结构Ⅵ弹性纤维层:最外侧,在敷料吸水过程中可适当扩张,增加吸水容积;Ⅴ拒水和缓存层:有纤维绒毛,减少吸水层饱和后出现组织液外渗的概率;Ⅳ吸水树脂层:仅和水分子结合,形成锁水凝胶;Ⅲ散湿层:和吸水层有交叉,将组织液快速分散至吸水层;Ⅱ打孔膜层:最内侧,表面有棱状突起,可为网格状结构,增加组织液吸收面积,周缘有突起的阻挡条,该侧涂抹蜂蜜
3.实验分组:按制剂情况分为使用新型结构敷料的A组(液A)、B组(液B)。传统蜂蜜敷料制备的C组(使用液B,换药前纱布敷料于注射用水中浸泡3~5s,稀释蜂蜜浓度)和D组(使用液B),以及E组(空白对照组,凡士林纱布覆盖创面)。
4.动物实验和测定:将150例雄性大鼠(由嘉兴学院医学院提供,实验动物许可证号为SYXK(浙)2016-00014清洁级,10周龄,体重181.39±12.63g,无个体体重差异)随机分至各组,每组30只。各组大鼠均单笼饲养,定时喂食,不限水。分别监测实验操作前一天空腹及餐后血糖。实验当天,空腹8h后均予以水合氯醛腹腔麻醉,背部广泛剃毛,常规消毒,用专业打孔器于大鼠背部脊柱左侧相同位置打孔(直径2cm),深及筋膜层,止血后以无菌纱布包扎,1天后创面有肉芽组织变化,基础疮疡模型即成功制备(图4)。模型制备成功后第2天起,所有大鼠均每天固定后换药,去除创面上分泌物及坏死组织,常规碘伏消毒,用生理盐水擦拭创面、无菌纱布拭干后分别使用相应分组的药物敷料盖创面,然后以包扎固定。选取换药第1天、第4天、第8天、第12天、第16天、第20天为观察窗口,测定实验大鼠外周空腹及换药后餐后血糖。采血时去除鼠尾尖端少许,收集血样,由同一台血糖监测仪(ACCU-CHEK Performa,Roche)以试纸法测定血糖。选取换药第1天、第4天、第8天 A、B、D 3组创面表层蜂蜜,放入数显蜂蜜波美度计(陆恒生物,CNF92),测量各组的波美度,即间接反映创面的蜂蜜浓度。局部疮疡在放置比例尺后拍摄平面照片,将照片导入Auto CAD软件,计算不规则创面面积。
5.统计学方法:采用SPSS 13.0统计学软件对数据进行分析,各组组内比较采用重复测量资料的单因素方差分析检验,组间的两两比较采用Bonferroni配对t检验,以P<0.05为差异有统计学意义。
结 果
1.体重不良反应发生及体重比较:所有创面经换药逐渐愈合,未有显著不良反应发生,截止第20天,大鼠称重结果为178.94±11.57g,与初始体重比较差异无统计学意义(t=1.75,P>0.05)。
2.各组创面面积变化情况:由表1可知,各组创口的面积大小均随时间延长进行性缩小,呈加速趋势。组间比较,在换药第1天、第4天左右创面面积比较差异无统计学意义,自第8天A、B组创面愈合速度开始比其他组快,两组之间比较差异无统计学意义;D组较A、B组慢,但较C、E组快;C、E组愈合速度最慢,组间比较差异无统计学意义。
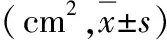
表1 各分组创面面积变化情况
组内比较:A组F=17.82,P<0.05;B组F=17.79,P<0.05;C组F=16.78,P<0.05;D组F=18.07,P<0.05;E组F=16.60,P<0.05;组间比较:同一观察时间,后一组与前组比较,*P<0.05,#P>0.05
3.各组血糖测量结果:除E组以外,其他各组均有不同浓度的蜂蜜直接外敷于创面,E组相当于空白组,起对照作用。但数据统计结果提示组内各观察点血糖值不随时间变化而出现差异性,组间比较差异无统计学意义,反映出无论外用蜂蜜浓度如何均不会导致大鼠空腹或餐后血糖异常,详见表2、表3。

表2 各分组空腹血糖情况
组内比较:A组F=1.48,P>0.05;B组F=1.25,P>0.05;C组F=1.91,P>0.05;D组F=1.64,P>0.05;E组F=1.60,P>0.05;组间比较:同一观察时间,后一组与前组比较,*P>0.05

表3 各分组餐后血糖情况
组内比较:A组F=2.36,P>0.05;B组F=2.07,P>0.05;C组F=2.87,P>0.05;D组F=2.71,P>0.05;E组F=2.20,P>0.05;组间比较:同一观察时间,后一组与前组比较,*P>0.05
4.换药时A、B、D组创面上蜂蜜的波美值:A、B、D 3组使用未经稀释的蜂蜜,原液的波美值比较差异无统计学意义;但组内各观测点和原液的波美值比较,差异有统计学意义。A、B两组各自组内比较,波美值不随时间推移而发生改变,但D组波美值随时间推移发生了改变,浓度逐渐下降,详见表4。
表4 换药时A、B、D组创面上蜂蜜的波美值情况(Bé,
组内比较:A组F=19.25,P>0.05;B组F=22.04,P>0.05;D组F=15.71,P<0.05;组间比较:同一观察时间,后一组与前组比较,*P>0.05,#P<0.05
讨 论
随着现代交通和社会工业的发展,肢体开放性损伤发生率明显增高,伴发的皮肤软组织缺损也不断增加,此外肿瘤及皮肤本身病变等原因形成皮肤缺损也十分常见[1]。目前临床处理方案多样,植皮、皮瓣转移等手术通过健康组织转位方法消除创面[2]。外固定牵张通过皮肤软组织的伸展性逐步拉拢创面两端,最终闭合缺口[3]。VSD、银离子敷料,美宝敷料等创面技术可以促创面的肉芽生长,降低或消除感染[4]。尽管如此,由于临床工作面对的创面情况复杂,患者对手术或治疗的耐受能力、接受性差异和经济成本、技术条件的限制,很多患者仍然接受传统的创面换药治疗,或者经过一定阶段的换药后,创面情况改善,可以实施手术操作,提高治疗成功概率[5]。
蜂蜜入药始载于《神农本草经》,具有滋阴润燥、补虚润肺、解毒的作用。《本草衍义》认为蜂蜜不仅可以解毒镇痛,外用可治疗口疮、疮疡、烧伤、烫伤等多种外伤疾病。该种药药用价值一直被典籍零散记录,并沿用至今。目前国内外对蜂蜜治疗外伤皮肤软组织缺损已经取得初步共识,认为蜂蜜可以破坏创面组织上细菌形成的有抵抗作用的生物膜,杀灭有害细菌,遏制创面感染,同时也可以改善软组织愈合过程中纤维结构,减少瘢痕增生,降低愈合后瘙痒、疼痛等不适症状[6~8]。因此有文献表明蜂蜜作为创面用药,不仅可以广泛使用于医疗资源紧缺的地区,也可以缓解微生物抗药性严重的国家,其功效和运用值得发掘、推广[9]。
传统蜂蜜敷料制备和使用方法几乎和凡士林纱布类似,将蜂蜜浸渍的纱布或无纺布,经高温灭菌消毒后,以单层或多层的片状结构,平铺于创口表面,外侧覆盖纱布、棉垫,以绷带或胶布固定,这在国内文献中多有报道,特别治疗难治性创面或有感染的创面取得良好的临床效果[10~12]。尽管如此,传统蜂蜜敷料作用于较大创面时由于创伤本身因素和蜂蜜的初始高浓度形成的高渗透压,使组织液大量渗出,蜂蜜被稀释,并随组织液进入外被的纱布和棉垫之中[13]。创面上的药液浓度下降,药用效果也降低,外被敷料湿透浸渍,增加感染机会和护理难度,需要经常更换,给医疗工作带来额外负担[14]。
有研究表明软组织创面在愈合过程中组织液内含有较多有益的生长因子,如转化生长因子(TGF-β)、血管内皮生长因子(VEGF)、成纤维细胞生长因子(FGF)和表皮生长因子(EGF)等,蜂蜜含有过氧化氢、丙酮醛类、蜜蜂抗素-1等物质,见本研究所用蜂蜜的药物光谱分析,Thermo is50 红外光谱仪,图3[15,16]。以上物质只有在保证局部高浓度前提下促进局部免疫调节,激活巨噬细胞、中性粒细胞的吞噬作用,清除创面坏死组织[17]。也可以刺激内皮细胞动员,加快新生血管和肉芽的生成,促进创面愈合[18]。
因此,新型敷料的设计尽可能吸收渗出液中的水分,减少蜂蜜的稀释、外漏,维持药物浓度,同时保持创面聚集高浓度生长因子。敷料结构可以分为6个层次,最外层Ⅵ是弹性纤维,在敷料吸水过程中可以适当扩张、臌胀,增加吸水容积。其内侧第Ⅴ层起防水作用,主要阻止内侧水液穿透,造成浸渍、渗出,污染被褥或衣物。Ⅳ层是吸水层,由淀粉和丙烯酸盐聚合物构成,只强力吸收水分,吸水后形成凝胶,在受热或加压下也不易失水,稳定性好,有锁水功能。Ⅲ层含有密集超细纤维可以通过毛细原理将水分或渗出液导入Ⅳ层,Ⅱ层最内侧是聚乙烯打孔膜,在打孔膜表面涂抹蜂蜜,其周边有缘状突起,似围栏样,和创面周缘组织贴合,使敷料像碗一样倒扣,阻挡蜂蜜向四周外溢,同时在创面表层形成由蜂蜜填充的腔隙。打孔膜上孔隙的倒漏斗样设计可以减少渗出液的倒流。Ⅱ层~Ⅳ层间为波浪样交错结构,增加接触面积,同时层内含有肝素锂或乙二胺四乙酸,防止血浆蛋白凝固堵塞孔道。Ⅰ层是蜂蜜层,直接接触创面,组织液的渗出将其局部稀释,吸水层将其水分去除后又再次浓缩,使敷料内部形成一个单向的内引流。创面蜂蜜波美值的变化说明经制药浓缩的原液涂抹在创面一天后都存在不同程度的稀释,但A、B两组由于新型敷料的作用,创面蜂蜜浓度和原液接近,且保持稳定,不随时间延长而出现差异性,传统敷料的D组蜂蜜浓度则不能保证,稀释程度较大,后期出现浓度升高的情况,考虑为创面向愈、渗出减少所致。故作用于面积较大或组织液持久渗出的创面,新型蜂蜜敷料更有优势。
从研究结果可知在外伤创面的愈合过程中,A、B、D组的创面愈合速度较C、E组快,说明高浓度蜂蜜外敷确有促进创面愈合的作用(A组创面愈合趋势见图2),而蜂蜜稀释液则没有。A、B组创面愈合都比D组快,但两组间比较差异无统计学意义,说明新型敷料疗效更佳,蜂蜜在创面浓度到达一定程度后其促愈合作用不再随药物浓度升高而进一步提高。
图2 新型蜂蜜敷料换药组CAD比例尺下的创面变化情况A.第1天;B.第8天;C.第12天;D.第16天。可见肉芽生长良好,创面周缘及基底部渐愈性生长

图3 蜂蜜的药物红外光谱分析图在波数3200处出现宽而圆的强峰(-OH缔合峰),在波数2800左右出现中强峰(C-H伸缩振动),在波数1634~1633左右表现为中峰(C=O伸缩振动), 在波数1400~1000左右为强峰(C-O伸缩振动),这是高浓度蜂蜜的特征性光谱表现[24]
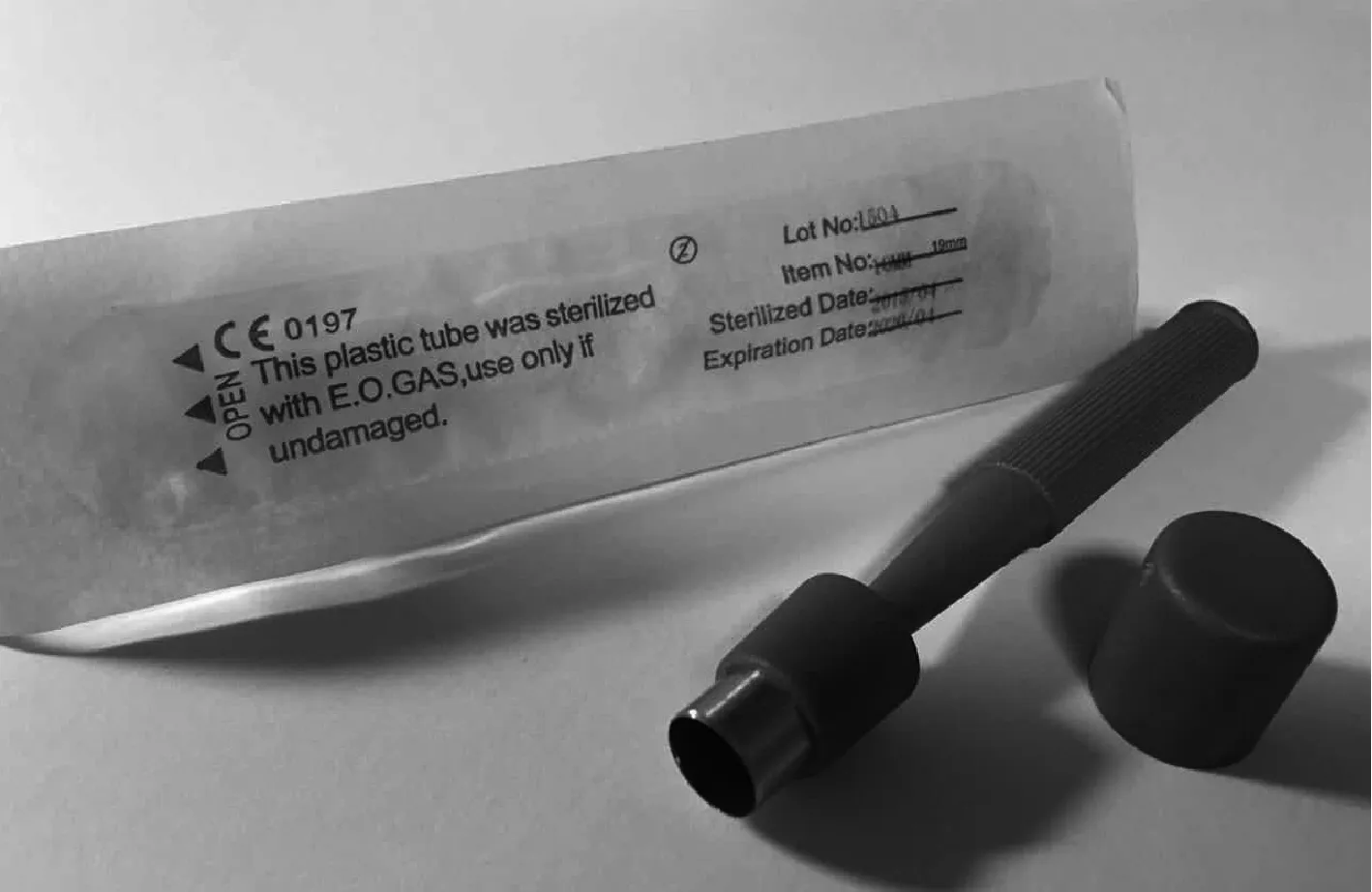
图4 本研究制备大鼠疮疡模型所用的皮肤打孔设备
A、B组细菌培养均为阴性,但C组3例、D组2例、E组3例存在表皮葡萄球菌、金黄色葡萄球菌。这也与文献经验相类似,表明蜂蜜高浓度形成的高渗透压和酸性环境是确保抑菌、杀菌作用的首要因素[19,20]。在这种环境中致病细菌的聚集和黏附作用下降、菌毛和鞭毛活动功能降低,细菌出现脱水、代谢紊乱,直至死亡[21,22]。本研究结果从另一个角度说明新型敷料的内引流结构有效保障了创面的药物浓度,而传统敷料则没有这一优势。
蜂蜜是以果糖、葡萄糖为主的大分子混合性糖,主要依靠位于肠黏膜上皮细胞的载体蛋白转运吸收入血,通过外伤创面直接吸收数量有限,难以造成整体血糖波动[23]。本研究对大鼠空腹血糖和餐后血糖的比较结果,提示使各组大鼠血糖数据差异无统计学意义,外用蜂蜜不造成血糖变化。
综上所述,新型蜂蜜敷料直接外用于创面,既可以促进愈合、通畅引流、减少感染,也不会造成血糖异常波动,值得推广。

