糖皮质激素影响间充质干细胞成骨分化的实验研究
徐莹 田野
1. 中国医科大学附属盛京医院麻醉科,辽宁 沈阳 110004 2. 中国医科大学附属盛京医院脊柱关节骨科,辽宁 沈阳 110004
糖皮质激素(glucocorticoids,GCs)是目前许多慢性疾病和自身免疫性疾病治疗的首选药物,如类风湿性关节炎、结缔组织病、炎性肠道疾病、慢性阻塞性肺炎和哮喘等。调查表明,全世界约有1%~2%的不同年龄段患者接受长期的GCs治疗[1]。其副作用中,糖皮质激素诱发的骨质疏松(glucocorticoid induced osteoporosis,GIO)是继发性骨质疏松的主要原因[2]。由此带来的低应激性骨折,更是给患者带来了巨大的痛苦和负担。虽然GIO目前在临床上已被广泛认知,但目前干预措施主要为发病后钙剂、磷酸盐的补充和骨折后的手术治疗,其发生发展具体机制仍不明确。
正常生理状态下,成骨与骨吸收处于平衡中。骨质疏松是多种原因所导致的成骨受到抑制,骨吸收大于骨形成,进而产生骨代谢失衡所致[3-4]。在成骨过程中,骨祖细胞作为骨组织的干细胞,分化为成骨细胞,参与骨代谢稳态的维持[5]。有研究[6]证实,在间充质干细胞(mesenchymal stem cells, MSCs)分化成骨细胞的过程中,不仅对成骨细胞的数量进行补充,而且能通过细胞旁分泌的形式分泌内源性生长因子,进一步促进成骨。其分化过程是一个受到多种信号通路与细胞因子调控的复杂过程[7]。
在对MSCs成骨分化的调控中,Notch信号通路已被证实具有明显的促进成骨分化作用[8],但在GIO中,Notch信号通路的作用仍不明确。本研究通过GCs对MSCs成骨分化的影响入手,明确在GIO发生发展中MSCs的功能变化,并进一步验证Notch信号通路在这种变化中的调控作用。
1 材料与方法
1.1 材料
人MSCs细胞系(Lonza Group 公司,美国);MSCGM 培养基(Mesenchymal Stem Cell Growth Medium,Lonza公司,瑞士);JAG1重组蛋白 (EnzoLife Sciences公司,美国), Alizarin Red 染色剂(北京索莱宝科技有限公司,中国);anti-Hes1,anti-ALP,anti-Collagen1,(Santa Cruz公司,美国);RNeasy 试剂盒(Qiagen公司,美国);逆转录试剂盒(Invitrogen公司,美国);Apo-ONE homogeneous Caspase-3/7分析试剂盒(Promeg Biosciences公司,美国);SYBR Green(Applied Biosystems公司,美国)。
1.2 细胞培养和分组
将细胞以5 000 cell/mm2的密度接种于6孔培养皿的MSCGM培养液中,其内加入10%胎牛血清、1% 青霉素溶液、5 mmol/L的L-Glutamine,置于37 ℃、5% CO2,6% O2的饱和湿度孵育箱中培养,至细胞70%~80%融合时,分别以生理盐水(对照组)、地塞米松106mol/L(GCs处理组)、地塞米松106mol/L+JAG1(Notch信号通路配体激活,GCs+JAG1组)处理细胞。于孵育箱内共同培养48 h。
1.3 检测指标
1.3.1 细胞凋亡分析:收取细胞,通过Apo-ONE homogeneous Caspase-3/7分析试剂盒,应用multi-mode microplate reader软件,以530 nm来测量吸收率,分析细胞凋亡情况。
1.3.2 RNA提取和real-time PCR检测:应用RNeasy试剂盒提取细胞总RNA,逆转录合成cDNA,稀释3倍后,取1 μL稀释后的cDNA进行Real-timePCR反应。在95 ℃预变性15 min,同温度下变性20 s,在58 ℃退火30 s,在72 ℃条件下延伸30 s,共计45个循环。于延伸阶段检测荧光产物,生成扩增曲线。在每个同次反应中,各组均设3个平行重复实验。以β-actin 为内参基因,通过PCR仪RotorGene 分析软件进行定量分析。特异性引物序列见表1。
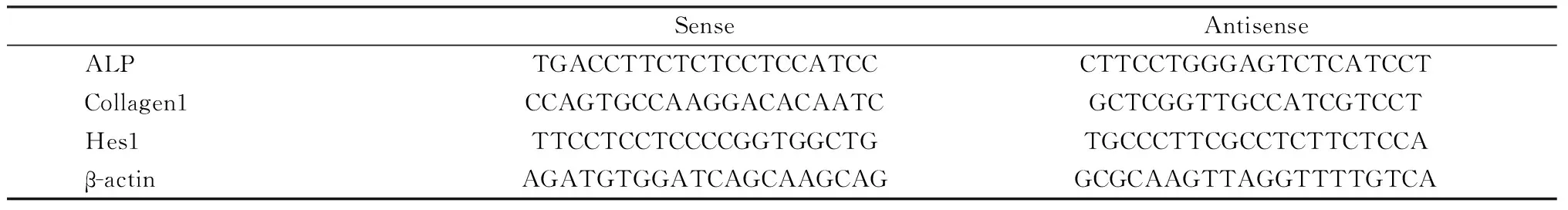
表1 特异性引物序列Table 1 Specific primer sequence
1.3.3 Western blot 蛋白表达检测:应用Goldenlysis buffer液提取细胞总蛋白,BCA法测定蛋白浓度,每泳道上样40 μg。应用10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳,电转移到聚偏氟乙烯(PVDF)膜上。转膜后应用5%的脱脂牛奶封闭,并与一抗4 ℃孵化过夜。一抗分别为anti-Hes1,anti-ALP,anti-Collagen1(1∶1 000,Santa Cruz.Cambridge, MA, USA)。次日PVDF膜在室温下与二抗(中杉金桥,中国)孵化2 h。应用显影液(赛默飞世尔科技,美国)使蛋白条带显影。使用Image Quant 5.0 软件对蛋白条带进行密度分析。通过应用β-actin作为内参来控制实验误差。
1.3.4 茜素红染色:培养48 h后除去细胞培养液,蒸馏水清洗3次;10%中性甲醛4 ℃条件下固定细胞20 min;吸除甲醛,蒸馏水清洗3次;加入Alizarin Red染色剂,于室温下染色30 min;吸除染色剂,蒸馏水清洗3次;加入乙醇脱水,室温下自然干燥过夜。显微镜下观察,照相。
1.4 统计学分析
全部计量数据以均数±标准差表示,并按照SNK法进行单因素方差分析(ANOVA),各组间比较采用t检验;当P<0.05时认为差异有统计学意义。所有数据应用SPSS 17.0软件进行分析。
2 结果
2.1 GCs处理对MSCs凋亡的影响。
在GCs处理后48 h,通过应用multi-mode microplate reader软件,以530 nm波长吸收率计数Caspase-3/7阳性的细胞,计算凋亡细胞百分率。笔者发现,与对照组相比,GCs处理组凋亡细胞百分率明显增加[(80±5.789)vs 对照组(60±7.132),P<0.05];而GCs+JAG1组则部分减少了凋亡细胞百分率(72±2.169),与GCs组相比,P<0.05;与对照组相比,P<0.05,见图1。
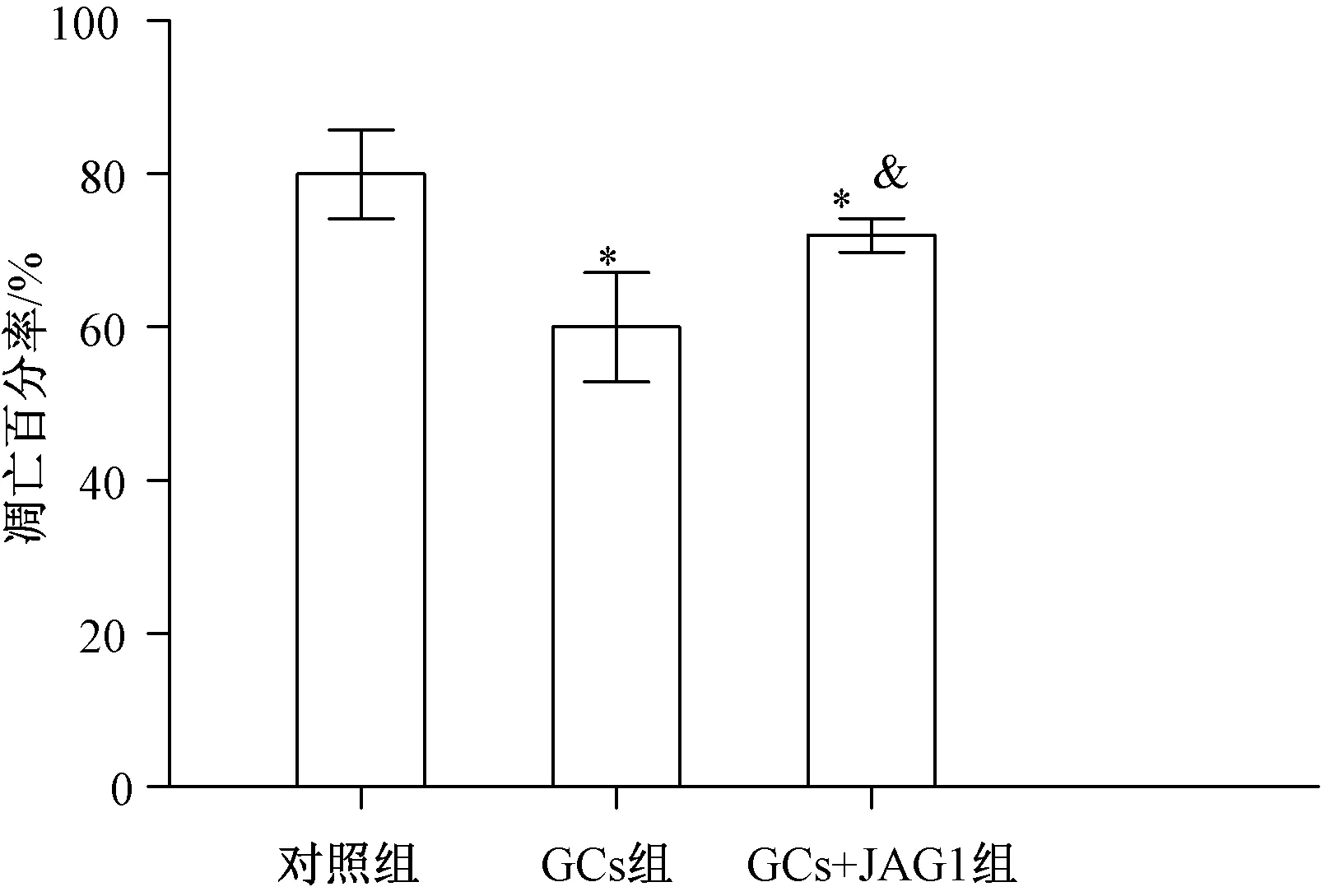
图1 GCs处理对MSCs凋亡的影响(与对照组比较,*P<0.05;与GCs组比较,&P<0.05)Fig.1 Effects of GCs on MSCs apoptosis(vs control group,*P<0.05; vs GCs group,&P<0.05)
2.2 GCs处理对MSCs中Notch信号通路表达的影响
通过对各组MSCs的Hes1mRNA的RT-PCR检测,与对照组相比,GCs处理组Hes1mRNA明显降低(P<0.05),JAG1的给予逆转了Hes1mRNA的下降(与GCs组相比,P<0.05;与对照组相比,P>0.05);通过Western blot检测Hes1蛋白表达,与RT-PCR结果一致(见图2a,图2b)。
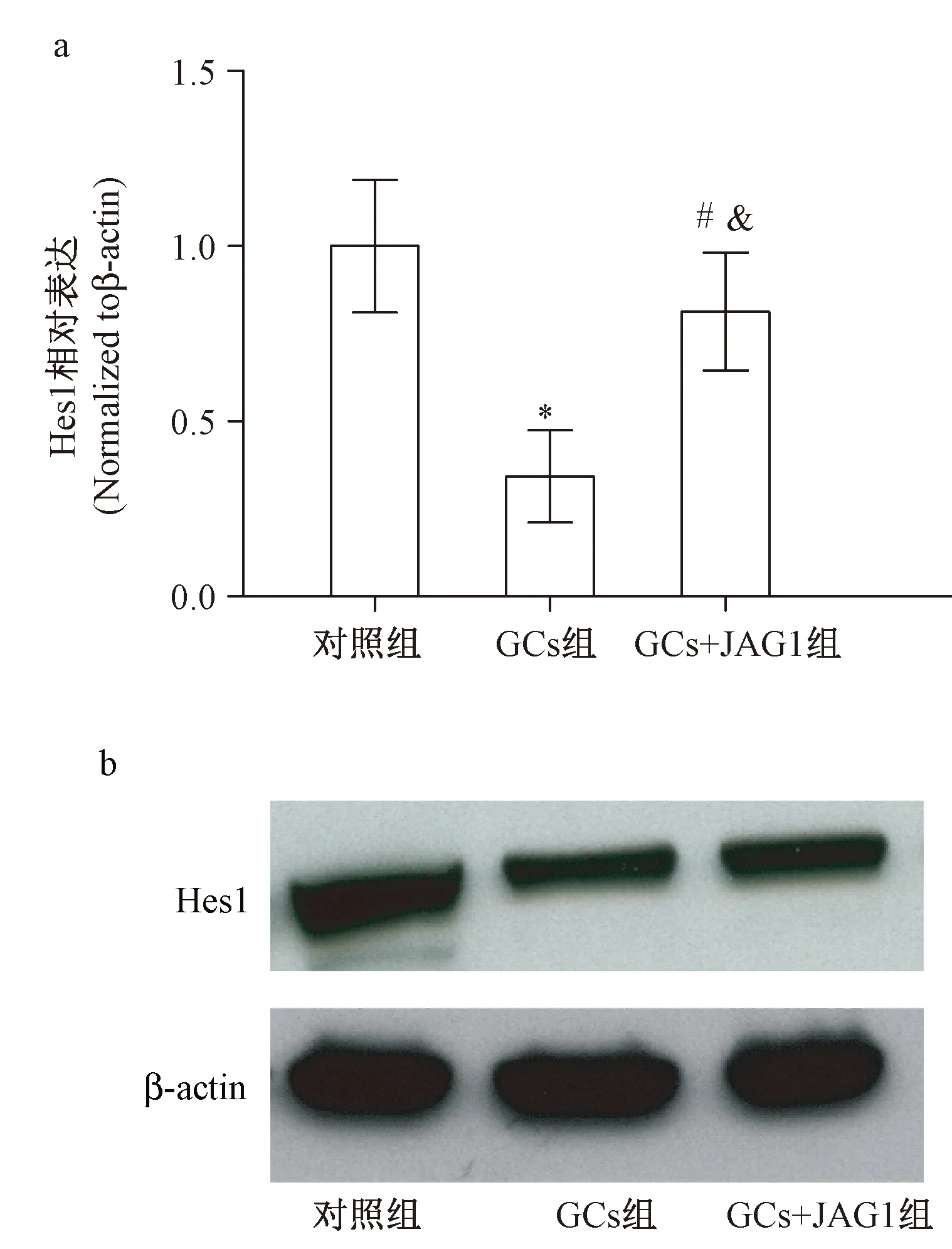
图2 GCs处理对MSCs中Notch信号通路的影响(与对照组相比,*P<0.05;与GCs组相比,&P<0.05;与对照组相比,#P>0.05)Fig.2 Effects of GCs on Notch signaling in MSCs (vs control group,*P<0.05; vs GCs group,&P<0.05; vs control group,#P>0.05)
2.3 GCs处理对MSCs成骨分化的影响
在对各组MSCs成骨相关的指标ALP、Collagen1的RT-PCR和Western blot检测中,发现GCs处理组ALP、Collagen1的mRNA明显降低,蛋白表达也同步下降,与对照组相比,P<0.05;在GCs+JAG1组,逆转了上述下降(与GCs组相比,P<0.05;与对照组相比,P>0.05),见图3a~图3c。在茜素红染色的实验中,与对照组相比,GCs处理组染色明显减弱(P<0.05),GCs+JAG1组染色强度得到明显改善(与GCs组相比,P<0.05;与对照组相比,P>0.05),见图4。
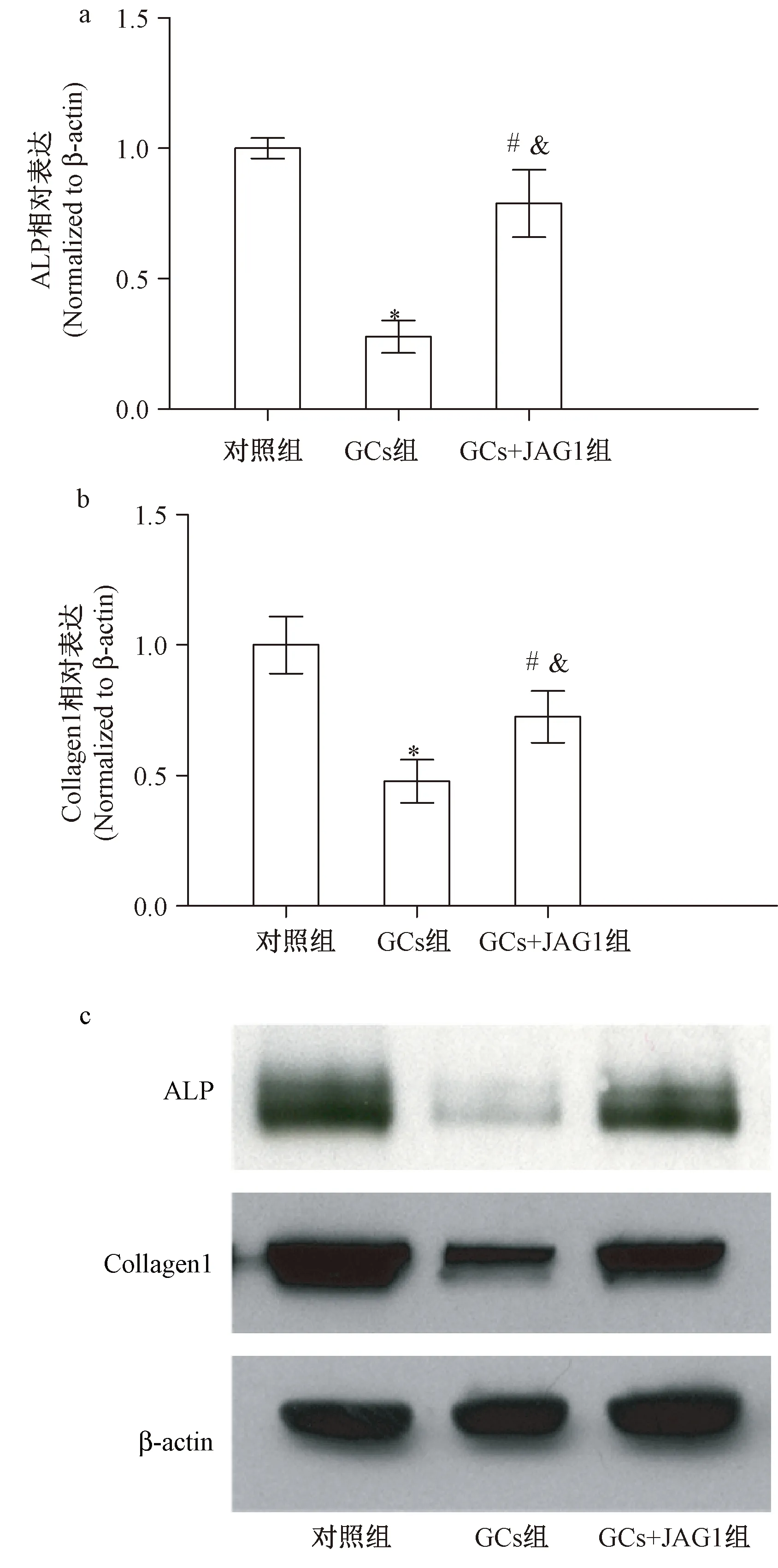
图3 GCs处理对MSCs成骨分化的影响(与对照组相比,*P<0.05;与GCs组相比,&P<0.05;与对照组相比,#P>0.05)Fig.3 Effects of GCs on MSCs osteogenic differentiation (vs control group,*P<0.05; vs GCs group,&P<0.05; vs control group,#P>0.05)
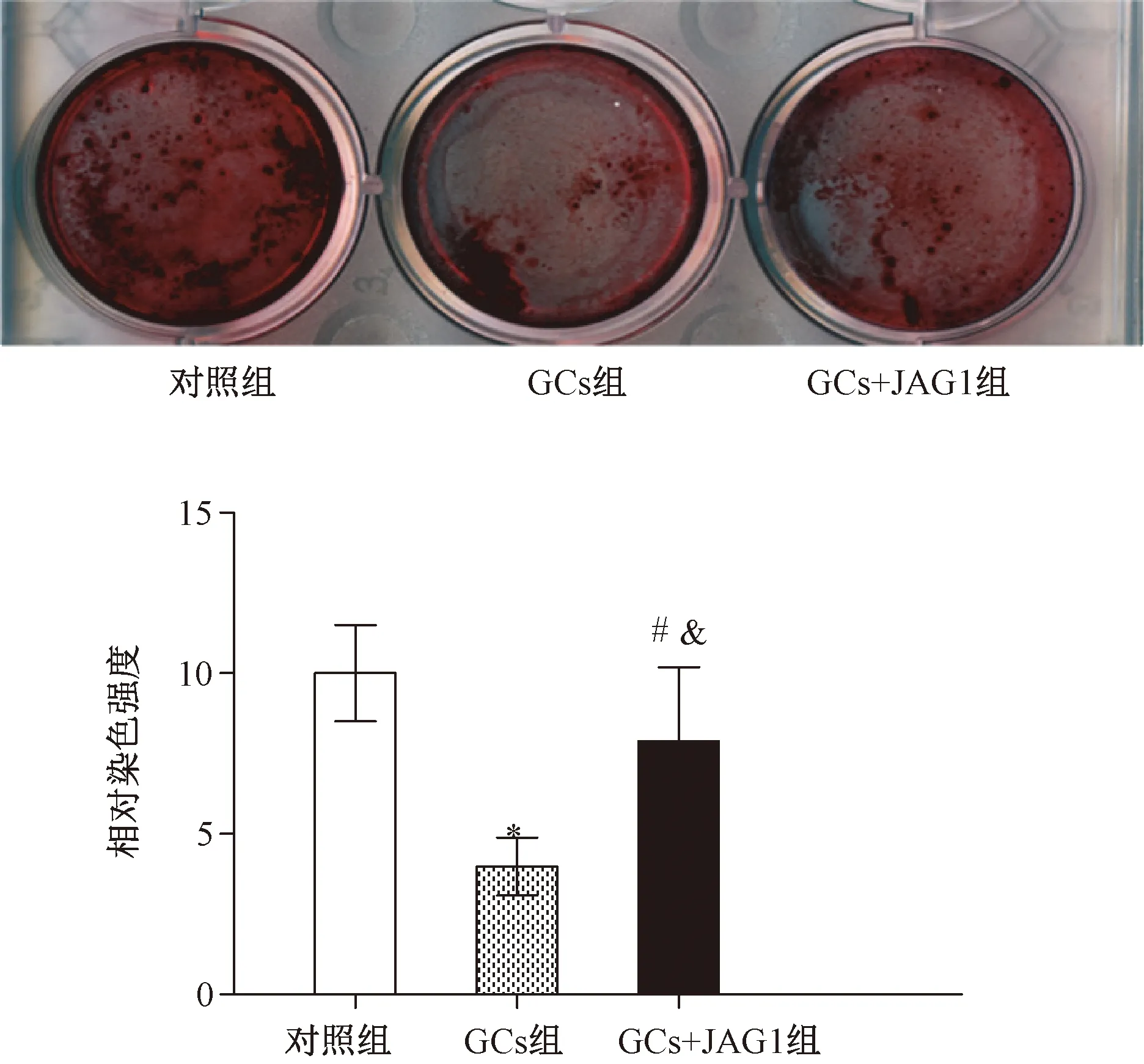
图4 GCs处理对MSCs茜素红染色的影响(与对照组相比,*P<0.05;与GCs组相比,&P<0.05;与对照组相比,#P>0.05)Fig.4 Effects of GCs on Alizarin staining in MSCs (vs control group,*P<0.05; vs GCs group,&P<0.05; vs control group,#P>0.05)
3 讨论
糖皮质激素诱导的骨质疏松(GIO)是长期或大剂量应用GCs而产生的骨骼系统并发症,是继发性骨质疏松的主要原因[2,9]。已有研究[10]证实,骨质疏松发生的主要机制为骨代谢障碍,而GIO的具体发生发展机制目前仍不明确。本研究从GCs对成骨方面的影响入手,探讨由此而产生的骨代谢失衡,及GIO的发病机制。
已有研究[6]证实,在骨代谢和骨重建的过程中,MSCs作为成骨细胞的重要来源,同时在骨组织局部通过细胞旁分泌方式释放生长因子,促进成骨。在本实验中, GCs对MSCs的成骨分化标志基因ALP和Collagen1的mRNA与蛋白水平表达,都具有明显的抑制作用,而且增加了MSCs的凋亡,表明GCs对细胞成骨分化具有明显的抑制作用。对于GCs体外应用浓度的选择上,笔者选择了106mmol/L的地塞米松,这是基于对前期研究和文献的查阅[11],相当于摄入5 mg/kg GCs(临床常用的治疗量)后的体内血药浓度。
体内MSCs的成骨分化是一个由多种机制共同调节的复杂过程。Notch信号通路近年来被证实广泛参与体内骨骼系统的成骨和血管生发过程,是MSCs成骨分化调控的重要机制。有研究[12]发现在Notch受体和配体突变的小鼠模型中,骨内发生异常的血管构建,骨生发减少,软骨细胞异常,骨小梁减少和骨量缺失,已经发现,在JAG1涂层的培养皿中培养的MSCs中,细胞内ALP等成骨标志性基因表达显著增强;当沉默Notch信号通路时,细胞内成骨相关基因表达减弱[13]。在本次实验中,就GCs对MSCs中Notch信号通路的表达的影响进行了验证,发现GCs对其具有明显的抑制作用,这种抑制作用通过补充Notch信号通路配体JAG1而得到逆转。并且,MSCs的成骨分化也因Notch信号系统的激活,得到一定程度的增强,提示Notch信号通路是GIO发生发展的潜在机制之一。
综上所述,本研究证实GCs能够增加MSCs的凋亡,并抑制其成骨分化,其机制与GCs抑制MSCs中的Notch信号通路表达有关。对MSCs中Notch信号通路的进一步研究将为GIO的干预治疗提供新的靶点和思路。

