柚皮素的提取及其抗癌作用研究进展
唐 镜,谭若兰,吕中建,唐 斌,郭建敏
(1.西南医科大学 药学院,四川 泸州 646000;2.成都克莱蒙医药科技有限公司,四川 成都 610000;3.西南医科大学 基础医学院,四川 泸州 646000)
1 引言
柚皮素(Naringenin)结构如图1所示,为白色针状晶体,分子式C15H12O5,分子量272.25 g/mol,熔点260 ℃,溶于乙醇、乙醚和苯,几乎不溶于水[1]。柚皮素分子显中极性,由于分子内含有苯环、羟基、羰基等官能团,所以在紫外区有吸收,吸收波长为325 nm[1]。
柚皮素存在于菝葜、化橘红、枳实、桃叶[2]等天然植物中,一般以柚皮苷的形式存在于自然界中,柚皮素是柚皮甙的甙元,通常可以通过水解糖苷键制备柚皮素。柚皮素具有抗菌[3]、抗氧化[4]、抗炎[4]、抗癌[5]、抗粥样动脉硬化[6]、解痉和利胆等作用,可被广泛地应用于医药、食品等领域[7]。
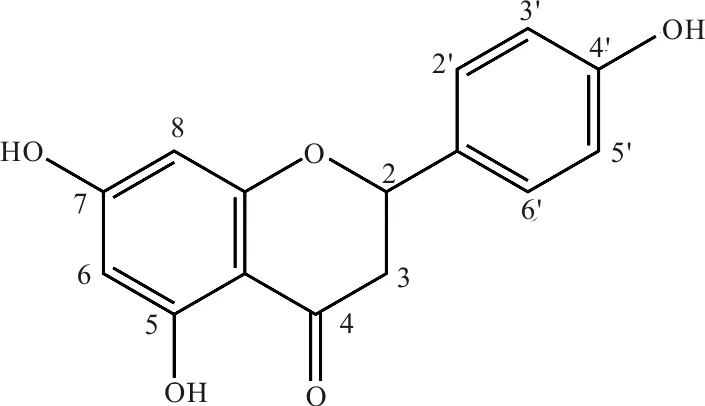
图1 柚皮素的化学结构式
2 柚皮素的提取
2.1 酸水解法
原料先以水为溶剂,加热提取柚皮苷或直接以柚皮苷作为原料,再通过无机酸或有机酸水解得到柚皮素的粗品,最后溶解于有机溶剂中进行柚皮素的纯化。如张林凤等[8]以干燥柚子落地果为原料,投入热水中提取得柚皮苷,柚皮苷用盐酸水溶液水解,得到柚皮素粗晶体,加入重量比1∶5的乙醇进行重结晶,实验检测,柚皮素得率达98%。李伟等[9]以破碎干燥的柚子皮为原料,水为溶剂加热提取得柚皮苷提取液,再加入酸,加热加压水解,得柚皮素粗品,用低碳醇的水溶液进行重结晶,所得柚皮素纯度>99.67%,柚皮素得率>85%。
樊振等[10]柚皮苷在低级醇或低级酮溶剂中的溶液在酸性条件下发生酸水解获得柚皮素粗品,使柚皮素粗品溶解在无水乙醇或无水甲醇中,加活性炭脱色,分离提纯,干燥后得柚皮素纯度达99%。温尧林等[11]将柚皮苷边搅拌边加入有机酸溶液中水解,获得柚皮素粗品溶解在含有活性炭的50%~90%乙醇溶液中,抽滤干燥,柚皮素得率和纯度均达98%。李玉山[12]在柚皮苷水解过程中加入抗氧化剂,得到柚皮素反应物,冷却沉淀,沉淀物以板框压滤机压滤,得柚皮粗品以一定量的有机溶剂溶解,加入活性炭脱色过滤,结晶干燥,得到柚皮素精品纯度达98%。
陈雪峰等[13]以桃叶为原料,干燥粉碎,过60目筛,65%乙醇、料液比1∶35、温度40 ℃、提取4 h,乙醇甲醇体积比7∶3、料液比1∶45(g∶mL)、温度50 ℃、再次提取5 h,柚皮素平均获得率为5.25%。
刘亚萍等[14]以化橘红为原料,加入蒸馏水提取得柚皮苷粗品,再用水重结晶得精制柚皮苷,在精制柚皮苷中按1∶100加入2% H2SO4,冷却加碱调pH值至中性,加入等量乙酸乙酯置于分液漏斗中萃取,浓缩后用乙醇重结晶,得柚皮素得率较低。
酸水解法设备简单,试剂易获得,柚皮素获得率和纯度高,方法优化空间大,但有机溶剂用量大,步骤繁琐,需反复结晶。
2.2 超临界CO2萃取法
原料直接用超临界CO2作为溶剂,再添加一定的夹带剂,在一定条件下萃取出柚皮素。如洪昕[15]以干燥粉碎并过筛后的桃叶为原料,以一定量乙醇为夹带剂,在温度60 ℃,压力30 MPa的条件下萃取6 h后,柚皮素提取率为2.18%。陈雪峰等[16]亦通过实验证实此为最优方案,其纯度为36.33%。全灿等[17]以柑橘皮为原料加入料液比为1∶0.3的10%的乙醇溶液,没泡12 h后,加入到萃取釜中静态萃取0.3 h,再动态萃取3 h,收集得到柚皮素粗品,得率达78%,采用C18制备色谱柱进行纯化,柚皮素纯度达99.5%。
超临界CO2萃取法与传统的酸水解法相比较,提取率高、时间短、工艺简单、操作方便,但所用的设备要求较高,投资大,萃取物含杂质较多。以桃叶为原料时,萃取物中含大量的叶绿素。
2.3 酶水解法
以酶作为催化剂水解柚皮苷,得柚皮素粗品后添加有机溶剂中进行柚皮素的纯化。如李晓凤等[18]在缓冲溶液中加入有机溶剂或者离子液体(体积比1∶1~1∶5),混匀后加入柚皮苷,以黑曲霉细胞为催化剂,得到粗产物,采用等体积的乙酸乙醋萃取3次,减压蒸干,再加入甲醇溶解过滤,滤液在40 ℃下减压干燥后, 得到纯度达98%的柚皮素。朱必玉等[19]以柚皮苷为原料,在底物浓度为4.0 g/L、温度为55 ℃、pH值为3.0的条件下加交联柚苷酶聚集体18.0 mg/mL,反应24 h后柚皮素得率为97.72%。
酶水解法工艺简单,纯度高,但用酶量大,价格昂贵,柚皮苷初始含量改变可能会导致后条件发生变化。
3 抗癌作用
3.1 抗胃癌
柚皮素(Nar)可明显抑制人胃癌细胞系SGC-7901细胞的生长,可降低胃癌细胞内 MMP-2、MMP-9 的表达,对SGC-7901细胞株的增殖、黏附、侵袭和迁移能力有明显抑制作用[20],Nar的刺激能明显提高caspase-3凋亡细胞活性,促进caspase-3以及PARP的表达,能够明显抑制Akt的磷酸化,提高p53蛋白的表达[21],可降低抗凋亡蛋白Bcl-2和Survivin的表达,增加促凋亡蛋白Bax和裂解的caspase-3的表达,进一步诱导胃癌细胞的凋亡[22],作用呈时间-剂量浓度依耐性[21]。大量与肿瘤形成和发展相关的基因,证实是被β-catenin/Tcf信号激活。Nar能作用于β-catenin本身或下游成分,不激活胞质b-catenin的降解途径,抑制AGS胃癌细胞的β-catenin/Tcf信号[23]。Nar对胃癌的具体作用机制尚未明确,但其抗胃癌活性可以体现。Nar通过保护谷胱甘肽代谢酶、I期和II期异型生物酶,对MNNG诱导和S-NaCl促进的胃癌有抑制作用,对肿瘤的形成有预防作用[24]。
3.2 抗肺癌
Nar通过诱导人肺癌A549细胞DR5的表达[25],抑制A549细胞的增殖并诱导其凋亡,抑制AKT活性和下调MMP-2和MMP-9,抑制A549细胞的迁移[26],有明显的时间-剂量浓度依赖关系[27]。抑制MAPKs/AP-1和IKKs/IκB/NF-κB 信号通路的协同活性,减弱A549 细胞中EGF诱导的MUC5AC黏蛋白分泌[28]。
Nar能诱导NcI-H2170细胞产生G1期阻滞,PARP蛋白表达量下降,抑制DNA的复制的同时无法进行DNA修复,从而抑制人肺鳞癌NcI-H2170细胞增殖,促凋亡因子Bid表达上调,Bcl-2表达下调,Procaspase-3、Procaspase-8被激活,诱导NcI-H2170细胞凋亡[29]。Qin等[30]发现小鼠口服Nar可明显减少肿瘤细胞向肺转移的数量,T细胞的抗肿瘤活性增强,延长肿瘤切除小鼠的生存期。
3.3 抗肝癌
作用于人肝癌细胞系HepG2细胞后,Nar诱导HepG2细胞表面DR5受体表达上调,激活Caspase-8信号转导通路,增强抗人DR5单克隆抗体对HepG2细胞的凋亡作用[31]。Nar作用于肝癌细胞(MHCC97-H)后,MMP-9表达明显下降,E-钙黏蛋白表达明显升高,而N-钙黏蛋白表达无明显改变,抑制细胞上皮-间充质转化能力从而抑制肿瘤的侵袭转移能力,促进肝癌细胞凋亡[32]。
3.4 抗乳腺癌
Nar通过下调Cdk4、Cdk6、Cdk7、Bcl-2、x-IAP和c-IAP-2,上调细胞中的p18、p19、p21、caspases-3、7、8和9、Bak、AIF和Bax来调节细胞周期基因的表达,使细胞周期停留在S期或G2/M期,诱导乳腺癌细胞(HTB26,HTB132)凋亡。同时降低细胞存活因子PI3K、pAkt、pIκBα和NFκBp65的表达水平,有明显的时间-剂量浓度依赖关系[33]。Nar对MCF-7乳腺癌细胞的增殖和活力有影响,Nar靶向ERK,能抑制胞外信号调节激酶(ERK1/2)磷酸化、改变ERA定位、抑制MAPK信号通路。但它也靶向参与细胞活力和凋亡的其他蛋白质,可能以多种蛋白为靶点诱导其对细胞增殖和存活的影响[34]。Nar是一种潜在的PI3K抑制剂和MEK抑制剂,抑制胰岛素诱导 GLUT4易位的关键调节因子磷酸肌醇3-激酶(PI3K)的活性、受损的下游信号分子 Akt 的磷酸化、p44/p42 有丝分裂原活化蛋白激酶的磷酸化,抑制葡萄糖的摄取而抑制MCF-7 乳腺癌细胞的增殖[35]。柚皮素是一种弱雌激素激动剂,T47D-KBluc乳腺癌细胞表现出雌激素缺乏状态[36]。柚皮素作用于表达或不表达的雌激素受体α(ERα)乳腺癌细胞系,发现柚皮素与 ERα结合作为拮抗剂降低了 ERα阳性细胞的数量[37]。
3.5 抗结肠癌
Nar通过p38激活增加转录激活和ATF3蛋白水平,而Nar介导的ATF3表达在部分程度上对人结肠癌细胞的凋亡有少量贡献[38]。Nar通过下调Cdk4、Cdk6、Cdk7、Bcl-2、x-IAP和c-IAP-2,上调细胞中的p18、p19、p21、caspases-3、7、8和9、Bak、AIF和Bax来调节细胞周期基因的表达,使细胞周期停留在S期或G2/M期,诱导大肠癌细胞(SW1116,SW837)凋亡。同时降低细胞存活因子PI3K、pAkt、pIκBα和NFκ B p65的表达水平,有明显的时间-剂量浓度依赖关系[33]。Jeong 等[39]还发现Nar诱导细胞周期蛋白D1的降解。
3.6 其他
Nar通过抑制胰腺癌细胞中TGF-B1/Smad3信号通路,下调了EMT标记物在mRNA和蛋白质水平的表达,抑制了胰腺癌细胞的迁移和侵袭[40]。Nar在SUN-213细胞中可能抑制PRDx-1Y途径促进胰腺癌细胞凋亡[41]。
Nar是一种新型的MMP-2抑制剂,可能具有抑制膀胱癌转移的潜力[42]。
Nar对前列腺癌细胞的增殖和迁移有明显的抑制作用,还能通过调节PI3K/AKT和抑制ERK 1/2、P38和c-Jun N端激酶(JNK)细胞信号通路诱导细胞凋亡,实现Ell系依赖性。在PC3细胞中,柚皮素可引起MMP的丢失和内源性AP的ROS的生成,而在不影响MMP的情况下,可诱导LNCaP细胞产生ROS[43]。Aktas等表明[44]柚皮素抑制细胞迁移和侵袭的浓度对细胞没有毒性作用或阻止生长,但是对由SCN9A基因直接或间接编码VGSC具有抑制活性,从而抑制前列腺癌细胞转移性行为。Gao等[45]证实了Nar能刺激氧化应激后LNCaP前列腺癌细胞BER酶基因的表达,这种刺激反过来导致通过定量8-OH-DG/106DG水平确定的增强的DNA修复。
4 柚皮素的量子化学研究
刘科梅等[46]使用密度泛函理论(DFT)中的B3LYP方法,在6~31G (d, p)基组水平上对柚皮素进行研究,结果表明柚皮素的抗氧化活性位点主要是 4’-OH、5-OH 以及7-OH 3个基团,其中4’-OH的活性最大。柚皮素的溶剂效应、与信号蛋白的相互作用等量子化计算未见报道。近年来量子化学研究溶剂效应的两种方法分别是自洽反应场(SCRF)理论计算法和量子力学、分子力学结合模型(QM-MM模型)计算法[47]。量子化学研究分子间相互作用的方法主要有DFT、abinitioI-IFSCF和微扰MP2等。相比之下DFT计算方法既考虑了电子相关性,与MP2相比也不是太费时,计算精度与MP2相当,是研究分子间弱相互作用,特别是大体系相互作用比较理想的理论工具[48]。
5 结语
柚皮素的提取方法中,3种方法各有优缺点,可根据自身实验环境条件和得率、纯度的要求进行的选择。
Nar对胃癌(SGC7901)、肺癌(A549、NcI-H2170)、肝癌(HepG2、MHCC97-H)、乳腺癌(HTB26,HTB132、T47D-KBluc)、结肠癌(SW1116,SW837)、胰腺癌、膀胱癌、前列腺癌细胞等有抗增殖、抗黏附、抗侵袭和抗迁移能力。在Nar的作用下,caspase家族、bcl-2、bax、ALF、MAPK通路、周期蛋白依赖性激酶等生长凋亡调控相关的表达在癌细胞中活性增强,促进癌细胞凋亡。Nar可能以多种蛋白为靶点,调节信号通路,但具体作用机制尚未明确。
目前,柚皮素的抗氧化活性点已通过DFT方法计算得出。探究柚皮素在抗癌过程中的分子机制与相互作用,为柚皮素的药物研发与临床应用提供理论依据,量子化学理论计算方法拥有良好的应用前景。

