花生壳乙醇提取物(EEPH)抗细菌作用差异性研究
戚馨月,田兴国,汪海峰,周建新
(南京财经大学 食品科学与工程学院 江苏省现代粮食流通与安全协同创新中心 江苏高校粮油质量安全控制及深加工重点实验室,南京 210023)
食品由于微生物污染,常会腐败变质而造成直接经济损失或者引发消费者健康问题,向食品中加入防腐剂是一种简单有效的方法[1]。随着生活水平的不断提高,人们对食品的安全、营养、保健性也提出了更高的要求,传统化学合成防腐剂的使用受到挑战或限制。因此具有抗菌性强、安全无毒、水溶性好、热稳定性好、作用范围广等特点的天然防腐剂的研究和开发成为食品科学的研究热点。食品天然防腐剂按其来源可分为三类,即植物源、微生物源和动物源。其中植物源食品天然防腐剂是在植物的根、茎、叶、花和果实等中提取出来的具有良好抗菌性能的液态或半固态混合物,在人体消化道内可降解,不影响消化道菌群的生长,同时还具有一定的营养、保健价值,即在发挥抗菌和食品保鲜作用的同时,还具有抗氧化、降血脂、降血压、预防肿瘤等防病保健的功能。同时我国植物资源丰富多样,药食两用资源及传统的调味料植物资源符合我国居民的饮食习惯,安全性相对化学合成防腐剂高,容易被消费者接受,可满足人们对天然食品、绿色食品、健康食品的需要,因此,开发安全、高效、经济、营养的植物源天然食品防腐剂是食品天然防腐保鲜领域的优先方向[2]。
我国是花生主要生产国之一,据统计,我国花生年产量超过1400万吨,按含壳量33%计算,每年大约有450吨的花生壳,花生除榨油外也逐渐被开发成一些调味品应用于食品中,花生壳是花生果加工食品、食用油脂的废弃物,除含有65.7%~79.3%的纤维素、木质素外,还含有少量的蛋白质、脂肪、多糖以及矿物质等营养成分;此外,还含有3.34%~7.13%的多酚类化合物[3],其中花生壳提取物的有效成分以木犀草素为主的黄酮类化合物,此类化合物在体内具有抗氧化性、增强免疫功能、降血脂、降胆固醇和抗炎症等药理作用[4]。
近十几年来,花生壳提取物在食品的抗氧化与抗菌活性方面得到了大量研究,显示其具有良好的抗氧化与抗菌活性。汪海峰等[5]对花生壳甲醇粗提取物成分进行分析,其中主要的黄酮类化合物木犀草素的含量达12.6%。陈春涛等[6]通过粗提、溶剂梯度萃取、配合抑菌活性跟踪检测,得到了抑菌活性较强、富含黄酮类的花生壳乙酸乙酯组分,并用酸碱沉淀、柱层析等方法纯化得到3种化合物。于亚莉[7]用花生壳多酚提取物(PPS)对脂肪酶进行体外抑制作用,其抑制率在0.29 mg/mL时可达41.5%,同时花生壳中多酚提取物对胰脂肪酶具有竞争性抑制作用。由于目前我国的花生壳大部分用作燃料,其余作为废渣被弃去,因此花生壳作为一种价廉、可再生的资源,是提取食品天然抗氧化剂和防腐剂的理想原料,具有广阔的应用前景[8],而且在果蔬保鲜,调味品、海鲜、熟食等食品的防腐抑菌方面对天然无毒的抑菌剂有着迫切的需求。然而,目前的研究只说明了花生壳提取物具有一定的抗氧化和抑菌能力,但对于其抗细菌作用差异性的研究较少,本文研究了花生壳乙醇提取物对食品中常见污染菌的抑制作用,并分析了其差异性。旨在为将其开发成高效、低毒的天然食品防腐剂提供依据,在调味品防腐抑菌方面,对天然抑菌剂和食品的保鲜等有重要的意义,使其更广泛地应用于食品领域中。
1 材料与方法
1.1 材料
花生壳:选取产自吉林省松原市的优质花生,手工剥壳并去除发黑、有虫洞的次品。将花生壳清洗沥干后置于50 ℃烘箱中烘干4 h,粉碎过40目筛,密封袋保存。
实验菌种:大肠杆菌(Escherichiacoli)、枯草芽孢杆菌(Bacillussubtilis)、金黄色葡萄球菌(Staphylococcusaureus),江苏省疾病预防控制中心微生物试剂厂。各菌种分别接入肉汤(LB)培养基,(36±1) ℃培养 24 h进行活化,用LB培养基调节菌液浓度为106~107cfu/mL作为原菌悬液,用生理盐水进行10倍梯度稀释,得到10-1、10-2、10-3、10-4、10-55个梯度的菌悬液,用于抗菌活性测定。
实验试剂:氯化钠(分析纯)、无水乙醇(99%),国药集团化学试剂有限公司;肉汤培养基(LB)、平板计数琼脂(PCA)、马铃薯葡萄糖琼脂(PDA):250 g,青岛高科园海博生物技术有限公司;去离子水:实验室自制。
1.2 仪器与设备
ZQTY-70S型低温摇床 上海知楚仪器有限公司;FW100型高速粉碎机 天津市泰斯特仪器有限公司;BSC-1300 Ⅱ A2型生物安全柜 上海博讯实业有限公司医疗设备厂;SHZ-D Ⅲ型循环水式真空泵 巩义市予华仪器有限责任公司;DHP型电热恒温培养箱 金坛市医疗仪器厂;101-34S型电热鼓风干燥箱 上海苏进仪器设备厂;LDZX-50FBS型立式高压蒸汽灭菌锅 上海申安医疗器械厂;RE-2000旋转蒸发仪 上海亚荣生化仪器厂;镀铬游标卡尺(0~150 mm) 桂林量具厂。
1.3 试验方法
1.3.1 花生壳乙醇提取物(EEPH)的制备(水浴回流法)
选择乙醇为有机溶剂结合回流法对花生壳粉进行提取,提取工艺:85 ℃水浴回流,70%乙醇,料液比1∶20,提取2次,每次1.5 h。合并滤液,旋蒸至浸膏状,用50%的乙醇溶液定容,得到花生壳乙醇提取液(EEPH)。按此操作分别制得0.2,0.4,0.8,1.6 g/mL的花生壳乙醇提取液(原料花生壳/定容体积,g/mL)备用。
1.3.2 平板计数法测定花生壳乙醇提取物的抑菌率
在无菌培养皿中加入1 mL上述不同浓度和菌种的菌悬液,在PCA培养基中加入相应体积的0.2 g/mL EEPH,使其体积分数分别为1.25%、2.5%、3.75%,倾注平板,混匀,以50%乙醇作为对照组,36 ℃恒温培养24 h后计数。
抑菌率的计算方法:

1.3.3 滤纸片法测定花生壳乙醇提取物的抑菌圈
将灭菌后直径为6 mm的滤纸片浸泡于不同EEPH浓度(0.2,0.4,0.8,1.6 g/mL)和50%乙醇(对照)中3 h,取出沥干。取0.1 mL不同浓度、不同菌种的菌悬液,均匀涂布于PCA平板上,将上述滤纸片3个为一组呈正三角形平铺皿中,36 ℃恒温培养24 h后,用游标卡尺采用十字交叉法测量抑菌圈直径。
1.3.4 花生壳乙醇提取物对实验菌生长曲线的影响
取10支无菌试管,按0,4,8,12,16,20,24,28,32,36 h编号,配制含0.4 g/mL EEPH的LB培养基,调整EEPH的体积分数为5%,每支试管加入9 mL,并加入1 mL不同菌种的原菌悬液,以不加花生壳乙醇提取液的LB培养基作为空白对照,36 ℃摇床培养,并按时将试管取出,4 ℃保存。对样品做适宜10倍稀释,平板计数法计数。
1.3.5 数据分析
2 结果与分析
2.1 基于平板计数法的花生壳乙醇提取物的抑菌率
EEPH 对实验菌种大肠杆菌、金黄色葡萄球菌和枯草芽孢杆菌的抑制率见表1。
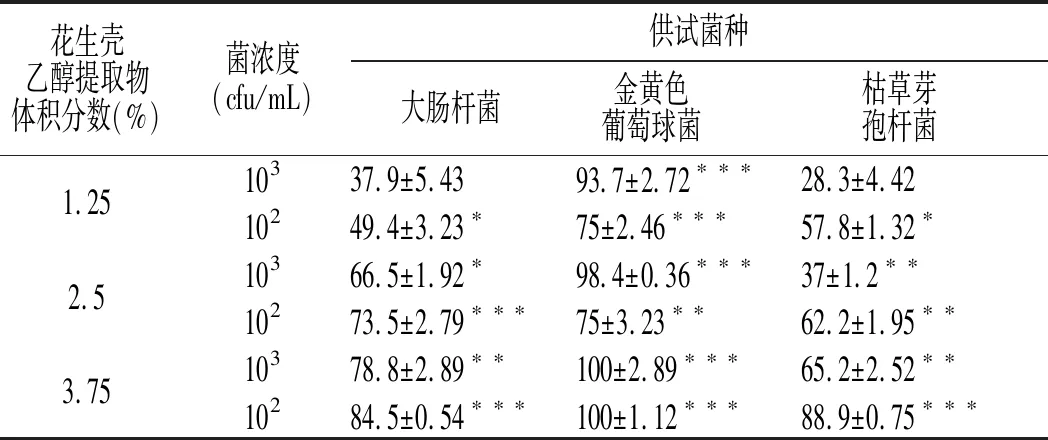
表1 不同体积分数的花生壳乙醇提取物 对不同浓度、不同菌种的抑菌率Table 1 Antibacterial rates of EEPH with different volume fractions for different strains with different content
注:与空白对照组比较,“*”表示P<0.05;“**”表示 P<0.01;“***”表示 P<0.001。
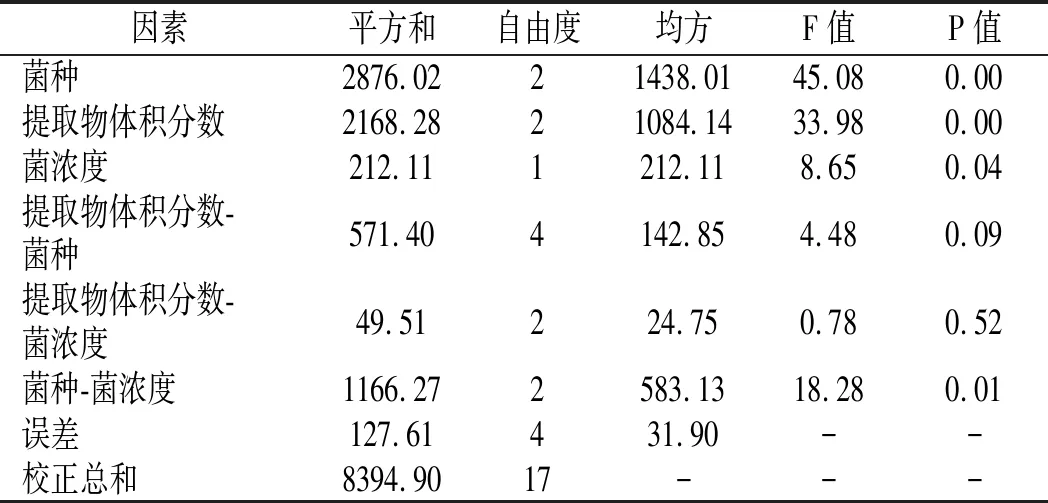
表2 方差分析Table 2 Analysis of variance
在相同提取物和实验菌浓度下,EEPH可显著抑制实验菌种的生长,金黄色葡萄球菌的抑制作用较强,最高可完全抑制,大肠杆菌次之,枯草芽孢杆菌较弱。通过SPSS 21.0软件进行方差分析(见表2),可知实际F(实验菌种)=45.08,F(提取物浓度)=33.98,F(菌浓度)=8.65,均大于查表所得的F值F0.05(2,4)=6.24,F0.05(1,4)=7.71。因此,实验菌种类与抑菌率具有显著性关系。当菌浓度一致时,其EEPH的体积分数与抑菌率之间呈正相关,其抑制效果与提取物存在一定的剂量效应。当提取物体积分数一定时,菌浓度与抑菌率之间同样具有显著性关系,对低浓度菌液的抑制较敏感。通过分析菌种、提取物的体积分数与菌浓度3个因素的交互作用,可知实际F(提取物体积分数-菌种)=4.48,F(提取物体积分数-菌浓度)=0.78,小于查表所得的F值F0.05(4,4)=6.39,F0.05(2,4)=6.24,实际F(菌种-菌浓度)=18.28,大于查表所得F值 F0.05(2,4)=6.24,表明菌种和菌悬液的交互作用与抑菌率之间存在显著性差异。
2.2 基于滤纸片法的花生壳乙醇提取物的抑菌圈
对于不同浓度花生壳乙醇提取液作用于不同菌种而形成的抑菌圈直径实验,统计结果见表3。EEPH对3个菌种均有抑制作用,在相同提取物和实验菌浓度下,其抑菌圈大小为:金黄色葡萄球菌>大肠杆菌>枯草芽孢杆菌,对金黄色葡萄球菌的抑制作用最大,抑菌圈可达到19 mm,其次为大肠杆菌,最后为枯草芽孢杆菌,抑菌效果同平板计数法相同。通过SPSS 21.0软件进行方差分析(见表4),可知实际F(实验菌种)=130.57,F(提取物浓度)=31.16,F(菌浓度)=18.80,均大于查表所得的F值F0.05(2,6)=5.14,F0.05(3,6)=4.76,F0.05(1,6)=5.99。因此,抑菌圈的大小与菌株的种类显著相关。当菌液浓度一致时,EEPH对抑菌圈直径随提取液浓度增加而增大,呈显著正相关。当提取物浓度一定时,抑菌圈大小随提取物浓度减小而增大,呈显著负相关。通过分析菌种、提取物浓度与菌浓度3个因素的交互作用,可知实际F(提取物浓度-菌种)=4.26,F(提取物浓度-菌浓度)=3.75,小于查表所得的F值F0.05(2,6)=5.14 ,F0.05(6,6)=4.28,实际F(菌种-菌浓度)=5.08,大于查表所得的F值F0.05(3,6)=4.76,表明菌种和菌浓度的交互作用与抑菌圈直径之间具有显著性差异,即与抑菌效果有显著关系。
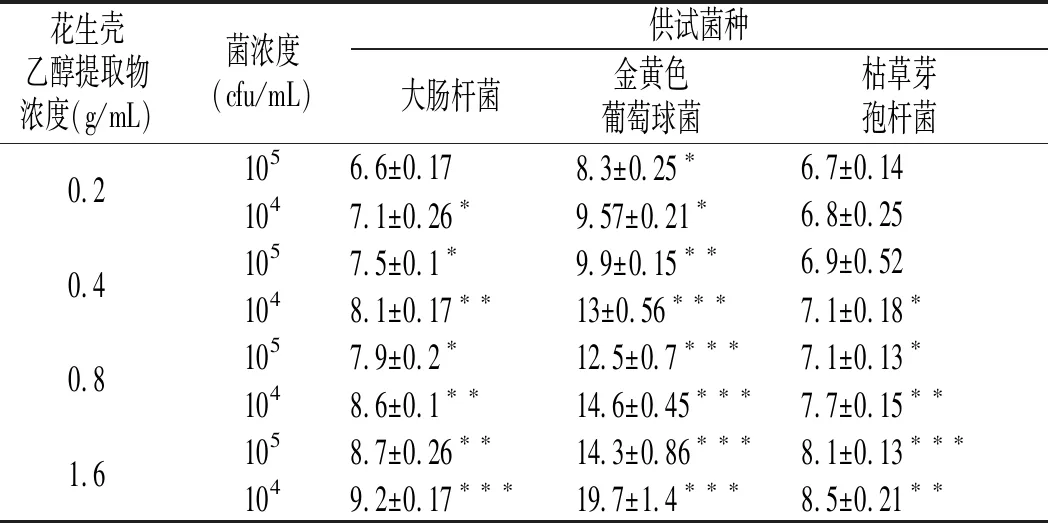
表3 花生壳乙醇提取物对不同浓度、不同菌种抑菌圈(mm)的影响Table 3 Effect of EEPH on inhibition zones(mm)of different strains with different content
注:与空白对照组比较,“*”表示P<0.05;“**”表示P<0.01;“***”表示P<0.001。

表4 方差分析Table 4 Analysis of variance
2.3 花生壳乙醇提取物对实验菌种生长曲线的影响
花生壳乙醇提取物对大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌生长曲线的抑制作用结果见图1。
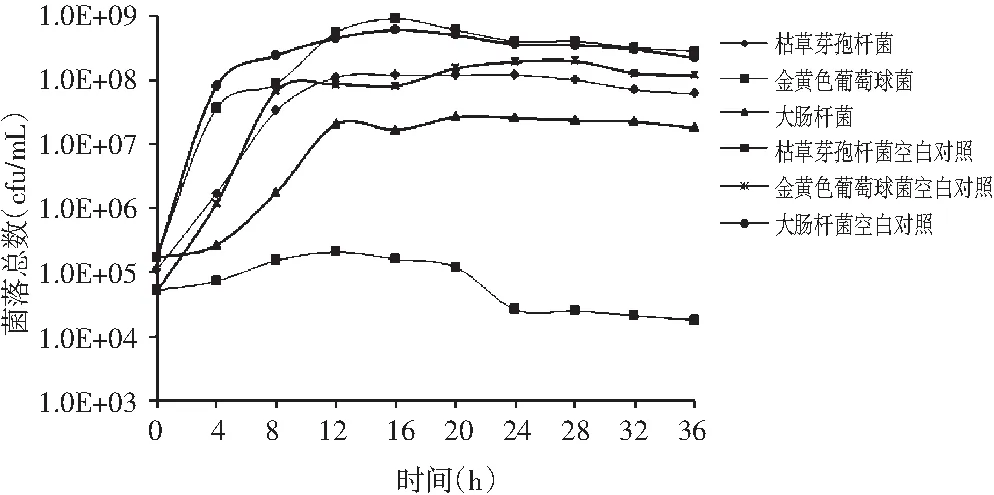
图1 花生壳乙醇提取物对不同菌种 生长曲线的影响Fig.1 Effect of EEPH on growth curve of different strains
对于大肠杆菌,不加EEPH的空白对照组,很快进入了对数生长期,供试菌大量繁殖,菌体个数迅速增长,在16 h时细菌增长缓慢,进入平稳期,而实验组在12 h时结束对数生长期,保持平稳生长,并在28 h时开始衰退。对于枯草芽孢杆菌,空白组在前期菌落生长迅速,于16 h时达到最大值,而实验组在12 h时进入稳定期,生长略有波动。对于金黄色葡萄球菌,实验组相比空白组抑制作用较明显,空白组在0~8 h有明显的对数生长期,菌落数最高可达1.89×108,而实验组未出现明显的对数生长期,并在20 h时开始衰退。总体而言,与空白组相比,实验菌实验组生长曲线变化明显,曲线趋势较平缓,对数期时间滞后于空白组,且对数期峰值较低。以上结果表明,EEPH可有效地缩短对数生长期,抑制菌体的生长,达到抑制作用。抑菌效果为金黄色葡萄球菌>大肠杆菌>枯草芽孢杆菌。
3 结论
通过平板计数法、滤纸片法和生长曲线法测定了花生壳乙醇提取物(EEPH)对金黄色葡萄球菌、大肠杆菌和枯草芽孢杆菌抗菌活性的差异性。结果表明,在相同EEPH和实验菌浓度下,比较抑菌率、抑菌圏和生长曲线对数生长期峰值,抗菌活性为金黄色葡萄球菌>大肠杆菌>枯草芽孢杆菌。对同一菌种的抑菌率或抑菌圈与EEPH和菌浓度呈显著的剂量效应,与EEPH浓度呈显著正相关,与菌浓度呈显著负相关。加入EEPH的生长曲线对数期时长滞后于对照组,实验中组可缩短为8~12 h,尤其是金黄色葡萄球菌,几乎完全抑制,且峰值显著降低,菌落数可下降2~3个数量级。进一步方差分析表明,菌种、EEPH浓度、菌浓度以及菌种和菌浓度2个因素的交互作用与其抑菌率或抑菌圈之间显著相关。
花生壳提取物的有效成分以木犀草素为主的黄酮类化合物[9]。黄酮类化合物对细菌的抑制效果明显,抗菌活性可能由于它们可以与细胞外可溶性蛋白、细胞膜形成复合物,许多亲脂类黄酮还可能破坏微生物的细胞膜[10]。对数生长期是细菌细胞分裂的主要时期,也是核酸、蛋白质合成的主要时期,因此,根据本研究结果可推测花生壳乙醇提取物对菌体的抑制作用可能是通过抑制菌体核酸或者蛋白的合成,从而抑制菌体的分裂和增殖[11]。本实验的结果不仅为花生壳作为天然抑菌防腐剂提供了理论支持,还有利于农产品废物的综合利用,减少了环境污染。

