光照条件下核黄素对宫颈癌细胞的毒性作用
王 飞, 许 青
复旦大学附属中山医院药剂科,上海 200032
光动力疗法是目前临床上较新的肿瘤治疗方法,对皮肤癌具有较好的疗效,但对实体肿瘤效果一般,主要原因为多数光敏剂存在对肿瘤靶体选择性低、能量利用率低、易受实体肿瘤乏氧环境影响且患者治疗后易受阳光伤害等缺点[1-2]。核黄素(riboflavin,RF)是构成生物氧化过程中所必须的黄素核苷酸(FMN)、黄素腺嘌啉二核苷酸(FAD)的主要活性基团,以自由态或共轭态广泛存在于人体各器官和各类水果中,对促进代谢、维持皮肤和视觉的正常功能具有一定作用[3]。核黄素作为一种内源性光敏剂,具有较高的系间窜越系数,易从短寿命的单重激发态转化为长寿命的三重激发态,且量子产额较高,从而能诱发一系列的光化学和光生物学反应[4]。
一系列研究[5-7]表明,在可见光和紫外线(UVA)照射下,核黄素可抑制癌细胞生长,导致上皮细胞凋亡。文献[8]认为,核黄素是导致肿瘤细胞损伤较为重要的内源性光敏剂之一,具有潜在的临床应用价值。因此,本研究采用噻唑蓝溴化四唑(MTT)法及荧光显微镜观察核黄素体外对宫颈癌细胞的光敏损伤作用,并初步探讨其可能的作用位点,为后续研究奠定基础。
1 材料与方法
1.1 主要试剂及仪器 细胞培养基RPMΙ-1640、胰蛋白酶、小牛血清、双抗均为Gibco公司产品;MTT、二甲亚砜(DMSO)购自Sigma公司;PBS缓冲液购自鼎国生物。细胞培养瓶、培养皿、96孔板、6孔板均为Greiner产品。酶标仪为Rayto产品;CO2培养箱购自一恒科技有限公司;洁净工作台为苏州净化设备厂产品;台式紫外灯购自巩义予华仪器有限公司;荧光显微镜为ZEISS公司产品。
1.2 细胞培养及计数 宫颈癌细胞培养于含10%新生牛血清的RPMI-1640培养基中,37℃、5%CO2饱和湿度培养。细胞于对数生长期时,经PBS缓冲液洗涤2次,而后用0.25%胰酶消化收集细胞,制成细胞悬液。吸取50 μL细胞悬液滴于血细胞计数板上,稳定后计数4个角大格内的细胞数。细胞数(个/mL)=4大格细胞数/4×稀释倍数×104。
1.3 MTT法测定正常及光敏状态下核黄素对宫颈癌细胞存活率的影响
1.3.1 正常状态下核黄素对宫颈癌细胞存活率的影响 收集对数生长期的宫颈癌细胞,用含10%新生牛血清的RPMI-1640培养基配成单细胞悬液(细胞密度约1×104个/mL),接种于96孔细胞培养板中,每孔体积100 μL,6个复孔,培养过夜。对照组加入培养基、给药组加入不同浓度的核黄素,置于5%CO2培养箱内,37℃培养48 h。每孔中加入10 μL MTT溶液于相同条件继续培养4 h。小心吸弃培养基,每孔加入DMSO 150 μL,震荡10 min,用酶标仪测定各孔的光密度值(D值),选用490~630 nm双波长系统,重复3次,计算各组细胞的存活率。细胞存活率=(实验组D值÷对照组D值)/%。
1.3.2 光敏状态下核黄素对宫颈癌细胞存活率的影响 将对数生长期的宫颈癌细胞配成细胞悬液(细胞密度约1×104个/mL),接种于96孔板,6复孔,培养过夜。每孔中加入10、50、100、150、200、250 μmol/L终浓度的核黄素,置于5%CO2培养箱内,37℃培养24 h。然后,光照组用24W紫外灯(中心波长365 nm)照射45 min,光照后采用培养基润洗2次,每孔中加入正常培养基100 μL、5%CO2培养箱内37℃培养2 h。MTT法检测细胞存活率。
1.4 荧光显微镜检测核黄素在细胞内的亚细胞定位 收集对数生长期的宫颈癌细胞,调整细胞密度为1×105个/mL,接种于20 mm×20 mm盖玻片,置于6孔细胞培养板中,培养48 h。用不同终浓度的核黄素溶液作用24 h,弃去培养液,PBS缓冲液冲洗3次,荧光显微镜(激发波长450 nm,发射波长520 nm)下观察其亚细胞定位、拍照。
1.5 不同作用条件下核黄素对宫颈癌细胞形态的影响 收集对数生长期的细胞,调整细胞密度为1×105个/mL,接种于20 mm×20 mm盖玻片,置于6孔细胞培养板中,培养24 h。加入无血清培养基配制的100 μmol/L的核黄素,在37℃、5% CO2培养箱中培养。其中,光照组予以光照,光源中心波长365 nm,光照时间45 min。培养24 h后移去培养基,PBS冲洗3遍,加入正常培养基,37℃、5% CO2培养箱中培养2 h。取出盖玻片,PBS冲洗3次,荧光显微镜下观察,拍照。
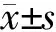
2 结 果
2.1 无光照条件下核黄素对宫颈癌细胞存活率的影响 结果(图1)表明:无光照条件下,与正常培养细胞相比,10、50、100、150、200、250 μmol/L核黄素孵育48 h后,宫颈癌细胞存活率无明显改变,未出现明显的细胞毒性,且核黄素在较低浓度范围内(10、50、150 μmol/L)对细胞的生长有一定促进作用。
2.2 光敏状态下核黄素对宫颈癌细胞存活率的影响 结果(图1)表明:光照45 min,不同浓度的核黄素孵育24 h后,宫颈癌细胞存活率明显降低,且宫颈癌细胞存活率随核黄素浓度的增加而降低,差异有统计学意义(P<0.05)。
2.3 核黄素在宫颈癌细胞内的亚细胞定位 结果(图2)表明:当浓度较低(25 μmol/L)时,核黄素主要集中在核膜上和细胞核内部,提示光敏损伤的主要位点是细胞核;当浓度较高(200 μmol/L)时,细胞膜上也有核黄素的分布。

图1 MTT法测定核黄素对宫颈癌细胞存活率的影响

图2 光敏条件下核黄素作用24 h后在宫颈癌细胞中的定位
A: 核黄素25 μmol/L;B: 核黄素200 μmol/L. Original magnification: ×400
2.4 光学显微镜观察不同条件下核黄素对宫颈癌细胞形态的影响 结果(图3)表明:单独核黄素和单独光照作用下,细胞形态变化不明显;核黄素+光照作用下,细胞形态发生了明显变化,同时从培养瓶壁大量脱落。
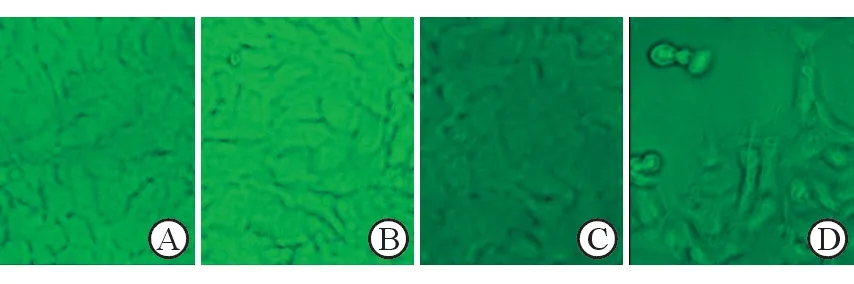
图3 不同条件下核黄素对宫颈癌细胞形态的影响
A:正常培养;B:单独365 nm紫外光照射;C:单独100 μmol/L核黄素;D: 100 μmol/L核黄素, 光照波长365 nm,光照时间45 min. Original magnification: ×200
3 讨 论
尽管目前光动力治疗肿瘤的研究已经取得一定成果,一系列光敏剂(血卟啉类混合物、红紫素、海棠素、紫菜碱等)已在临床得到应用,但该方法仍有很多局限[9-10]。多数光敏剂存在对肿瘤靶体选择性低、能量利用率低、易受实体肿瘤内乏氧环境的影响,且患者治疗后易受阳光伤害等缺点。本研究发现,光照条件下,核黄素孵育48 h后,宫颈癌细胞存活率明显降低,且随核黄素浓度的增加而降低,提示作为内源性光敏剂的核黄素可能在一定浓度范围内促进细胞新陈代谢。为了从根本上克服光动力疗法的弱点,有必要开拓有别于传统光动力疗法的新型光敏氧化疗法,即按照Ⅰ型反应机制选择氧化性强、能量利用率高、选择性好、治疗后患者不易受阳光伤害且不受乏氧环境影响的光敏剂。
荧光显微镜是生物学常用仪器,可以观察细胞内蛋白、DNA及其他生物大分子的位置、结构和状态。由于核黄素作为一种光敏剂,可被激发产生较强的荧光,利用这一特性,可以观察其在细胞中的亚细胞定位,并以此作为对光敏氧化作用机制进行准确判断的依据。亚细胞定位决定了光敏剂在细胞中发生作用的位置,不同的光敏剂对生物组织的损伤机制因其作用位点差异而不同[11-12]。本研究表明,核黄素在宫颈癌细胞内的分布因其浓度不同而有所差异,其中细胞核及细胞膜均可能是其光敏化细胞的作用位点,提示核黄素光敏损伤细胞基于一种综合的光敏氧化损伤机制。此外,光学显微镜观察发现,核黄素光敏损伤细胞形态的变化与其细胞存活率相似,即无光照时,核黄素对宫颈癌细胞的生长可能有促进作用,但在365 nm光照条件下对宫颈癌细胞有明显的杀伤效果。
综上所述,作为一种内源性光敏剂,核黄素自身对宫颈癌细胞无毒性,但在光敏状态下无需氧参与即能损伤细胞。本研究结果提示,核黄素有望成为应用于临床治疗宫颈癌的潜在光敏药物。

