微塑料的环境行为及其生态毒性研究进展
刘沙沙,付建平,郭楚玲,党 志
(1.肇庆学院环境与化学工程学院,广东 肇庆 526061;2.生态环境部华南环境科学研究所,广州 510655;3.华南理工大学环境与能源学院,广州 510006)
塑料及塑料制品在工业、农业和日常生活中被大量生产和使用,给人们带来了极大的便利,但大量的废弃塑料难以回收而对环境造成严重污染。近年来的研究发现,这种“白色污染”正以一种新的形式——微塑料威胁着生态和环境安全[1]。微塑料是指粒径<5 mm的塑料碎片或颗粒,种类较多,主要包括聚乙烯(PE)、聚丙烯(PP)、聚氯乙烯(PVC)、聚苯乙烯(PS)、聚酯(PEst)和聚对苯二甲酸(PET)类等[2];在形状上分为碎片、泡沫、颗粒、纤维和薄膜状等[3]。
微塑料污染已无处不在,在淡水、海洋和陆地环境中均存在大量的微塑料,从海滩到海底最深处(马里亚纳海沟),从城市到偏远地区(青藏高原湖区),从南极到北极[4-5]。另外,在食盐[6]、蜂蜜[7]、啤酒[8]等产品,家禽、海鲜[9]以及饮用水[10]中均检出了微塑料。微塑料的粒径较小、密度低,能够在强风、河流、洋流、潮汐等外力作用下发生迁移和转化。此外,微塑料还可以作为其他有毒污染物(PAHs、PBDEs和重金属等)的载体[11]。微塑料的大量赋存会对环境中的生物产生毒性效应,造成严重的生态风险,甚至通过食物链传递和富集[12-13],威胁人类的生存和健康。
微塑料的化学性质稳定,在环境中的存在具有持久性,可达数百至数千年[1],而且环境中微塑料的数量还在持续增加,微塑料污染已经成为全球关注的问题。国内外学者对微塑料的环境行为及其对生物的影响进行了广泛的总结,但是大部分的综述侧重在某一方面,且只关注单一环境介质,缺乏系统的归纳和分析。本文对不同环境介质中(水体、大气和陆地)微塑料的来源、迁移、分布特征及生态毒理效应进行了系统的总结,指出目前研究中存在的问题,展望了未来的研究方向,以期为微塑料污染的控制及生态风险评估提供理论依据。
1 微塑料的来源
环境中微塑料的来源比较复杂,可分为初生微塑料和次生微塑料两大类。初生微塑料的来源主要包括塑料/树脂颗粒的工业原料、含有微塑料颗粒或清洁微珠的工业化产品,例如药物、抛光料、个人护理品(化妆品、洗面奶、牙膏和沐浴露)等[14-15]。Gouin等[16]的调查发现,2012年在欧盟、挪威和瑞士的市场上,含有微塑料(球形颗粒、线状纤维)的皮肤清洁用品占到了6%,粒径范围为450~800 m,颜色以蓝色和白色为主[15,17]。欧洲化妆品协会进一步调查发现其中聚乙烯的比例最高(93%),其次为聚苯乙烯。由于其粒径小、密度低等原因不易从污水中分离去除,而随尾水排放进入到水环境中。Rochman等[18]的研究发现,在美国每日有8万亿个塑料微珠进入到水体中。
城镇、旅游、农业及工业区塑料垃圾的不当处置、船舶运输、水产养殖、捕鱼等过程会对水环境造成一定程度的塑料污染[19-20]。塑料进入水体后,经过物理(磨损、水体扰动、波浪击打、风力)、化学(紫外光辐射、冻融循环)和生物过程(降解)发生破裂、分解或体积减小而形成微小的塑料碎片,称为次生微塑料(图1)。在环境中,紫外光辐射是促使塑料破碎、分解的主要推动力,与海洋等大型水域相比,河流、湖泊等小型水域中的微塑料暴露于紫外线中的可能性更高[21],但缺乏海浪的冲击力,这在潮汐地带的海洋中尤为明显[22]。另外,塑料的紫外光降解效率在水体、沙滩表面相对高效,在深水域或沉积物中的效率较低[22],因此不同环境介质中微塑料的含量相差较大。此外,人工合成纤维纺织品洗涤过程中产生的塑料微粒纤维也是次生微塑料的重要来源,Hernandez等[23]在实验室模拟家用洗衣机清洗衣物的过程,发现洗衣机的排水中含有大量的纤维状塑料,且在使用洗涤剂的排水中纤维状塑料的含量(每克纺织品含有0.1 mg)明显高于未使用洗涤剂的排水(每克纺织品含有0.025 mg)。由此可见,水环境中微塑料的来源十分广泛,但是对于海洋、淡水环境中微塑料污染的主要来源及不同途径的贡献率还不明确,仍需做进一步的调查和研究。
陆地环境中的微塑料主要来源于农业活动(地膜和农膜使用)、污泥(化妆品、衣物及工业生产过程中的微塑料沉积)施用及堆肥、微塑料污染的灌溉水和大气沉降等过程[24-26]。据估算,进入到陆地环境的微塑料可能会超过40万t,这远高于海洋和淡水环境中微塑料含量的总和[24]。地膜和农膜的广泛应用成为农田中次生微塑料的主要来源之一,由垃圾填埋或其他表面沉积物产生的微粒和微纤维,可以通过大气沉降作用进入陆地环境[27]。德国海洋生物研究机构的研究人员发现,每千克干燥污泥中约含有2.4万个塑料微珠[28]。有研究指出,在最后一次污泥施用15年以后,土壤中仍能检测到微塑料纤维的存在,其含量明显超过了对照区域[29]。由于土壤生态系统复杂多变,对其中的微塑料进行分离和检测具有一定的难度,水生生态系统的研究模式也不适用于陆地环境,因此,关于陆地环境中微塑料的来源研究相对较少。
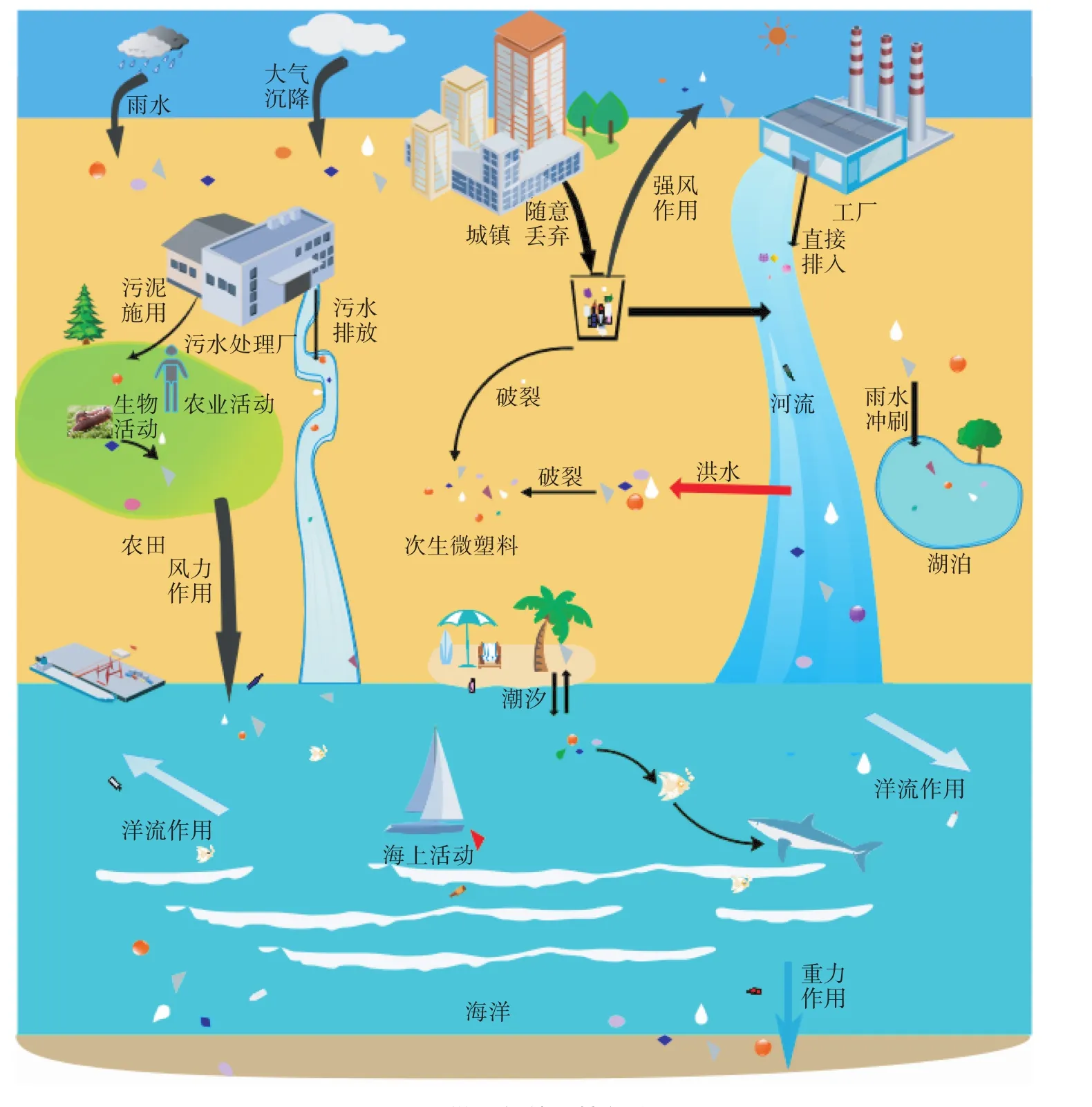
图1 微塑料的环境行为Figure 1 Behaviors of microplastics in the environment
工业粉尘的排放是大气中微塑料污染的来源之一[30],Dris等[31]研究者观察到法国巴黎大气中存在合成纤维、混合纤维和天然纤维等,推测室内空气微塑料(纤维类)污染可能是大气环境中微塑料的重要来源[32]。大气环境中的微塑料可能会通过沉降进入水体和陆地,有些研究报道了一些内陆偏远湖泊中微塑料的存在[4-5],这说明大气环境中微塑料通过输移和沉降成为海洋、湖泊和陆地微塑料的来源之一。例如,Dris等[33]发现法国巴黎城区及郊区大气沉降中含有纤维类微塑料,周倩等[34]在中国烟台市区大气降尘和降水中分离和鉴定到四种类型的微塑料(纤维类、碎片类、薄膜类和泡沫类)。目前,关于大气环境中微塑料的污染特征和沉降规律还不清楚,未来还需加强该方面的研究。
总体来看,环境中微塑料的来源与我们的生活密切相关。近年来,国内外关于淡水、大气及陆地环境中微塑料污染的研究逐渐增多,但是对于环境介质中微塑料的源解析工作还存在不足[35-36]。进入到环境中的大块微塑料破碎、分解的速度是无法估计的[37],对环境中的初生微塑料和次生微塑料进行定量化难以实现,这增加了对微塑料来源进行追溯的难度。此外,现有的微塑料提取、分离和鉴定方法没有统一的标准,更重要的是化学质量平衡法、同位素示踪、化学或生物指纹图谱等溯源技术还未广泛用于微塑料源解析的研究中。未来需要根据不同种类的微塑料特性建立与之匹配的监测分析方法,并结合准确高效的溯源分析技术,以解决目前环境介质中微塑料来源研究中的瓶颈和不足。
2 微塑料的迁移分布
2.1 微塑料在环境中的迁移
大部分的微塑料密度较小,会漂浮或悬浮在水体表面,在洋流、潮汐、风浪、海啸等外力的作用下进行迁移(图1)。例如,潮汐对微塑料在海岸带和海洋之间的迁移起到了重要作用,不仅能使海岸环境中的微塑料迁移至海水中,而且还能促使海水中的微塑料重新回岸。微塑料可以在不同环境介质之间进行迁移,风力和地表径流可以将微塑料从陆地转移至水环境。大气中的微塑料可通过雨水或沉降作用进入到水体和陆地环境中,而关于微塑料如何迁移至大气目前还处在研究阶段。陆地环境中的部分微塑料还会在重力和生物活动的作用下进入到深层土壤,而这部分微塑料也可能通过地下径流迁移至淡水系统。淡水环境被认为是陆地和海洋环境之间微塑料迁移的纽带,陆地上约80%的微塑料是通过河流进入到海洋环境中[38]。然而,在涨潮或发生洪水时会发生微塑料从海洋或河流向陆地的迁移。水体表面的微塑料能够在紫外辐射和高温的作用下发生分解[39],但是浑浊的水体会遮挡太阳光而不利于微塑料的光解。机械应力也会引起微塑料的分解,在经历持续的作用后微塑料变得易碎[40]。另外,密度较大的微塑料进入水体后会不断沉降,在沉积物中聚集。
微塑料的迁移过程受自身特征(密度、形状和大小)、天气(风、降雨)以及地形和水文(水位、流速)等因素的影响。Besseling等[41]指出由于微塑料的聚集沉积和斯托克斯沉降作用,中等大小的微塑料更容易从淡水环境迁移至海洋,而较小或较大的则容易滞留。然而,Lebreton等[42]的研究发现体积大的微塑料在水体中迁移的距离更远,可能是由于在这些研究中微塑料的种类和水体的类型不同引起的。在微塑料的迁移过程中,流速越快、河水越浅,越有利于已沉积的微塑料的迁移[21]。长期存在于环境中的微塑料因风化、侵蚀等作用不仅会使其进一步破裂,还会改变其形貌和表面特征,容易吸附有毒污染物,并且还会附着一些海藻、微生物和黏土颗粒等,从而增大了微塑料的密度,影响其迁移过程。
目前为止,关于微塑料在陆地环境中的迁移研究还存在欠缺。土壤表面聚集的微塑料可以在生物活动的作用下沿着土壤剖面迁移至深层土中,例如蚯蚓(Lumbricus terrestrisL.)[43]、跳虫(Folsomia candida和Proisoto maminuta)[44]、鼹鼠和植物(葡萄树、红树植物)等[45-46],且更容易到达地下水位较高的地方,纳米级的微塑料能够穿过土壤孔隙和粗质土[47]。Rillig等[43]在实地土壤中添加蚯蚓和750 mg聚乙烯塑料(粒径 范 围 为 710~850、1180~1400、1700~2000、2360~2800 μm)21 d后,土壤的中层和底层均发现了微塑料颗粒,而且粒径越小迁移到达的土层越深(710~850 μm),研究者认为可能是由于蚯蚓的摄取/排泄、挖洞和附着等活动引起的。
生物摄取在很大程度上也带来微塑料的迁移(图1),在不同的生物体内(浮游生物和贝类)都检测到了微塑料的存在,而关于微塑料在生物体内积累和生物放大过程的研究目前还较少。大部分微塑料由于粒径较大仅仅存在于胃肠道中,并在几个小时或者几天后被排出体外,这可能是引起已经沉淀的微塑料再次漂浮起来的重要途径[13,48]。但也有研究指出,一些较小的微塑料被生物体摄入后会在胃部、肝脏、消化管、消化上皮细胞、肠道腔、肝胰腺、卵巢、鳃瓣和血淋巴等部位积累,而且微塑料的排出也会变得缓慢[49]。在胃肠的蠕动和肠道津液和菌群的作用下,微塑料也可能在消化道内发生分解[6,50]。此外,微塑料在不同营养级水平中的转移与富集逐渐成为研究热点。一些研究结果证明微塑料可以随食物链发生迁移,例如,将预先摄取微塑料的桡足类或者多毛类浮游动物喂食糠虾之后,微塑料可在糠虾的肠道中积累[12]。Lwanga等[51]研究了微塑料在陆生食物链中的迁移(园土-蚯蚓-鸡),微塑料的浓度随着营养级的升高而增加,在鸡粪中浓度达到了最大值。此外,在鸡的砂囊中也检测到了一定浓度的微塑料,由于砂囊可作为人类的食物,这说明微塑料可能会随着食物链进入到人体。Zhu等[52]的研究发现,捕食者尖狭下盾螨(Hypoaspis aculeifer)和被捕食者跳虫(Folsomia candida)同时存在于土壤中与各自单独存在时相比,聚氯乙烯在土壤中的迁移距离更远,这说明微塑料的迁移与土壤中不同营养级的生物密切相关。
2.2 微塑料在环境中的分布
近年来,关于微塑料赋存与分布的研究主要集中在海洋环境。由于海水的流动性和无国界,微塑料已遍布全球各处的海域,包括南极和北极地区、海岛、大陆架、深海区域及大洋底部等。但是微塑料浓度的计量单位不一致,包含个数和质量两种表述,目前文献报道的单位有个·m-3、个·m-2、g·km-2和g·m-3等,这造成了不同研究结果的可比性不高。但是从整体来看,海洋表层微塑料的含量高于下层及深海区域,并容易在沉积物中和海岸带积累;在工业污染源、人类居住区附近海域的微塑料污染比较严重。微塑料进入到海洋后,在大气运动和大气洋流的作用下会向环流区域聚集,形成微塑料的高污染区,引起微塑料空间分布的不均匀。依据现有资料,全球海洋范围内存在五大塑料聚集的“垃圾带”,其中,北太平洋和北大西洋都是微塑料污染的“热点”区域。而在封闭或者半封闭的海域,例如地中海、加勒比海[53],也易于形成环流污染区。在微塑料的粒径分布方面,0.5~1 mm范围的微塑料较多,也有一些海岸带以小于50 m的为主。沉积物中的微塑料大多小于1 mm,有的甚至在几十微米,例如在新加坡红树林湿地中,微塑料的粒径范围主要在20 m以下[54]。近年来,微塑料在海洋环境中分布的调查研究越来越多,应加强对不同类型的微塑料的数量及深海水域和沉积物中微塑料赋存特征的研究。
目前,淡水环境的微塑料污染主要分布在欧洲(莱茵河、多瑙河)、北美(五大湖、圣劳伦斯河)和中国部分地区(太湖、长江、珠江)[55]。另外,在巴西[56]、蒙古[57]、印度[58]及南非[59]等国家的淡水系统也检出了微塑料。与海洋环境相比,淡水环境更容易受到人类活动的影响,其周边的人口密度、城镇化水平、经济产业结构和垃圾处置状况是影响微塑料污染状况的重要因素。此外,水文情况、气象气候条件[60]和季节变化[61]等也会影响微塑料的分布,美国洛杉矶河水中微塑料的丰度在雨季时要大于旱季,水体表面的含量大于底部[62]。总体上看,在人口密集地区微塑料的分布浓度相对较高,但在人迹罕至的偏远地区也检测到一定浓度的微塑料,例如蒙古国北部的库苏古尔湖、青藏高原内陆湖、西藏北部西陵盆地湖泊等,可能因为这些湖泊大部分是封闭式水系,微塑料一旦进入会长时间停留并积累,从而造成了污染。值得注意的是,我国淡水环境中微塑料的浓度高于其他国家和地区[55,60],近年来学者们对淡水环境中微塑料污染的研究越来越重视,但相关研究主要集中在污染较严重的长江中下游地区。另外,除了对珠江流域的微塑料检出进行了报道外[63],在其他主要水系(黄河、辽河和松花江等)的污染调查和监测还没有开展。
目前的很多研究指出微塑料也广泛存在于陆地环境中,但是土壤中微塑料的提取和分离难度较大,关于陆地环境中微塑料分布特征的研究还十分欠缺。在墨西哥,微塑料对40%~60%的家庭花园表层土壤造成了污染[25]。Zhang等[64]对我国云南滇池附近耕地土壤中微塑料丰度和分布情况进行了调查研究,与已报道的水体和沉积物中微塑料相比,该地区土壤中微塑料的丰度明显要高,微塑料的浓度为7100~42 960个·kg-1土,粒径范围为0.05~1 mm。纤维状微塑料的比例(92%)最高,其余为碎片状和薄膜状,72%的微塑料处于与土壤团粒紧密结合的状态,还有一些分散存在。同样,对于分布在大气中的微塑料的报道也寥寥无几,Cai等[30]对东莞城区大气中的微塑料进行了调查,聚乙烯、聚苯乙烯和聚丙烯微塑料分布在该地区的大气中,其中纤维类为主要的类型,大气沉降物中微塑料的浓度范围为 175~313个·m-2·d-1。Dris等[32]的研究发现室内(私人公寓、办公室)空气中纤维类微塑料的浓度为0.4~59.4个·m-3,沉降速度为1586~11 130个·m-2·d-1,降尘中的含量为 190~670个·mg-1。Dris等[31]还对法国巴黎人口聚集地区(2500 km2)每年大气中沉降的纤维类微塑料的量进行了估算,约为3~10 t。尽快建立简单、高效的土壤和大气中微塑料的提取和分离方法,开展陆地和大气环境中微塑料的调查工作是十分必要的。
3 微塑料的生态毒理效应
微塑料的生态毒性研究主要集中在微型和小型生物方面,而对动物和人类的影响研究较少。纤维类和薄膜类的微塑料容易缠绕生物体,限制其行动甚至导致死亡。大部分的微塑料能够直接被生物摄取而产生物理损伤,堵塞或磨损摄食器官和消化道,降低摄食率,锋利的微塑料还会对鳃或肠道组织造成损伤(图2)。例如,紫贻贝(Mytilus edulis)和食草蟹(Carcinus maenas)分别可以通过鳃呼吸摄入聚乙烯(<80 μm)和聚苯乙烯微球(10 μm),进入体内的微塑料能够损伤肠道[65-66]。聚苯乙烯可以通过静电作用吸附在初级生产者(藻类、浮游生物和硝化细菌)的表面,阻碍了光照和空气流动而影响生物体的光合作用和呼吸速率,导致其生长受到抑制[67]。此外,微塑料被生物体作为食物吞食后,会引起错误的饱食感,减少了对食物的摄取并作用于消化过程,导致能量缺失,生长和繁殖能力减弱,最终使生物体处于饥饿状态并死亡[68](表1)。
目前微塑料对水生生物毒性效应的研究大多以短期暴露实验为主,用于评价毒性效应的指标主要包括行为、摄食率、生长情况、产卵量、氧化应激、炎症反应和生物酶活性等亚致死效应以及死亡率(图2)。这些不同的效应之间是相互关联的,例如Lee等[69]的研究发现日本虎斑猛水蚤(Tigriopus japonicus)误将聚苯乙烯微球作为食物摄取,会引起所需能量的减少,从而引发一系列的生理功能异常,包括繁殖能力下降、生长迟缓甚至死亡等。Goldstein等[70]通过长期观察和研究发现北太平洋丝海黾(Halobates sericeus)的产卵密度与微塑料含量正相关,这可能是由于微塑料能够为丝海黾提供更多新的产卵载体,因而会对整个生物群落组成和结构造成潜在的影响。微塑料的毒性与其大小、种类、形状和暴露剂量密切相关,大部分的微塑料被摄入后仅在肠道中停留,容易随粪便排出[71]。Goldstein等[72]发现生活在水面表层的鹅颈藤壶(Lepassp.)体内的微塑料(聚乙烯、聚苯乙烯、聚丙烯)主要集中在肠道部位,Cole等[73]在桡足类浮游生物Centropages typicus的肠道中也检测到大量的聚苯乙烯微珠。
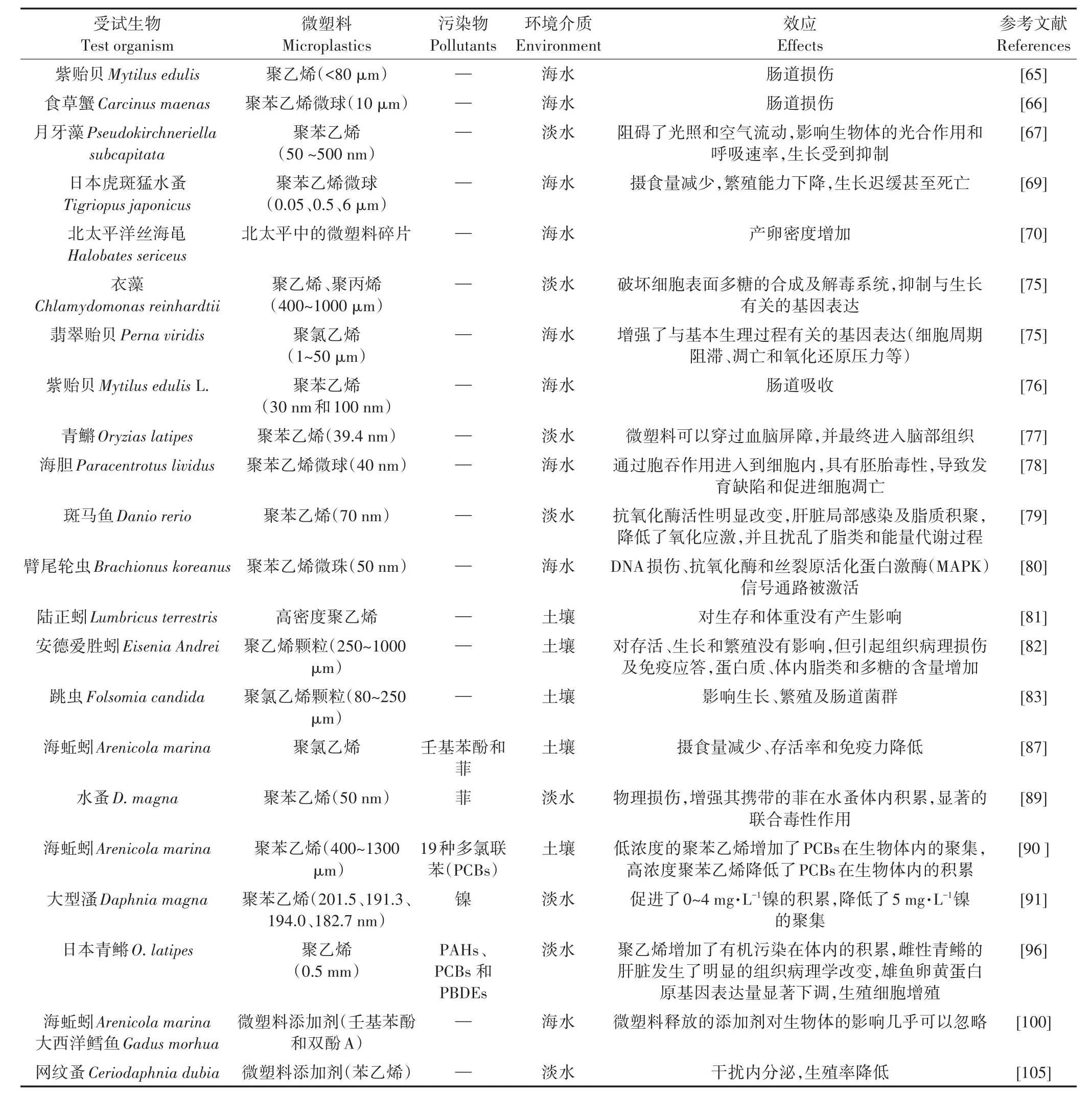
表1 微塑料对生物的毒性效应Table 1 Toxic effect of microplastics on organisms

图2 微塑料对生物的毒性效应Figure 2 Toxic effects of microplastics on organisms
然而,粒径较小的微塑料一旦进入生物体内会长期滞留,并穿过细胞膜进入到周边组织和循环系统,产生细胞及分子层面的毒性效应[74]。聚乙烯和聚丙烯能够破坏衣藻(Chlamydomonas reinhardtii)细胞表面多糖的合成及解毒系统,抑制了与生长有关的基因表达。聚氯乙烯增强了参与翡翠贻贝(Perna viridis)基本生理过程的基因表达(细胞周期阻滞、凋亡和氧化还原压力等)[75]。当微塑料的尺寸降至纳米级,其对生物体的入侵能力和毒性进一步增强。紫贻贝(Mytilus edulis L.)可通过肠道摄取30 nm和100 nm的聚苯乙烯颗粒[76]。在青鱂(Oryzias latipes)成鱼的大脑、睾丸、肝脏和血液中检测到了聚苯乙烯(39.4 nm),这说明了纳米级的微塑料可以穿过血脑屏障,并最终进入脑部组织[77]。Della等[78]研究发现表面带负电的纳米级聚苯乙烯微球(40 nm)容易在海胆(Paracentrotus lividus)胚胎的消化道内聚集,可以通过胞吞作用进入到细胞内;而表面带正电的微球表现出更为明显的胚胎毒性,导致发育缺陷和促进细胞凋亡。Lu等[79]的研究发现,在聚苯乙烯(70 nm)作用下斑马鱼的抗氧化酶活性发生了明显的改变,引起了肝脏的局部感染及脂质积聚,降低了氧化应激,并且扰乱了脂类和能量代谢过程。此外,聚苯乙烯微珠(50 nm)还会引发臂尾轮虫(Brachionus koreanus)体内DNA损伤、抗氧化酶和丝裂原活化蛋白激酶(MAPK)信号通路被激活等[80]。鉴于纳米粒子与纳米级微塑料具有一定的相似之处,因此,将已有的检测方法和风险评价用于纳米微塑料颗粒的研究,有助于全面了解纳米微塑料的特性、分布及对环境和生物的影响。
微塑料对陆生生物的毒性作用研究还存在欠缺,目前关注的主要为土壤动物,例如蚯蚓、线虫和弹尾虫[27]。Lwanga等[51]将陆正蚓(Lumbricus terrestris)暴露在低密度聚乙烯(<150 mm)中60 d,结果表明微塑料会对蚯蚓的健康状况产生影响,还会在蚯蚓体内聚积并随着食物链转移至土壤中其他生物体内,或者迁移进入到更深层,甚至到地下水中。但是,有的研究发现高密度聚乙烯对陆正蚓(Lumbricus terrestris)的生存和体重没有影响,蚯蚓对其也没有摄取或者排斥的倾向[81]。这可能是因为在这些研究中微塑料的性质、大小和暴露浓度不同引起的。Rodriguez-Seijo[82]的研究也指出聚乙烯颗粒(250~1000 μm)对安德爱胜蚓(Eisenia Andrei)的存活、生长和繁殖没有影响,但引起其组织病理损伤及免疫应答,且在肠和中肠道内发现了微塑料的存在。此外,傅里叶红外光谱(FTIRATR)分析发现蚯蚓体内的蛋白质、脂类和多糖的含量增加,这可能是安德爱胜蚓应对微塑料污染胁迫的机理之一。Zhu等[83]的研究发现聚氯乙烯颗粒(80~250 μm)能够对土壤跳虫(Folsomia candida)的生长、繁殖及肠道菌群产生影响。微塑料及携带的有毒污染物进入土壤后,可能还会引起土壤微生物(微生物生物量和活性、群落结构和多样性、代谢功能等)及其生态过程(土壤呼吸强度和酶活性)的变化,但是目前还没有微塑料对土壤微生物影响的报道。
环境中微塑料具有较大的比表面积,可作为有毒污染物的载体,微塑料与污染物形成的复合污染已经成为研究其生态毒理效应的关键问题。目前有关微塑料复合污染的研究刚刚起步,主要集中在与多环芳烃(PAHs)、多氯联苯(PCBs)、多溴联苯醚(PBDEs)和重金属(HMs)等常见污染物对生物的联合效应[84]。值得注意的是,近年来已有研究指出微塑料(聚丙烯、聚氯乙烯、聚乙烯)能够吸附水体中的全氟化合物(PFOS、FOSA)、药物及个人护理品(PPCPs)等新型污染物[85-86],并影响这些污染物的迁移、转化和生态毒理效应(图2)[11]。Browne等[87]研究发现聚氯乙烯能够携带壬基苯酚和菲进入到海蚯蚓(Arenicola marina)体内,导致其摄食量减少、存活率和免疫力降低等毒害效应。这说明疏水性有机污染物能在微塑料表面聚集,并可以通过微塑料摄取而进入到生物体内产生毒性效应。然而,关于微塑料作为载体对生物体摄取有机物的贡献率还不明确,进入到生物体内的微塑料大多数情况下会被排出,因此确定微塑料在肠道中的解吸速率是十分必要的。Koelmans等[88]利用生物动力学模型研究了微塑料对PCB的吸附/解吸过程,聚苯乙烯对PCB在海蚯蚓肠道内的聚集没有影响,而聚乙烯降低了PCB的积累,可能是因为PCB再次吸附在微塑料表面而减弱了生物积累作用,这说明微塑料对有毒化学物质在生物体内的积累没有很大的相关性。Ma等[89]利用同位素标记法研究了5种不同尺寸的聚苯乙烯与菲的联合毒性效应,发现聚苯乙烯与菲的联合毒性与聚苯乙烯颗粒本身的尺寸有较大的关系,纳米级的聚苯乙烯(50 nm)对水蚤(D.magna)的物理损伤和毒性作用最大,而且能够增强其携带的菲在水蚤体内积累,呈现出显著的联合毒性作用。Besseling等[90]把海蚯蚓(Arenicola marina)暴露于含有19种多氯联苯(PCBs)污染物和聚苯乙烯的土壤中,研究发现当聚苯乙烯的浓度较低时(0.007 4%),PCBs在生物体内的聚集量升高1.1~3.6倍,而当聚苯乙烯的浓度升到较高的程度时,PCBs的聚集量反而会有轻微的下降。聚苯乙烯增强了镍(0~4 mg·L-1)在大型溞(Daphnia magna)体内的积累,但当镍的浓度为5 mg·L-1时,聚苯乙烯降低了镍的聚集[91]。
初生微塑料或次生微塑料进入环境后,其存留时间越长,毒性效应越显著。因风化、光照、侵蚀等作用,长期存在于环境中的微塑料会进一步的碎片化,而且其表面形貌、结构及性质都会发生显著变化,由此可能改变微塑料对共存环境中有害污染物及生物体的吸附作用,影响其在环境中的归趋和生态效应[27,92]。Turner等[93]研究了聚乙烯微塑料对重金属离子(Ag、Cd、Co、Cr、Cu、Hg、Ni、Pb和 Zn)的吸附性能,吸附动力学实验表明,在河水中老化的聚乙烯的吸附效率要大于原始的聚乙烯,可能是因为老化的聚乙烯表面结构发生改变,更容易获得电荷达到表面电荷平衡。Holmes等[94]研究发现海水中老化的聚乙烯对重金属(Cd、Co、Ni、Cr、Cu和Pb)的吸附能力也强于原始的聚乙烯。Frias等[95]发现葡萄牙海岸沙滩中黑色老化的微塑料吸附PAHs和PCBs的浓度都较高。Rochman等[96]以日本青鳉(O.latipes)为受试对象进行了两个月的毒理实验,海水中老化的聚乙烯(3个月)+食物组生物体内PAHs、PCBs和PBDEs的含量要比对照组(只添加食物)和原始的聚乙烯+食物组高。海水中聚乙烯喂食的雌性日本青鳉的肝脏发生了明显的组织病理学改变,编码卵黄蛋白原、雌激素受体α基因的表达略微低于原始的聚乙烯组,显著低于对照组。老化的聚乙烯处理的雄鱼卵黄蛋白原基因表达量显著下调,并产生生殖细胞增殖的现象。
综上所述,当微塑料与污染物共存时,其是否促进了污染物在生物体内富集及改变污染物的毒性效应是一个极其复杂的问题。这可能是由很多不确定的因素引起的,包括污染物和微塑料的性质,污染物在微塑料表面的吸附/解吸能力,污染物在微塑料和生物体之间的逸度梯度[97],生物体的摄取速率及在肠道中的停留时间等。此外,目前的研究是在实验室模拟条件下进行的,将生物体或微塑料作为固定的因素且分类较为单一,暴露时间短,剂量高于环境中的浓度。然而,实际的环境介质-微塑料-微生物生态体系复杂多变,而且是长期积累的效应,这就增加了微塑料对生物体毒性效应研究的难度。目前,单一的分析手段已经难以满足研究的需求,在未来的研究中应加强微塑料分离/检测技术、微观结构分析方法、环境微生物学及分子生物新技术的联合。例如,在选择实际环境中同一地区未污染为对照、微塑料污染和有毒物质污染的实验区域生物的基础上,通过综合运用Micro-FTIR、Pyr-GC-MS、指纹图谱和SEM-EDS来确定生物体内的微塑料及污染物的浓度和性质,结合同位素示踪、转录组学和蛋白组学等技术探讨微塑料在复合作用过程中所扮演的角色,以期能够区分微塑料本身及其携带的污染物对生物体的单独或复合毒性效应。
此外,为了满足不同的应用需要,在塑料生产过程中会添加增塑剂(邻苯二甲酸酯)、防火剂(双酚A、多溴联苯醚)、抗菌剂和染料等化学组分。Andrady等[98]对海洋中的微塑料调查发现,聚乙烯和聚丙烯没有任何残留单体,但是聚苯乙烯含有质量分数为0.1%~0.6%的苯乙烯单体和低聚物。这些添加剂在微塑料的风化过程中浸出,并且会随着微塑料迁移并释放出来,对环境和生物造成危害(图2)[99]。聚苯乙烯和高密度聚乙烯中的壬基苯酚释放进入水体后,其在水中的半衰期为4~5 d[100]。陆地环境中也有大量的增塑剂被检出,Wang等[101]对中国南京种植蔬菜的土壤中的邻苯二甲酸酯化合物(PAEs)进行了分析检测,总PAEs的浓度范围为0.15~9.68 mg·kg-1,高浓度的检出点主要集中在塑料大棚和薄膜使用的地方。Kong等[102]检测了中国天津城郊不同类型土壤中的6种PAEs的浓度,依次为蔬菜地>废弃土壤>农田>果园,废弃土壤中PAEs的主要来源为固体废弃物,其他土壤中的PAEs主要来自于污泥中的化妆品、个人护理品和塑化剂,农用地膜的使用也会增加土壤PAEs的含量。
微塑料中的添加剂能够干扰神经系统,影响动物的繁殖,诱发遗传畸变,甚至对人体的内分泌功能、生殖发育产生不良影响。但不同种类微塑料释放的添加剂差别较大,因此其毒性影响也非常复杂。增塑剂对大型溞的毒性效应已经被证实[103],邻苯二甲酸酯类浓度很低时(ng·L-1),也会对生物体产生毒性,尤其是贝壳类、两栖动物类和甲壳纲动物[104]。此外,微塑料在分解过程中易释放聚合物单体(苯乙烯),对网纹蚤(Ceriodaphnia dubia)的内分泌产生干扰效应,例如降低繁殖率等[105]。添加剂的释放速度与微塑料的理化性质、所在介质以及温度等有关。老化的或者脆性微塑料释放添加剂的速度较快,另外,由于生物体的胃肠道溶液中溶解性有机物和生物表面活性物质(糖、醋酸)的浓度较高,有利于添加剂从微塑料上解吸出来[100]。但是微塑料被生物摄取后,具体是哪种添加剂在体内释放以及每种添加剂的毒性作用,目前还不清楚。通过化学成分检测对在生物体内释放的添加剂进行定性和定量分析,确定其生态毒理效应,这是未来需要进一步解决的问题。Koelmans等[100]利用生物动力学模型的分析结果表明,海蚯蚓(Arenicola marina)摄取微塑料后,壬基苯酚和双酚A的释放浓度低于全球的浓度限值,而这两种添加剂对大西洋鳕鱼(Gadus morhua)的影响几乎可以忽略,这说明添加剂的释放及其毒性效应可能与生物种类相关。此外,当生物体摄取携带其他有毒污染物的微塑料进入体内,污染物与添加剂发生相互作用,污染物可能会影响添加剂的释放,添加剂也会对污染物在生物体的积累产生影响,或者两者的毒性作用处于平衡状态,这些都应是未来研究关注的重点。
微塑料的食物链迁移已被报道,其能够从低营养级向高营养级传递,从而导致食物链紊乱和生态位失衡[106]。但微塑料在食物链中的累积效应、是否具有生物放大效应,以及微塑料是否会沿着食物链进入人体并产生潜在的危害尚缺乏深入的研究。相关研究指出当微塑料的尺寸较小时,能够产生更为显著的生物效应。纳米级聚苯乙烯(24 nm)被证实可以沿着斜生栅藻-大型蚤-鲫鱼的水生食物链发生迁移,并影响鲫鱼的脂质代谢和行为活动[107]。目前还没有足够的数据证明微塑料可以通过皮肤暴露途径对人体造成直接危害,但人类却可能通过饮食使其在体内积累,例如,人类会食用体内积累了微塑料的鱼类和海产品[108]。2.4%的人类食用的大西洋鳕鱼(Gadus morhua)体内含有微塑料[109],马鲛鱼(Scomberomorus cavalla)和巴西鲨鱼(Rhizoprionodon lalandii)体内平均含有2~6个微塑料颗粒[110]。美国化学学会研究人员认为,摄入塑料微珠的鱼类被人类食用后,塑料微珠会引发人体细胞坏死、炎症和组织裂伤等症状[18]。微塑料在生物体内的聚集和毒性对人类身体健康的潜在威胁,这应是将来重点关注的研究领域。
4 结论与展望
微塑料在全球环境中的广泛分布和累积,已经引起了人们对其来源、迁移分布及生态毒理效应等方面的关注。但是由于环境中的大块塑料在环境外力作用下会不断破裂和降解为粒径更小的微塑料,对于进入到环境中的微塑料的大小、数量和形状等还不确定,以及相关研究方法和分类标准的不完善,导致微塑料环境行为的研究缺乏一致性。微塑料具有特殊的理化特征,并可以通过不同方式与有毒污染物结合形成复合污染,其对环境及生物体的毒性效应、生物积累和食物链传递过程仍缺乏系统的分析和总结。从研究现状来看,未来需在以下几个方面开展进一步的研究:
(1)建立统一的微塑料样品采集和分类标准、分离和鉴定方法,规范微塑料丰度/浓度的表示方法,将同位素示踪、指纹图谱等溯源技术应用于微塑料的源解析研究中。加强全球范围内的国际合作,系统地开展环境介质中(大气、水体和土壤)微塑料污染的调查及生命周期研究,阐明微塑料的分布特征及在不同环境中的交互作用,揭示其环境行为与归趋。
(2)在分析微塑料的化学组分和特性的基础上,确定微塑料对生物体的毒性作用是由于摄取了微塑料后引起的物理损伤,还是其自身释放的有害物质造成的,掌握微塑料的物理化学特性与其毒性效应之间的关系;微塑料可以作为有毒污染物的载体而改变其原有的毒性效应,研究微塑料与污染物的相互作用机制及对生物体的复合毒性效应,探讨微塑料在复合效应中所起的作用。
(3)微塑料的毒性实验大部分是在实验室内进行的,研究对象单一、暴露时间短且剂量高于环境浓度,需要结合实际环境的特点对其毒性效应进行综合评价;将基因组学、蛋白组学和代谢组学等分子生物学新技术应用到微塑料毒性效应的研究中,深入研究微塑料及复合污染对环境中生物的致毒机理,以及对生物多样性、群落结构和生态系统功能的影响,为环境中微塑料基准值的判定及标准制定提供基础数据。
(4)在明确微塑料的生态毒性过程和机理的基础上,结合同位素示踪法,重点研究微塑料在食物链中的传递规律和效应,为预防和控制微塑料对生态环境及人类健康的影响提供理论依据。确定微塑料及吸附的污染物对人体的暴露途径,深入系统地探索微塑料对人类的潜在健康风险,这也将是今后亟需研究的问题之一,对环境中微塑料生态风险评估标准的制定具有重要意义。

