锡膜修饰玻碳电极测定药品中铋的含量
李新华,岳志劲,李卫华,刘永文*
(山西大同大学化学与环境工程学院,山西大同037009)
1984年R.W.Murray[1]首次提出了化学修饰电极这个概念。化学修饰电极是为了在电极表面形成指定作用膜[2],用化学或物理修饰使电极具有一些指定的性质[3],更高选择性地完成实验[4]。化学修饰电极是一种比较理想的定量分析体系,较普通电极有许多优点,比如良好的化学稳定性,试剂用量少,制备简洁等。具体来讲就是把分离、富集和测定集于一体。这使得化学修饰电极成为电分析化学研究的一个热点专题。可以用电化学聚合法[5]、吸附法[6]、共价键键合法[7]、电化学沉积法[8]等方法制作化学修饰电极。电化学沉积法是最常用到的方法之一。常见的电化学沉积法制成的修饰电极有汞膜电极[9]、铋膜电极[10-12]、锑膜电极[13]。但是汞是重金属,汞膜有毒性,铋膜也有较小的毒性,对环境会造成危害。锡膜电极类似于铋膜电极,能对一些金属具有明显催化作用。同时Sn材料比Bi材料更便宜,更环保。因此,采用锡作为电极修饰材料测定胃铋治药品中Bi(III)的含量,回收率达到98.48%,得到满意结果,说明该方法可用于药物中Bi(III)含量的测定。
1 实验部分
1.1 仪器与试剂
CHI660E电化学工作站(上海辰华仪器有限公司),CLJ2000磁力搅拌器(天津市兰力科化学电子高科技有限公司),FA22048电子天平(上海精科天美科学仪器有限公司),PHS-3C型精密酸度计(上海大普仪器有限公司),KQ5200DE型数控超声波清洗器(昆山市超声仪器有限公司);以玻碳电极为工作电极,铂电极为辅助电极,饱和甘汞电极为参比电极的三电极系统。
1.0×1 0-2mol/L Bi3+标准溶液:准确称取0.490 0 g Bi(NO3)3,置于50 mL烧杯中,加入6.0 mol/L HNO3溶液50 mL进行溶解。完全溶解后转移至100 mL容量瓶中,继续用6.0 mol/L HNO3定容至刻度线;6.0 mol/L HNO3溶液,0.50 mol/L H2SO4溶液,1.0 mol/L HC1溶液;1.0×10-2mol/L SnCl2溶液:称取0.230 2 g SnC12,置于50 mL烧杯中,加入1.0 mol/L HCl溶液50 mL进行溶解。完全溶解后转移至100 mL容量瓶中,继续用1.0 mol/L HCl定容至刻度线;所用试剂均为分析纯;所用水均为去离子水。
1.2 仪器操作参数
脉冲振幅0.040 V,脉冲宽度0.050 s,脉冲周期0.20 s,电位增量0.007 0 V,富集电位为-0.90 V,富集150 s,初始电位-0.80 V,终止电位0.20 V。
1.3 实验方法
在10 mL比色管中依次加入1.0 mL 1.0×10-3mol/L的Sn2+溶液,1.0 mL Bi3+的待测液,用0.10 mol/L H2SO4加至刻度,然后转移至10 mL小烧杯中。将玻碳电极、铂电极和饱和甘汞电极插入在溶液中,调节富集电位为-0.90 V,富集150 s,停止搅拌,静止10 s,记录0.20~-0.80 V的溶出伏安曲线。为了除去电极上残余的物质,在每一次测定结束后,电极在0.30 V搅拌清洗2 min。
2 结果与讨论
2.1 电极的处理
在麂皮上用0.05 μm Al2O3粉打磨玻碳电极后,然后超声清洗6 min,前3 min利用无水乙醇,后3 min利用水,用水冲洗后,将电极擦干待用。将三电极系统放入1.0×10-3mol/L K3Fe(CN)6和1.0 mol/L KCl的混合溶液中,在0.45~-0.05 V电位下进行循环扫描,扫描速度为50 mV/s,扫描20次。当出现的氧化峰与还原峰峰形对称并且电位差小于80 mV时,则说明电极已处理好可进行修饰,并且进行实验,循环伏安扫描图见图1。
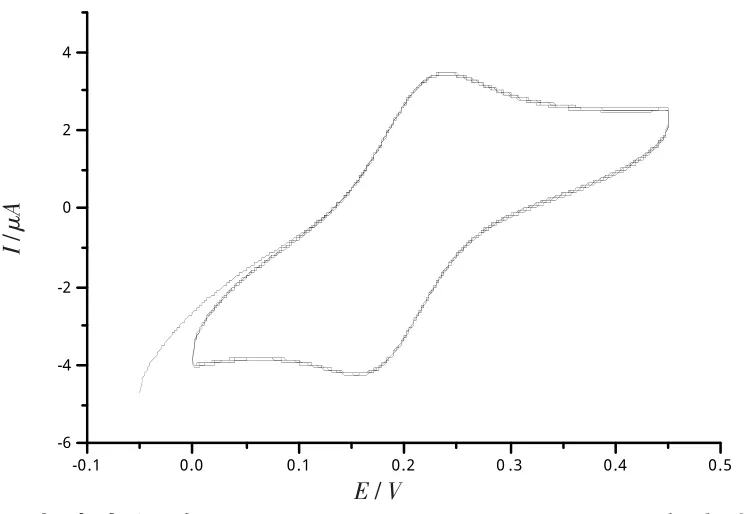
图1 玻碳电极在1.0×10-3mol/LK3Fe(CN)6溶液中的循环伏安图
2.2 锡膜电极的制备
制备锡膜电极有预镀锡膜法和同位镀锡膜法,本实验采用同位镀锡膜法[3]。
2.3 电极的选择
将裸玻碳电极、锡膜修饰电极在同一溶液中按实验方法的步骤分别进行实验。结果表明,锡膜修饰电极的峰电流比裸玻碳电极的峰电流值大。因此本实验选择锡膜修饰电极作为工作电极。见图2。
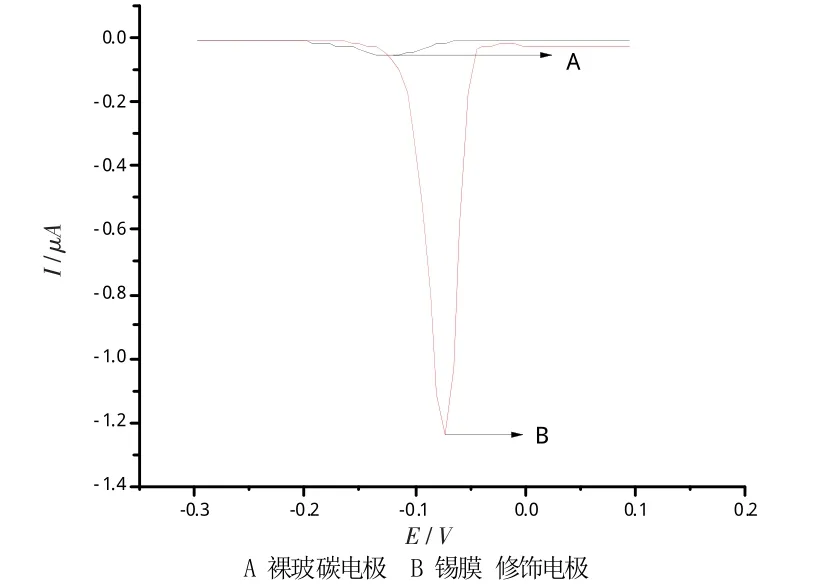
图2 在1.0× 10-3mol/L Bi3+和0.10 mol/L H2SO4中的DPASV图
2.4 底液及pH
控制其它实验条件,改变底液的种类,分别试验了0.50 mol/L H2SO4溶液,1.0 mol/L HC1溶液,pH 2.2柠檬酸-磷酸氢二钠缓冲溶液,pH 4.0醋酸-醋酸钠缓冲溶液。结果表明:当底液为0.50 mol/L H2SO4溶液时,Bi3+溶出峰电流最大,峰形最好。所以本实验选择0.50 mol/L H2SO4溶液作为底液(见图3)。进一步试验了H2SO4浓度对峰电流的影响,结果表明,0.10 mol/L H2SO4溶液作底液时效果最好。
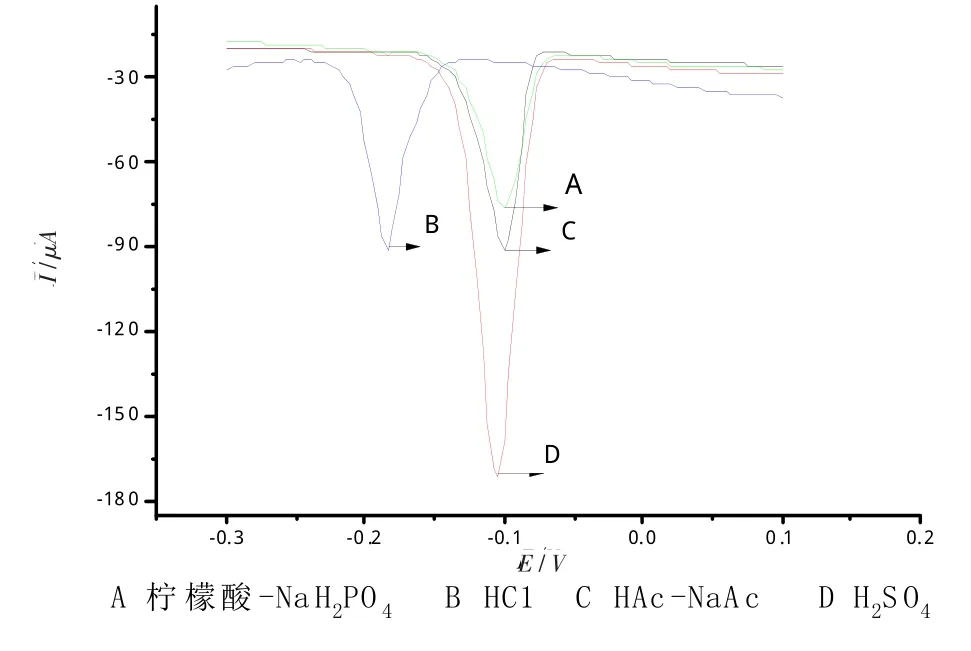
图3 不同底液下Bi3+的DPASV图
2.5 富集电位及富集时间
在其它实验条件不变的情况下,进行不同富集电位和时间的测试。结果表明:在富集电位为-0.90 V,富集150 s时,溶出峰电流最大且峰形较好。所以本实验以此作为富集电位、富集时间的最佳条件。
2.6 静止时间
改变不同的静止时间,Bi3+溶出伏安曲线见图4。当静止时间为10 s时,溶出峰电流最大,所以选择10 s作为静止时间的最优选择。见图4。
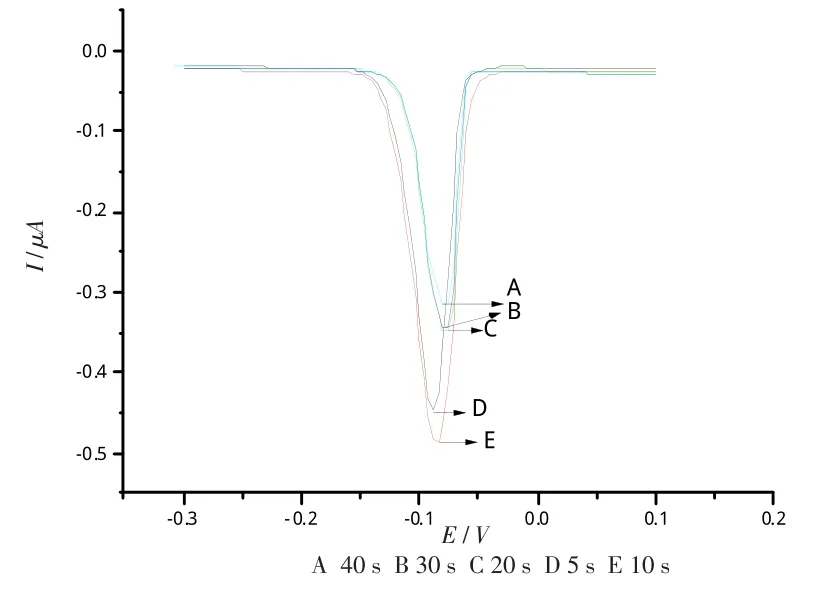
图4 不同静止时间下Bi3+的DPASV图
2.7 锡离子浓度的影响
固定Bi3+浓度和其他条件不变,改变Sn2+的浓度。结果显示,当Sn2+浓度为1.0×10-3mol/L时,Bi3+的溶出峰最大。当Sn2+浓度大于1.0×10-3mol/L时,镀膜太厚,使Bi3+的溶出峰减小;当Sn2+浓度小于1.0×10-3mol/L时对Bi3+的增敏作用小,使Bi3+的溶出峰也减小。
2.8 抗干扰实验
试验了一些常见离子如Ca2+、Zn2+、Na+、Mg2+、Fe3+等对Bi3+溶出峰电流的影响情况。加入干扰离子后,Bi3+的溶出峰电流值改变小于±10%,就认为该离子对Bi3+无干扰。结果表明,在仪器参数和试剂浓度最佳的条件下,1 000倍的阳离子如Ca2+、Fe3+、Na+,100倍的阳离子如Pb2+、Ni2+均对Bi3+的测定无干扰。
2.9 线性范围
移取浓度分别为1.0×10-5、2.0×10-5、3.0×10-5、4.0 × 10-5、5.0 × 10-5、6.0 × 10-5、7.0 × 10-5、8.0 × 10-5、9.0×10-5mol/L的Bi3+标准溶液1.0 mL,按照实验方法进行实验。在以上最佳实验条件下发现Bi3+的浓度在1.0×10-6~9.0×10-6mol/L范围内与峰电流成线性关系,其线性方程为Ip=0.496 3c+0.959,相关系数为0.997 1。见图5。

图5 峰电流与浓度的关系
2.10 检出限及重现性
1)检出限的测定:保持其他条件不变,逐渐减小混合溶液中Bi3+的浓度,直至无法检测到Bi3+的溶出峰电流,则此时混合溶液中Bi3+的浓度为检出限。实验结果表明,方法的检出限为1.0×10-10mol/L。
2)重现性的测定:使用同一电极依据实验方法对1.0× 10-3mol/L Bi3+、1.0× 10-3mol/L Sn2+和0.10 mol/L的H2SO4溶液的混合溶液进行15次平行测定,得峰电流相对标准偏差为3.28%,说明电极系统稳定,满足测定要求。
2.11 样品分析
2.11.1 样品溶液的配制
取含Bi(III)的药片胃必治1片于50 mL烧杯中,加入20 mL 1∶1的HNO3溶解后,过滤至250 mL的容量瓶中,用水定容,取其中1.0 mL置于250 mL容量瓶中,加入12.5 mL 2.0 mol/L HNO3,用水稀释至刻度配成Bi3+的待测液。
2.11.2 样品测定
在实验条件最佳的情况下,移取0.50 mL上述稀释溶液,按照实验方法,进行样品测定,结果见表1(n=5)。
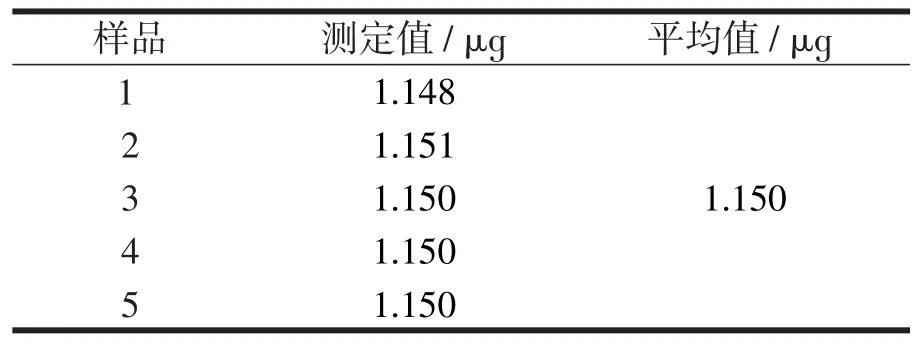
表1 样品测定结果
由实验测得的结果可算出每片胃铋治含Bi(AlO2)3的量为195.7mg。
2.12 加标回收实验
在上述溶液中,分别加入0.10 mL、0.20 mL、0.30 mL、0.35 mL Bi3+的标准溶液,按实验方法测定其中Bi(III)的含量,计算回收率,结果见表2(n=4)。由表2可见,4个加标量回收率平均值为98.48%,相对标准偏差R为1.05%,说明方法准确可靠。

表2 加标回收率的测定结果
3 结论
本实验采用锡离子作为修饰材料,利用DPASV法测定胃铋治中Bi(III)的含量。结果表明锡膜修饰电极具有很好的重现性和灵敏度,对胃铋治中Bi(III)有较好的电化学响应。本方法用于药物中Bi(III)含量的测定,结果满意。

