苦黄注射液多组分成分测定及成品的输液稳定性研究
何 远,石建丽,严榴芽
(余姚市人民医院药剂科,浙江 余姚,315400)
近几年来,临床上应用中药注射液造成的不良事件时有发生,因此,中药注射液的成品输液稳定性已经逐渐成为研究的热点[1]。为了探讨中药注射液从配制到输液过程中质量的变化,以及室内光照对中药注射液成品输液稳定性的影响,本研究考察了苦黄注射液的质量及成品输液的稳定性,以期为临床安全用药提供参考,减少不良事件的发生。苦黄注射液是由苦参、大黄、茵陈蒿、柴胡和大青叶经过加工制成的纯中药复方静脉注射液,临床上具有清热利湿、疏肝退黄的效果[2-3],主要用于因湿热内蕴引起的黄疸型病毒性肝炎的治疗。本研究采用UPLC-MS/MS技术对苦黄注射液的有效成分进行质量控制,并模拟临床用药对其成品输液进行稳定性考察。
1 材料与方法
1.1 仪器与试药
UPLC色谱仪(配有30型二元高压梯度泵、1100型柱温箱、1100型自动进样器,日本岛津),STQ5500型串联四级杆线性离子肼质谱仪(电喷雾离子化源和三重四级杆线性离子肼串联质量分析器,美国AB公司),电子分析天平(精密度0.000 1 g,美国梅特勒公司),KQ2700型120 W超声波清洗仪(昆山市超声仪器有限公司)。
苦参碱(批号:20161214)、槐国碱(批号:20170223)、大黄素(批号:20170412)、大黄酸(批号:20161223)、芦荟大黄素(批号:20170212)、柴胡皂苷a(批号:20170126)均购自国家食品药品检定研究院。苦黄注射液(批号:1610231、1702281、1706141,常熟雷允上制药有限公司),甲醇、甲酸为色谱纯,水为重蒸馏水,其他试剂均为分析纯。
1.2 方法
1.2.1液相色谱条件
色谱柱为Diamonsil-C18色谱柱(4.6 mm×250 mm,5.0 μm),柱温为26 ℃,流动相为甲醇(A)-0.1%甲酸缓冲溶液(B),梯度洗脱(0~3.5 min,22%~51%A;3.5~5.0 min,51%~74%A;5.0~8.0 min,74%~94%A;8.0~11.0 min,94%~94%A),流速为1.0 ml/min,进样量为10 μl。
1.2.2质谱条件
ESI源,源喷射电压为4 500~5 500 V;离子源温度为600 ℃,雾化气压力为4.15×105Pa,加热气压力为4.50×105Pa,工作模式为多反应监测模式(MRM)。正负离子同时进行检测监测。苦参碱、槐国碱、芦荟大黄素采用ESI+监测,大黄酸、大黄素、柴胡皂苷a采用ESI-监测。
1.2.3混合对照品溶液的配制[4]
分别精密称取苦参碱、槐国碱、大黄素、大黄酸、芦荟大黄素、柴胡皂苷a对照品适量,分别置于5 ml容量瓶中,甲醇溶液溶解,定容至刻度,摇匀,即得各组分单一对照品溶液。精密量取上述单一对照品溶液各适量,置于同一5 ml容量瓶中,甲醇溶液稀释,定容至刻度,摇匀,即可得到苦参碱80 ng/ml、槐国碱70 ng/ml、大黄素10 ng/ml、大黄酸168 ng/ml、芦荟大黄素391 ng/ml、柴胡皂苷a 95 ng/ml的混合对照品溶液,采用流动相逐级进行稀释为不同质量浓度的混合对照品溶液,置于冰箱中(2~8℃)储存备用。
1.2.4供试品溶液的配制[5]
分别精密量取不同批号的苦黄注射液1 ml置于10 ml容量瓶中,加入甲醇-水(1∶1,V/V)溶液稀释定容,过0.45 μm微孔滤膜,即可得到稀释10倍的苦黄注射液,用于芦荟大黄素和柴胡皂苷a的测定。将前述稀释10倍的苦黄注射液继续用甲醇-水(1∶1,V/V)溶液稀释,得到稀释4 000倍的苦黄注射液供试品,用于苦参碱、槐国碱、大黄素和大黄酸的测定。
2 结果
2.1 含量测定
2.1.1线性关系考察
将“1.2.3”项下的混合对照品溶液按照“1.2”项下的UPLC-MS/MS条件进样分析,以对照品进样质量浓度为横坐标(X)、峰面积积分值为纵坐标(Y)进行线性回归,得回归方程:
苦参碱:Y=3.75×105X+6.94×104,
r=0.999 7;
槐国碱:Y=2.14×105X+1.85×104,
r=0.999 4;
大黄素:Y=1.09×106X+4.32×104,
r=0.999 6;
大黄酸:Y=4.39×104X+2.24×105,
r=0.999 1;
芦荟大黄素:Y=1.87×104X+2.61×104,
r=0.999 4;
柴胡皂苷a:Y=4.37×105X+1.14×104,
r=0.999 4。
结果表明,苦参碱、槐国碱、大黄素、大黄酸、芦荟大黄素、柴胡皂苷a分别在1.25~80.21、1.12~71.23、0.15~10.45、2.54~168.74、6.12~392.56、1.49~95.02 ng/ml范围内线性关系良好。
2.1.2精密度试验
取同一批次苦黄注射液按照“1.2.4”项下制备得到稀释10倍的供试品溶液和稀释4 000倍的供试品溶液各6份,按照“1.2.1”项下的色谱条件进样分析,记录6种成分的色谱峰面积,计算RSD值,分别为1.02%、0.98%、1.01%、1.10%、0.99%、1.08%,表明仪器的精密度较好。
2.1.3重复性试验
取同批次苦黄注射液,按照“1.2.4”项下的制备方法配制稀释10倍和稀释4 000倍的供试品溶液各6份,分别按照“1.2.1”项下的色谱条件进样分析,记录6种成分的色谱峰面积,计算含量。苦参碱、槐国碱、大黄素、大黄酸、芦荟大黄素、柴胡皂苷a的平均含量分别为198.74、114.12、2.44、100.37、2.21、0.021 μg/ml,RSD分别为2.14%、1.98%、2.02%、2.14%、2.17%、1.99%,表明该方法重复性良好。
2.1.4加样回收率试验
取同一批次的苦黄注射液,分别加入6种有效成分的2种不同浓度,按照“1.2.4”项下的供试品溶液制备稀释10倍的溶液后,按照“1.2.1”项下的色谱条件进样分析,记录峰面积并计算平均加样回收率,结果如表1所示。
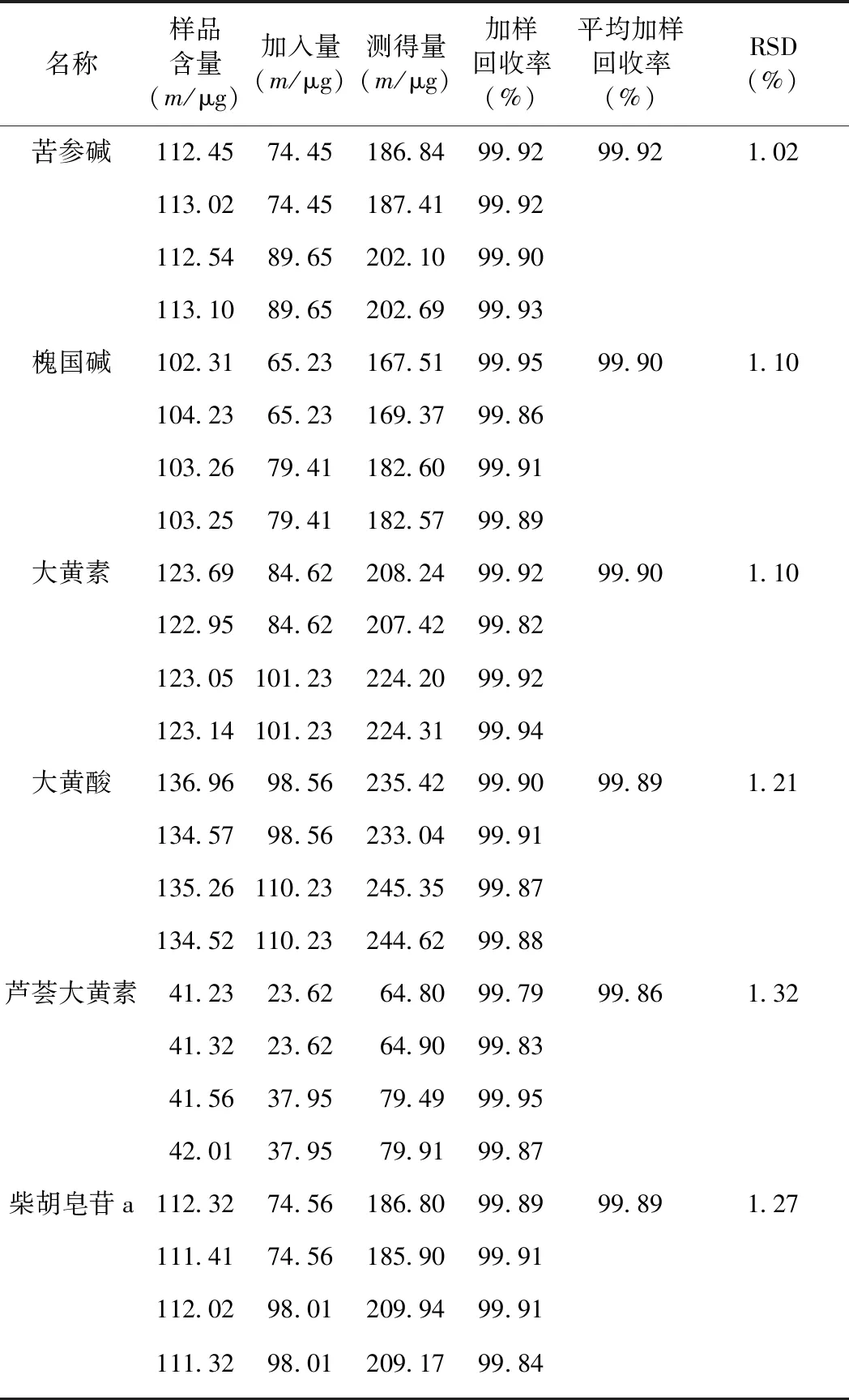
表1 苦黄注射液加样回收率试验结果(n=4)
2.1.5样品含量测定
取批号161023、170228、170614的3批次苦黄注射液,按照“1.2.4”供试品制备的步骤进行稀释配制后,按照“1.2.1”项下的色谱条件进行含量测定,结果如表2所示。
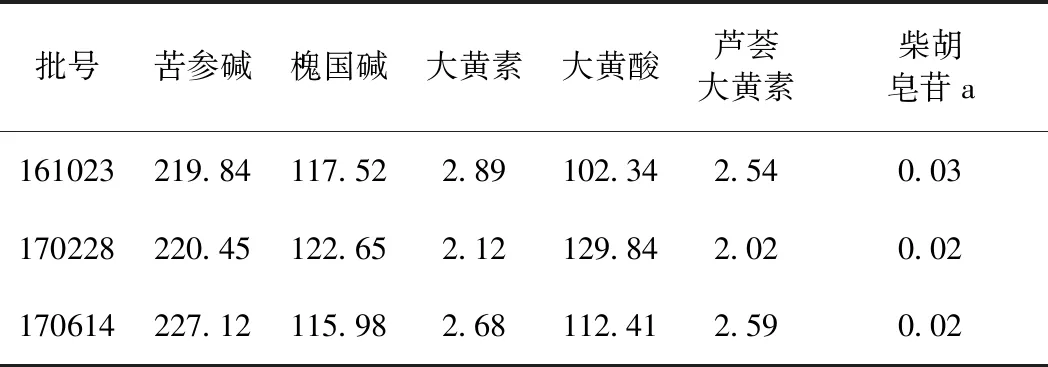
表2 样品有效成分含量测定结果(ρB/μg·ml-1,n=3)
2.2 苦黄注射液成品输液稳定性考察
模拟临床用药的浓度以及输液条件,于静脉用药配制中心由专业的药学人员在水平层流型洁净工作台上取苦黄注射液3支(每支10 ml),分别加入5%葡萄糖注射液250 ml、10%葡萄糖注射液250 ml,果糖注射液250 ml中,即可得到高浓度苦黄注射液成品输液;再取苦黄注射液3支(每支5 ml),分别加入5%葡萄糖注射液250 ml、10%葡萄糖注射液250 ml、果糖注射液250 ml即可得到低浓度苦黄注射液成品输液。对于最大剂量、最小剂量的苦黄成品输液按照2015年版《中华人民共和国药典》中的规定和相关检测方法[4],分别在室内光照(照度4 500 lx)下、遮光条件下室温放置36 h,并在0、1、2、3、4、6、8、10、12、14、20、24、30、36 h对其进行外观、可见异物、含量、pH值以及不溶性微粒的检测。结果:①各个成品输液在36 h均澄清,无明显的混浊和沉淀产生,颜色无明显的变化,为深黄色的澄清溶液。②低浓度室内光照的10%葡萄糖注射液的成品输液pH在6 h后显著升高;高浓度组5%葡萄糖注射液与10%葡萄糖注射液的成品输液pH值呈下降的趋势,低浓度组5%葡萄糖注射液的pH值则略微升高,遮光条件下保存的成品溶液稳定性比光照条件下的好;果糖注射液的成品输液呈中性。③除高浓度时,果糖注射液的成品输液24 h后的微粒值不符合规定,其余各个浓度组的微粒值在36 h内均符合规定,结果如表3所示。
3 讨论
3.1 样品的处理方式以及离子化模式的确定
在对苦黄注射液多组分成分进行测定时,其中的苦参碱、槐国碱、芦荟大黄素在正离子模式下的响应值较好,大黄酸、大黄素、柴胡皂苷a在负离子模式下的响应值最好[5-7]。在离子扫描结果中,苦参碱、槐国碱为苦参型生物碱逐步开环裂解,分别产生子离子。
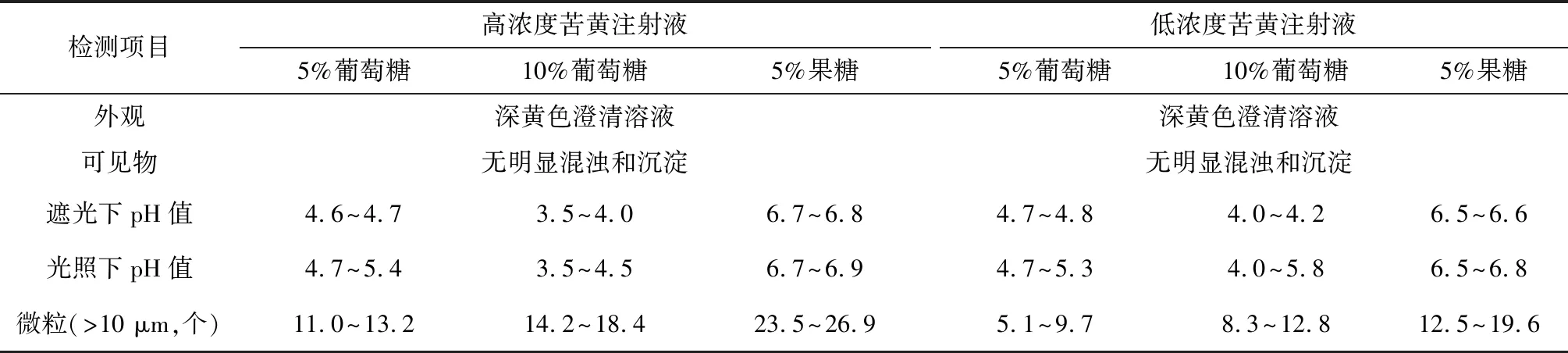
表3 3种苦黄成品输液的稳定性
因此,采用正负离子同时监测的模式,可以在同一分析周期内对苦黄注射液中的6种有效成分进行LC-MS/MS检测,为中药苦黄注射液的质量控制提供有效的实验参考数据[8-9],大大缩短了分析的时间,提高了分析检测的效率。
3.2 成品输液中溶媒的确定以及稳定性
中药注射剂在给患者输液过程中常常会出现不良反应事件[10],临床一般按照说明书选择5%葡萄糖注射液或者10%葡萄糖注射液作为苦黄注射液的溶媒,但不宜使用0.9%氯化钠注射液作为溶媒,主要原因是苦黄注射液一旦加入电解质会发生盐析作用,产生微粒或沉淀,因此,本研究不选择0.9%氯化钠注射液,而选择5%葡萄糖注射液和10%葡萄糖注射液[11-12],并对两者进行外观、可见异物、含量、pH值以及不溶性微粒的检测,结果表明,除光照条件下pH值有不同程度的增加之外,其余质量指标均符合合格标准。
本研究还选择了果糖注射液为溶媒进行配伍稳定性研究,考察糖尿病患者是否可以用果糖注射液代替葡萄糖注射液作为溶媒,以便为糖尿病患者的合理用药提供有价值的数据支持[13-15]。苦黄注射液及其成品输液在储存过程中对光照稳定性差,并且在最大剂量组中果糖注射液的成品输液24 h后微粒值不符合规定,在临床使用时,应注意上述引起质量变化的不稳定因素,以达到最大程度的安全治疗。

