长链非编码RNA BC200在非小细胞肺癌患者组织中的表达及作用*
孟腾 徐美林 耿华 王菁 高国政
肺癌是全球最常见的恶性肿瘤之一,约占所有肿瘤的13%,从组织学上可分为(small cell lung cancer,SCLC)和非小细胞肺癌(non-small cell lung cancer,NSCLC)。肺癌发病率和病死率近年来呈上升的趋势,肺癌患者5年生存率不足20%,晚期患者5年生存率更低,约2%[1-2]。各种调控基因在肺癌发生中起到重要作用,故探讨肺癌发生发展的机制具有重要意义。lncRNA 作为重要的调控因子,为恶性肿瘤的研究提供了新方向,lncRNA 是一类转录本长度超过200 nt功能性不编码蛋白的RNA分子,在肿瘤细胞的增殖、生长和凋亡的过程中扮演着不可或缺的角色,其表达异常与肿瘤的发生、发展、侵袭、转移等密切相关,可作为肿瘤临床诊断、疗效监测及预后评估的分子标志物[3-5]。上皮-间质转化(epithelial-mesenchymal transition,EMT)与肿瘤的发生、发展及侵袭转移密切相关,E-cadherin、N-cadherin 及Snail是上皮-间质转化相关蛋白,其中E-cadherin表达缺失是EMT最重要的标志[6]。研究表明,lncRNA BC200 在乳腺癌[7]、结肠癌[8]中明显升高,是一种与肿瘤细胞的增殖侵袭及转移密切相关的lncRNA[9],且在结肠癌中证明与EMT有关。本研究通过检测BC200在NSCLC组织中表达水平,分析其临床意义,为寻找肺癌新的生物学标志物提供思路。
1 材料与方法
1.1 材料
1.1.1 标本资料 收集2014年1月至2018年7月天津市胸科医院经病理确诊的肺癌原发灶和配对癌旁肺组织标本(距癌边缘>5 cm),共60 例,其中男性35例、女性25 例。TNM 分期:Ⅰ期27 例,Ⅱ~Ⅳ期33例;肿瘤大小:≤3 cm 39 例,>3 cm 21 例;组织病理类型:腺癌37例,鳞癌23例;30例有淋巴结转移。所选患者术前均未行局部或全身放疗或化疗,均有完整的病理组织学和临床资料,至少由2位病理学专家进行诊断或复核。所有组织样本取下后立即液氮冷冻,随后转入-80℃冰箱保存。本研究获得天津市胸科医院伦理委员会批准。
1.1.2 主要试剂及仪器 Trizol 等提取RNA 所用试剂购自美国Invitrogen 公司;引物购于北京奥科鼎盛生物科技有限公司;RNA逆转录试剂盒、实时荧光定量PCR 试剂盒购于大连Takara 公司;VIIA7 DX 实时荧光定量PCR 仪购自美国Applied Biosystems 公司;兔抗人Snail 抗体购于美国Abcam 公司(稀释浓度为1:100),兔抗人E-cadherin及鼠抗人N-cadherin抗体购于北京中杉金桥生物技术有限公司(稀释浓度均为1:100);二抗及DAB 显色试剂盒购于北京中杉金桥生物技术有限公司。
1.2 方法
1.2.1 RNA 提取和逆转录反应 取50 mg 的冻存组织磨成粉末状,加Trizol抽提RNA。组织中抽提RNA后,使用紫外分光光度计检测其纯度及浓度,取吸光度(A260/280)为1.8~2.0的RNA样本,将RNA样本按逆转录试剂盒说明书操作逆转录为cDNA,反应条件为30℃10 min,95℃5 min。
1.2.2 实时定量PCR 采用VIIA7 DX实时荧光定量PCR仪分析,按照SYBR Green说明书配制反应总体系20 μL:2×SYRR Green 10 μL,ROX Reference Dye Ⅱ0.4 μL,cDNA模板2 μL,上、下游引物(10 μmol/L)各0.8 μL,RNase free ddH2O6 μL。反应条件如下:95℃预变性30 s;95℃变性5 s,60℃退火延伸34 s,共40个循环。分析方法选用比较Ct值法(2-ΔΔCt法),Ct=ΔCt样本-ΔCt对照=[(样本Ct目的基因-样本Ct管家基因)-(对照组Ct目的基因-对照组Ct管家基因)]。
1.2.3 免疫组织化学染色法 组织标本经10%中性福尔马林缓冲液固定,常规脱水、浸蜡、石蜡包埋,连续切片,每张厚度4 μm。石蜡切片常规烤片,脱蜡,EDTA修复液修复,3%过氧化氢封闭10 min以阻断内源性过氧化物酶,滴加稀释的一抗,4℃冰箱过夜,二抗37℃水浴孵育20 min,DAB 显色,苏木素复染,封片。以PBS代替一抗为阴性对照。
1.2.4 结果判定标准 E-cadherin 和N-cadherin 均表达于细胞膜及近细胞膜处的少许细胞质,细胞质表达而包膜不表达者为阴性,Snail 表达于细胞质和细胞核,阳性细胞百分率及显色深浅采用半定量积分法分级。评分标准:随机选取10 个视野计数(×400),计数阳性细胞百分比。阳性细胞数<5%为0分,5%~25%为1 分,26%~50%为2 分,51%~75%为3分,76%~100%为4分。阳性着色强度:无色为0分,黄色为1 分,棕黄色为2 分,棕褐色为3 分。阳性细胞百分比和阳性着色强度乘积得分:<3 分为阴性组,≥3分为阳性组。
1.3 统计学分析
采用SPSS 22.0软件进行统计学分析。计量资料组间数据比较采用t检验,计数资料比较采用χ2检验,相关性分析采用pearson相关系数,诊断效能采用受试者工作特征(ROC)曲线来描述。以P<0.05为差异具有统计学意义。
2 结果
2.1 BC200与EMT相关蛋白在肺癌组织中的表达
实时荧光定量RT-PCR 检测结果显示,60 例NSCLC 患者中,BC200 在71.6%(43/60)的肺癌组织样本中表达高于癌旁正常组织,肺癌组织中BC200的表达水平显著高于癌旁组织中的表达水平(P<0.01),N-cadherin 及Snail mRNA 的表达水平显著高于正常肺组织中的表达水平,E-cadherin mRNA 在癌组织的表达水平显著低于癌旁组织中的表达水平(P<0.05)。
2.2 EMT相关蛋白的免疫组织化学法结果
E-cadherin 和N-cadherin 均表达于细胞膜及近细胞膜处的少许细胞质,Snail 表达于细胞质和细胞核(图1),免疫组织化学法结果显示,E-cadherin在癌组织中低表达或缺失表达,N-cadherin 及Snail 在癌组织中为高表达(P<0.05),E-cadherin、N-cadherin及Snail 在NSCLC 组织中的阳性表达率分别为40%(16/40)、57.5%(23/40)、57.5%(23/40),在正常肺组织中的阳性表达率为95%(19/20)、5%(1/20)、10%(2/20),表达差异具有统计学意义(P<0.05)。
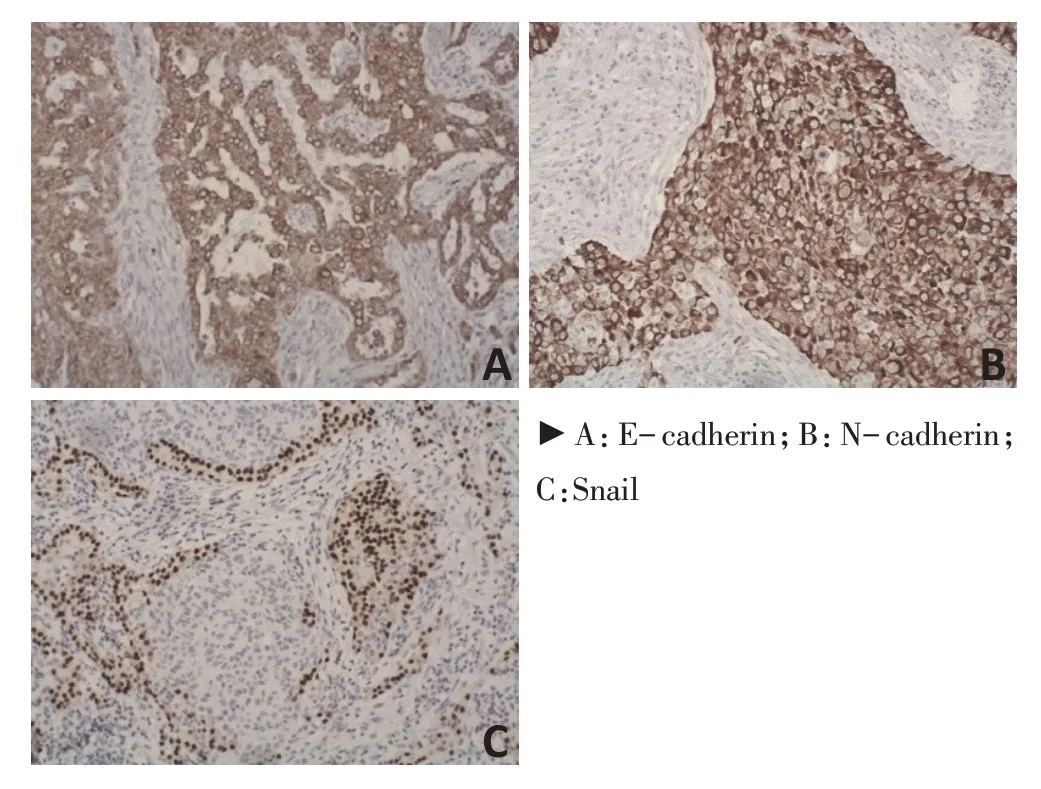
图1 免疫组织化学染色检测NSCLC 中E-cadherin、N-cadherin 和Snail的表达(SP法×200)
2.3 BC200表达水平与肺癌临床病理参数关系
BC200的表达与E-cadherin的表达呈负相关(r=-0.31,P<0.05),与Snail、N-cadherin的表达呈正相关(r=0.305、r=0.257,P<0.05);NSCLC中临床分期Ⅱ~Ⅳ者、淋巴结转移者、E-cadherin阴性者、N-cadherin及Snail阳性者,BC200高表达者多,肺癌组织中BC200的表达水平与淋巴结转移、临床分期、E-cadherin、N-cadherin及Snail阳性率相关(P<0.05),但与患者的年龄、性别、病理类型、肿瘤大小之间无明显相关性(表1,P>0.05)。
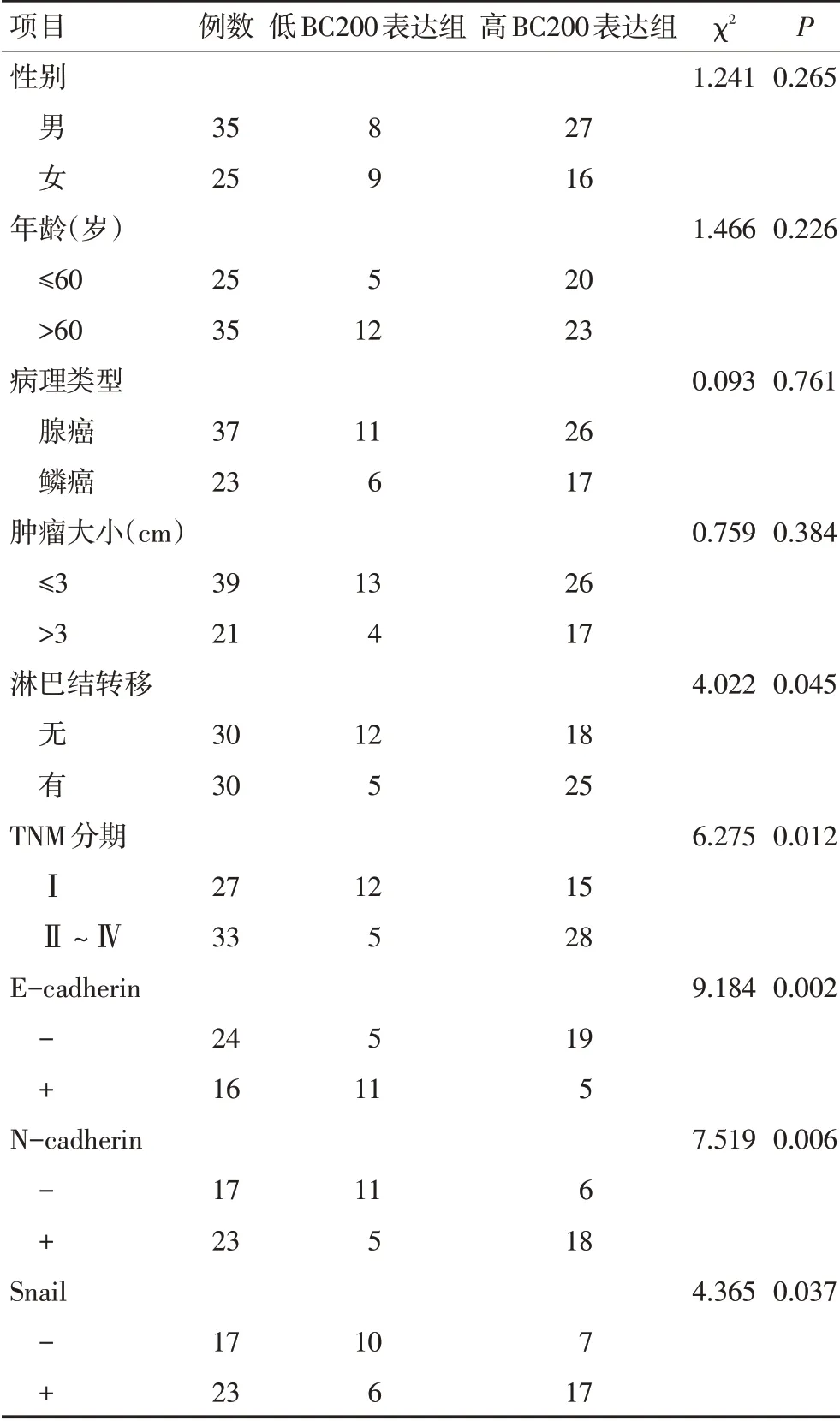
表1 BC200表达与NSCLC患者临床病理特征的关系
2.4 组织BC200水平在NSCLC诊断中的价值
组织BC200 水平诊断NSCLC 的价值较好,其曲线下面积分别为0.747(95%CI:0.660~0.835),灵敏度和特异度分别为60%和85%(图2)。

图2 BC200表达诊断非小细胞肺癌的ROC曲线
3 讨论
近年来,随着长链非编码RNA研究的深入,对肿瘤发生发展的机制研究已经从功能基因层面(编码蛋白质)逐渐拓展到非编码RNA。各种肿瘤包括NSCLC的发生发展的机制越来越多地在分子水平上被阐释,lncRNA作为重要的调控因子,已成为恶性肿瘤防治的研究热点,现已发现上千种lncRNA参与调控哺乳动物基因表达,在多种恶性肿瘤中均有lncRNA异常表达的报道,为临床诊断及靶向治疗等提供了理论基础[10-11]。通过高通量RNA测序(RNA-seq)对几种组织和细胞类型中的lncRNA表达已进行了定量分析[12]。有研究报道,前列腺癌的分子标志物前列腺癌抗原3(prostate cancer antigen 3,PCA3)[13]、肝癌的分子标志物(highly upregulated in liver cancer,HULC)[14]以及与多种恶性肿瘤有关的分子标示物肺腺癌转移相关转录本1(metastasisassociated lung adenocarcinoma transcript 1,MALAT-1)。lncRNA影响各种生物过程的潜在分子机制,包括染色质修饰、表观遗传调控、基因转录和翻译、RNA转换和基因组防御等[16]。
BC200 是一种在人类神经细胞中特异性表达的lncRNA,长度为200 nt,在神经细胞中由RNA 聚合酶Ⅲ转录,通过特定的调节机制调节神经元细胞突触小体的形成。BC200 通常仅在神经细胞和干细胞中表达,但有研究发现,BC200 在一些非神经系统的肿瘤组织中也呈现高表达(如肺癌、食管癌、乳腺等)[17]。Wu 等[8]发现,BC200 在结肠癌中表达上调,沉默BC200可能诱发明显G0/G1停滞,并通过抑制βcatenin 的表达而降低细胞周期蛋白D1,细胞周期素E 及c-Myc 的 表达,导 致HCT-116 和HT29 细胞 凋亡。下调BC200 会抑制HCT-116 和HT29 结肠癌细胞的增殖,并降低Ki-67 和PCNA 等细胞增殖标志物的表达以及MMP-2 和MMP-9 的表达,MMP-2 和MMP-9 的表达下降会减少HCT-116 和HT29 细胞的侵袭和EMT。本研究通过实时定量聚合酶链反应(QPCR)方法对60 例NSCLC 组织及癌旁配对肺组织的BC200的表达进行检测,并对其与临床病理特征的关系进行分析,发现NSCLC 患者癌组织中BC200 表达水平均显著高于配对癌旁组织(P<0.01),与之前在结肠癌中的报道一致[8]。本研究发现,NSCLC 组织BC200 表达与某些病理特征有关,如TNM Ⅱ~Ⅳ期的BC200 水平高于Ⅰ期,提示NSCLC 的恶性程度可能与BC200 表达水平有关,BC200 水平越高NSCLC的恶性程度越高,可能与BC200 参与NSCLC 的恶性转化有关;组织BC200表达水平与淋巴结转移情况有关,淋巴结转移者的BC200 表达水平相对较高,提示BC200可能参与了NSCLC 的侵袭转移过程。EMT 与肿瘤的发生、发展及侵袭转移密切相关,E-cadherin对于维持细胞与细胞间的黏附能力非常重要,E-cadherin 的低表达与肿瘤侵袭、迁移密切相关。E-cadherin、N-cadherin及Snail是EMT相关蛋白,而E-cadherin 表达缺失是EMT 最重要的标志[6]。本研究对BC200 表达与E-cadherin、N-cadherin 及Snail 的表达相关性进行了初步的研究,免疫组织化学法检测到E-cadherin 在癌组织中低表达或无表达,N-cadherin及Snail在癌组织中为高表达(P<0.05),E-cadherin阴性者、N-cadherin 及Snail 阳性者的NSCLC 中BC200高表达者居多,提示BC200在肺癌中的高表达可能与E-cadherin、N-cadherin及Snail均有关;QPCR法检测结果显示E-cadherin mRNA 在癌组织的表达水平显著低于癌旁组织中的表达,BC200、N-cadherin mRNA及Snail mRNA在癌组织的表达水平显著高于正常肺组织,BC200 的表达与E-cadherin 的表达呈负相关,与Snail、N-cadherin 的表达呈正相关,提示BC200 在肺癌中与EMT 有关,其可能通过EMT 调节肺癌细胞的侵袭和迁移。在NSCLC 诊断方面,组织BC200 水平有较高的价值,可考虑作为NSCLC 患者疾病诊断标志物在临床应用。

