血小板生成素抑制TGFβ1诱导的肺成纤维细胞向肌成纤维细胞转化的研究*
秦博宇 汪进良 齐晓光 陶然 周鑫 吴涛
肺癌是世界上最为常见的恶性肿瘤之一,国家癌症中心2015年发布数据表明,2006年至2011年间,中国肺癌5年患病率为130.2 万例[1]。放射疗法是肺癌综合治疗的重要组成部分,对于早期肺癌具有良好的治疗效果。然而,高能射线在杀伤肿瘤细胞的同时,不可避免地对放射区域附近正常细胞和局部肺组织造成损伤。其中,急性放射性肺炎和放射性肺纤维化是肺癌大剂量放疗后较为常见且危重的并发症[2-4]。此外,包括靶向治疗、免疫治疗及常规化疗在内的各种肺癌治疗手段都有可能造成间质性肺炎及肺纤维化[5-7]。肺纤维化病因组成复杂,是众多致纤维化因子、免疫细胞及肺实质细胞相互影响作用的结果,其病理特点表现为早期弥漫性肺泡炎和后期肺成纤维细胞异常增殖及以胶原蛋白为主的胞外基质过度合成积聚。目前对肺纤维化机制研究尚不明确,临床也缺乏有效的治疗方案[8]。
血小板生成素(thrombopoietin,TPO)作为一种主要由肝脏产生的糖蛋白,在巨核细胞分化及血小板产生过程中发挥关键调控作用[9]。近年研究发现,TPO处理能够通过抑制细胞氧化应激反应,改善由辐射或化学试剂造成的组织器官损伤[10-12]。由于氧化应激反应在肺纤维化的进展过程中扮演重要角色,提示TPO 可能具有缓解肺纤维化进展的潜在作用。因此,本研究拟观察TPO 处理对TGFβ1 诱导肺成纤维细胞向肌成纤维细胞转化的影响,为进一步探讨TPO在肺纤维化治疗中的应用价值提供实验基础。
1 材料与方法
1.1 实验材料
1.1.1 实验细胞 人胚肺成纤维细胞HFL 源自中国人民解放军总医院肿瘤中心实验室保存。
1.1.2 试剂与仪器 F12K培养基、胎牛血清、PBS缓冲液、含0.02%EDTA 的0.25%胰蛋白酶均购自美国GIBCO公司、重组人血小板生成素、重组人TGFβ1因子均购自美国Peprotech 公司、CCK8 试剂(日本同仁公司)、细胞总RNA 提取mini 试剂盒(中国天根生化公司)、cDNA反转录试剂盒(日本TAKARA公司)、实时荧光定量PCR 反应预混试剂(日本TAKARA 公司)、兔抗人ColⅠ抗体(美国Proteintech 公司)、鼠抗人αSMA 抗体、兔抗人Ki-67 抗体(中国中杉金桥公司)、山羊血清、DAPI(中国博士德公司)、荧光二抗(中国中杉金桥公司),PCR引物(中国华大基因公司)。细胞培养箱(美国Baxter 公司)、超净工作台(北京半导体设备厂)、倒置荧光显微镜(日本OLYMPUS公司)、低速离心机(北京医用离心机厂)、酶标仪(上海雷勃公司)、荧光实时定量PCR仪(美国BioRAD公司)、分光光度计(德国Eppendrof公司)。
1.2 实验方法
1.2.1 细胞培养 人胚肺成纤维细胞HFL 培养于含10%胎牛血清(fetal bovine serum,FBS)、100 IU/mL 青霉素和100 μg/mL链霉素的F12K培养基中。待细胞生长至90%汇合,吸弃培养基用PBS 缓冲液润洗一次,加入胰蛋白酶消化至细胞变圆脱落,加入培养基终止消化后将细胞收集至离心管内,1 200 rpm 离心5min后将细胞重悬并接种至新培养皿中,置于37℃、5%CO2的细胞培养箱中静置培养。
1.2.2 CCK8 法检测TGFβ1 与TPO 处理对细胞增殖的影响 将HFL细胞消化为单细胞,以5×103个/孔的密度接种于96孔板中,静置培养24h后,吸弃孔内培养基并分别加入含不同细胞因子的培养基:正常组(F12K+2%FBS)、对照组(F12K+2%FBS+10 ng/ml TGFβ1)、实验组(F12K+2%FBS+10 ng/ml TGFβ1+100 ng/ml TPO),每组均设置5 个重复检测孔。继续培养24 h,吸弃孔中培养基并加入含10%CCK8试剂的培养基,37℃孵育1 h后使用酶标仪测定每孔OD值(测定波长450 nm)。细胞相对增殖率计算公式为:相对增殖率=(实验组/对照组OD)×100%。
1.2.3 细胞总RNA 提取及实时荧光定量PCR 检测将细胞消化后离心收集细胞团,并按试剂盒使用分离获得细胞总RNA。通过分光光度计检测RNA纯度及浓度后,将800 ng总RNA通过Prime Script RT Master Mix 及oligo(dT)引物反转录为cDNA。采用SYBR Green掺入法进行实时荧光定量PCR反应,并通过实时荧光定量PCR仪采集荧光数据。GAPDH基因作为检测基因表达的内参对照。不同样本间基因相对表达水平经内参表达均质化后采用2-ΔΔCt法计算获得。PCR 反应引物如下:COL1A2-FP:GGCCCTCAAGGT TTCCAAGG;COL1A2-RP:CACCCTGTGGTCCAACA ACTC;cMPL- FP:CTGAAGTGTTTCTCCCGAACAT;cMPL-RP:GCGGGTAGGCATACAGCAG;GAPDH-FP:GGAGCGAGATCCCTCCAAAAT;GAPDH-RP:GGCT GTTGTCATACTTCTCATGG。
1.2.4 细胞免疫荧光染色 对细胞进行不同处理后,吸弃培养基后加入4%多聚甲醛溶液室温固定细胞15 min。用含0.2%Triton×100的PBS缓冲液室温处理细胞15 min。用含10%山羊血清的PBS缓冲液处理细胞1 h。用封闭液稀释的一抗并孵育细胞过夜(4℃)。洗涤后用PBS稀释的荧光二抗室温避光孵育细胞1 h。洗涤后用PBS稀释的DAPI孵育细胞5 min。洗涤后将细胞置于荧光显微镜下观察染色情况。
1.3 统计学分析
采用SPSS 20.0 软件进行统计学分析,所有实验数据均以表示;计数资料采用Student'st检验、多组数据统计采用ANOVA 方差分析。以P<0.05 为差异具有显著统计学意义。
2 结果
2.1 TGFβ1诱导HFL细胞向肌成纤维细胞转化
本研究采用10 ng/mL TGFβ1处理诱导HFL细胞分化[13]。与对照组相比,经10 ng/mL TGFβ1 处理24~48 h,HFL 细胞核质比缩小,细胞形态逐步由短梭形或卵圆形转变为长梭形(图1A)。实时荧光定量PCR 检测结果显示,经TGFβ1 处理24~48 h 肺肌成纤维细胞标志基因α-SMA 与COL1A2表达水平均较对照组显著提高(图1B)。免疫荧光结果进一步显示,经TGFβ1 处理48h 后细胞αSMA 及COL1 蛋白的表达水平较对照组显著提高(图1C)。这些结果均表明TGFβ1处理能够诱导HFL细胞向肌成纤维细胞转化。
2.2 TPO抑制TGFβ1介导的肺成纤维细胞向肌成纤维细胞的转变
为探讨TPO 对肺成纤维细胞向肌成纤维细胞转化的影响,首先应用实时定量PCR 对TGFβ1 处理前后TPO受体c-MPL基因的转录水平进行分析。检测结果显示,该基因在TGFβ1 处理前后均在细胞中表达,提示TPO 能够通过结合其受体发挥生物学作用(图2A)。TGFβ1与TPO联合处理HFL细胞24~48 h,显微镜检发现低浓度(10 ng/mL)或高浓度(100 ng/mL)的TPO 处理均未导致细胞凋亡水平的显著提高(图2B)。荧光实时定量PCR 检测结果表明,TPO 与TGFβ1联合处理HFL细胞24 h及48 h,肌成纤维细胞标志基因αSMA 及COL1A2 的表达水平均较对照组(单独添加TGFβ1 组)显著下降,且抑制效果与TPO处理浓度呈正相关(图2C)。
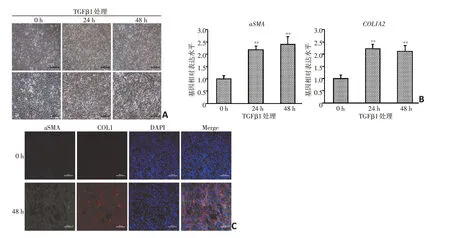
图1 TGFβ1诱导HFL细胞向肌成纤维细胞转化
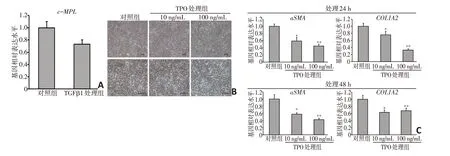
图2 TPO抑制TGFβ1介导的肺成纤维细胞向肌成纤维细胞的转化
2.3 TPO处理抑制TGFβ1介导的HFL细胞增殖
TGFβ1 能够通过活化SMAD 信号通路促进HFL细胞的异常增殖。在本研究中,将100 ng/mL TPO 与TGFβ1 联合处理HFL 细胞24 h,CCK8 检测结果表明TPO组细胞数量较对照组显著降低(图3)。提示TPO处理后能够抑制TGFβ1介导的细胞增殖发生。
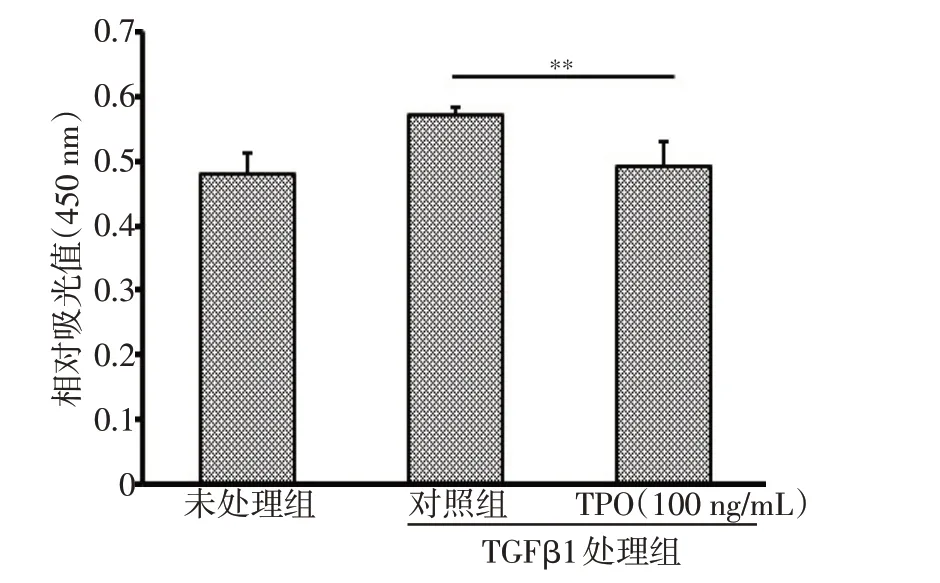
图3 TPO 抑制TGFβ1 介导的细胞过度增殖(CCK8 法检测TGFβ1 和TPO联合处理相较TGFβ1单独处理后细胞增殖率变化);**P<0.01
2.4 TPO 能够挽救TGFβ1 对HO-1 基因表达的抑制作用
血红素加氧酶(heme oxygenase,HO)作为热休克蛋白家族成员之一,是一种广泛存在的抗氧化酶,具有抗炎、抗氧化、抗凋亡、抗增生效应。通过荧光实时定量PCR 发现,TGFβ1 处理24h 后细胞HO-1 基因的表达水平较正常细胞显著降低,而加入TPO 处理后,该基因的表达水平较TGFβ1组显著提高,达到正常组细胞的水平(图4)。

图4 TPO 促进HO-1 基因的表达(实时定量PCR 分析TGFβ1 联合TPO处理后HO-1基因的相对表达水平;相对表达水平与未处理样本比较,GAPDH为内参基因);*P<0.05
3 讨论
肺纤维化是临床肿瘤治疗过程中一类常见并发症。临床研究表明,目前应用最为广泛的肿瘤治疗手段均可能导致间质性肺炎及肺纤维化的发生,包括:1)大剂量放射线治疗;2)博莱霉素、紫杉醇、环磷酰胺、吉西他滨等化疗药物治疗;3)吉非替尼、索拉菲尼、伊马替尼等靶向药物治疗等。目前,对特发性肺纤维化的治疗手段十分匮乏,临床常用的激素治疗效果有限且副作用大,难以逆转疾病进展[8,14-15]。
大量研究表明,在免疫细胞及炎性因子的刺激下,肺脏局部组织产生TGFβ1,并通过激活SMAD 信号通路诱导肺成纤维细胞向肌纤维细胞的分化,导致细胞异常增殖和细胞外基质蛋白的沉积。过量胞外基质沉积会导致肺组织结构异常及气体交换功能下降,最终导致呼吸功能衰竭[8]。因此,抑制肺成纤维细胞转变、增殖及胶原蛋白合成成为延缓肺纤维化发生的关键靶点。
TPO 作为一类临床治疗血小板减少症及血小板减少性紫癜的常用药物,已被大量研究证实不仅具有促进巨核细胞增殖分化的作用,能够使JAKSTAT、MAPK 等信号通路抑制胞内氧化应激反应,并通过抑制细胞凋亡发挥细胞保护的作用。本研究中,利用TGFβ1 介导的HFL 细胞向肌成纤维细胞转变模型,发现TPO 受体c-MPL 基因在TGFβ1 处理前后均表达于HFL细胞中。经TPO处理能够显著抑制COL1A2及αSMA基因及蛋白的表达水平及细胞的过度增殖。对TPO作用靶点的研究发现,TPO处理能够显著上调HO-1基因的表达水平,可能是TPO抑制胶原蛋白合成的潜在途径之一。HO-1 已被证实在应激条件下保持细胞的稳定性发挥关键的调控作用,并能够通过调控NRF2 抑制内源性ROS 的产生减少组织脂质过氧化,发挥其抗氧化应激损伤的功能[16-19]。放化疗均可导致局部组织ROS的代谢失衡,是肺纤维化发生的关键启动因素之一。因此,TPO是否通过HO-1 介导的ROS 抑制发挥其抗纤维化的功能,值得在后续的研究中进行深入探讨。
综上所述,本研究发现TPO 能够作为一类新型的肺纤维化候选治疗药物,具有抑制细胞增殖及肌成纤维细胞胶原蛋白合成的双重作用。为进一步开展体内相关实验提供了一定的理论及实验基础。

