根癌农杆菌介导的马铃薯遗传转化体系的研究
张 萍
(咸阳职业技术学院,陕西 咸阳 712000)
马铃薯为经济型作物,含有丰富的营养价值且产量高,属粮蔬兼用型食物,在农业生产和生活食用中备受青睐。随着马铃薯深加工的不断创新和快餐行业的发展,马铃薯食品的发展方向也由鲜食型转向加工型和专用型。科研工作者常用基因工程技术定向改造基因以改变其性状特征,获得新品质特征的马铃薯,研究培育出一些优质的抗病虫害的马铃薯新品种。以马铃薯作为基因工程研究作物,主要是利用马铃薯可以通过无性繁殖快速将转基因性状传递给后代的优势[1]。
实验以马铃薯NHD3、NC、NF的茎段为外植体,用根癌农杆菌研究马铃薯的遗传转化效率,筛选出适合诱导马铃薯新品种NHD3、NC、NF愈伤组织生长的培养基,进而研究农杆菌介导的转化遗传体系,并分别比较菌液浓度、预培养时间、共培养时间等因素对马铃薯遗传转化效率的影响,以便为相关研究提供参考及我们后续转化实验奠定基础。
1 材料和方法
1.1 材料
(1)马铃薯栽培品种NHD3、NC、NF无菌试管苗。
(2)癌农杆菌LBA4404(植物表达载体:pARTG F1-2)。
1.2 试剂及其配制
抗生素、激素以及MS培养基的配制[2],具体操作如下:
1.3 MS母液配制
(1)母液Ⅰ(20×):每升含33 g NH4NO3、38 g KNO3、8.8 g CaCl2·2H2O、7.4 g MgS·7H2O、3.4 g KH2PO4;
(2)母液Ⅱ(200×):每升含166 mgKI、1 240 mg H3BO3、4 460 mg MnSO4·4H2O、1 720 mg ZnSO4·7H2O、50 mg Na2MoO4·2 d H2O、50 mg CaSO4·5H2O、5 mg CoCl2·6H2O;
(3)母液Ⅲ(100×):每升含5 560 mg FeSO4·7H2O、7 400 mg Na2·EDTA·2H2O;
(4)母液Ⅳ(200×):每升含100 mg烟酸、100 mg盐酸吡哆醇、400 mg甘氨酸、20 mg VB1;
1.4 激素配制
(1)NAA(1 mg·mL-1):称取100 mg固体NAA,溶解于适量0.1 mol·L-1的氢氧化钠溶液中,用蒸馏水定容至100 mL,0.22 um滤膜过滤灭菌,4℃保存。
(2)IAA(1 mg·mL-1):称取100 mg固体IAA,溶解于适量0.1 mol·L-1的氢氧化钠溶液中,用蒸馏水定容至100 mL,0.22 um滤膜过滤灭菌,4℃保存。
(3)6-BA(0.5 mg·mL-1):称取100 mg固体6-BA,溶解于少量稀盐酸中,用蒸馏水定容至200 mL,0.22 um滤膜过滤灭菌,4℃保存。
1.5 培养基
1.5.1 YEB培养基 每升含5.0 g牛肉浸膏、1. 0 g酵母浸膏、5. 0 g蛋白胨、0.5 g MgSO4·7H2O、0. 8 %琼脂(pH 值7. 2)。
1.5.2 植物培养基 愈伤组织诱导培养基:以MS培养基为基础,调整NAA 浓度,配制成A、B、C、D、E、F六种愈伤组织诱导培养基,用于筛选愈伤组织诱培养基,具体组成如下:
A:MS+1.0 mg·L-16-BA +0.1 mg·L-1NAA
B:MS+1.0 mg·L-16-BA +0.2 mg·L-1NAA
C:MS+1.0 mg·L-16-BA +0.3 mg·L-1NAA
D:MS+1.0 mg·L-16-BA +0.4 mg·L-1NAA
E:MS+1.0 mg·L-16-BA +0.5 mg·L-1NAA
F:MS+1.0 mg·L-16-BA +0.6 mg·L-1NAA
1.6 仪器
双面超净工作台(SW-CJ-ZF,苏州净化设备有限公司);小型高压灭菌锅(TH-1020,台湾TIAOHTSTN公司);光照培养箱(GZP-250型,上海精宏实验设备有限公司);生化培养箱(SHP-250型,上海精宏实验设备有限公司);气浴式震荡器(ZJS-1320,科大创新股份有限公司中佳分公司);实验室专用超纯水机(KL-RO-20,成都康宁实验专用纯水设备厂);电热恒温水浴锅(HH-S4型,北京科伟永兴仪器有限公司)等。
2 实验方法
2.1 筛选培养基
2.1.1 组织培养苗的复壮 无菌条件将分别剪取三种马铃薯NHD3、NC、NF组培苗茎段若干,含一个腋芽,约1.0~2.0 cm,接种于MS培养基中,每瓶接种6~8个茎段,每个品种接种5~7瓶,培养条件:25±1℃、1 500~2 000 Lx光照。培养时间15 d左右。
2.1.2 愈伤组织诱导培养基的筛选 无菌条件下剪取长势良好的组织培养苗茎段若干,无腋芽,约1.0~2.0 cm,分别接种于1.6.2中所制的六种不同培养基中,每瓶接种6~8个茎段,每个品种接种5~7瓶,培养条件:25±1℃、1 500~2 000 Lx光照。培养时间:20 d。统计愈伤发生率。
2.2 研究农杆菌介导的马铃薯转化遗传体系
2.2.1 复壮 无菌条件剪取NHD3马铃薯组培苗茎段若干,含一个腋芽,约1.0~2.0 cm,接种于MS培养基中,接种6~8个茎段,培养条件:25±1℃、1 500~2 000 Lx光照。培养时间:15 d左右。
2.2.2 预培养 无菌条件剪取生长健壮的复壮组培苗茎段若干,无腋芽,约0.8~1.5 cm,接种于预培养基中,接种6~8个茎段,预培养条件:25±1℃、1 500~2 000 Lx光照。培养时间:10 d左右。
2.2.3 根瘤工程农杆菌菌液制备 将工程农杆菌LBA4404(含有pARTGF1-2)放入含Kan(70 mg·L-1)、Rif(80 mg·L-1)、Str(40 mg·L-1)的YEB培养基溶液中,避光振荡培养,培养条件:28℃,260 rpm。培养时间:24~36h。活化菌液后,按1 ∶50的比例进行放大培养,培养时间分别为4、6、8、10、12、14、16 h,取不同培养时间的菌液各取2 mL,测定OD600值,确定出农杆菌达对数生长期的最适振荡培养时间。将达对数生长期的菌液转入无菌离心管中,5 000 rpm离心5 min后收集菌体,加入MS培养基并稀释至所需浓度。
2.2.4 转化方法 首先对外植体组培苗进行两天的预培养,再进行农杆菌侵染,最后对侵染后的外植体置于黑暗环境进行共培养。方法:剪取健壮外植体组培茎段(约0.5 cm,无腋芽),接种于培养基上,置于人工气候箱(条件:16 h·d-1、25±1℃、光照强度2 000 Lx)预培养2 d,预培养后对农杆菌悬液进行侵染,并不断摇晃使菌液与外植体充分接触,数分钟后取出,拭去表面菌液,再转入共培养培养基中,置于黑暗环境28℃进行共培养。
2.2.5 优化农杆菌转化马铃薯遗传转化体系[4,5]为研究不同转化条件对马铃薯遗传转化效率的影响,分别进行以下实验:
(1)农杆菌浓度的影响。不同离心条件培养过夜的农杆菌菌液,调整OD600值分别为0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0,加入MS液体培养基中,分别转化培养马铃薯无菌苗。
(2)茎段预培养时间的影响。剪取生长健壮的NHD3组培苗茎段(0.8~1.0 cm,无腋芽),接种于预培养基中,在25+ 1℃、1 500Lx光照下预培养。
(3)共培养时间的影响。预培养的外植体在OD600=0.5的农杆菌菌液中浸染8~10 min后,接种于MS固体培养基上,黑暗条件下共培养时间分别为1 d 、2 d 、3 d、4 d、5 d、6 d。
3 结果与分析
3.1 马铃薯茎段愈伤组织诱导培养基筛选
马铃薯茎段在A、B、C、D、E、F六种马铃薯愈伤组织诱导培养基上培养10 d后,茎段边缘开始长出愈伤,20 d后,外植体分化出愈伤组织基本完成时,统计各品种马铃薯出愈外植体个数(结果见表1)。从中可以看出NC、NF、NHD3依次在B、D、C型培养基上出愈率最高,诱导率分别为94.44、97.50、97.56,在这三种培养基中愈伤组织长势良好,新芽呈新绿色、结构致密。
3.2 菌液浓度的影响
取10 mL对数生长期的农杆菌菌液,5 000 rpm离心5 min,弃上清液,取菌体制备不同浓度梯度的菌液MS培养基,研究农杆菌的不同浓度影响愈伤组织形成效率。结果表明,菌液浓度在OD600为0.6的浓度时诱愈率最高,形成愈伤组织数最多。浓度在OD600为0.2~1.0时可形成愈伤组织。
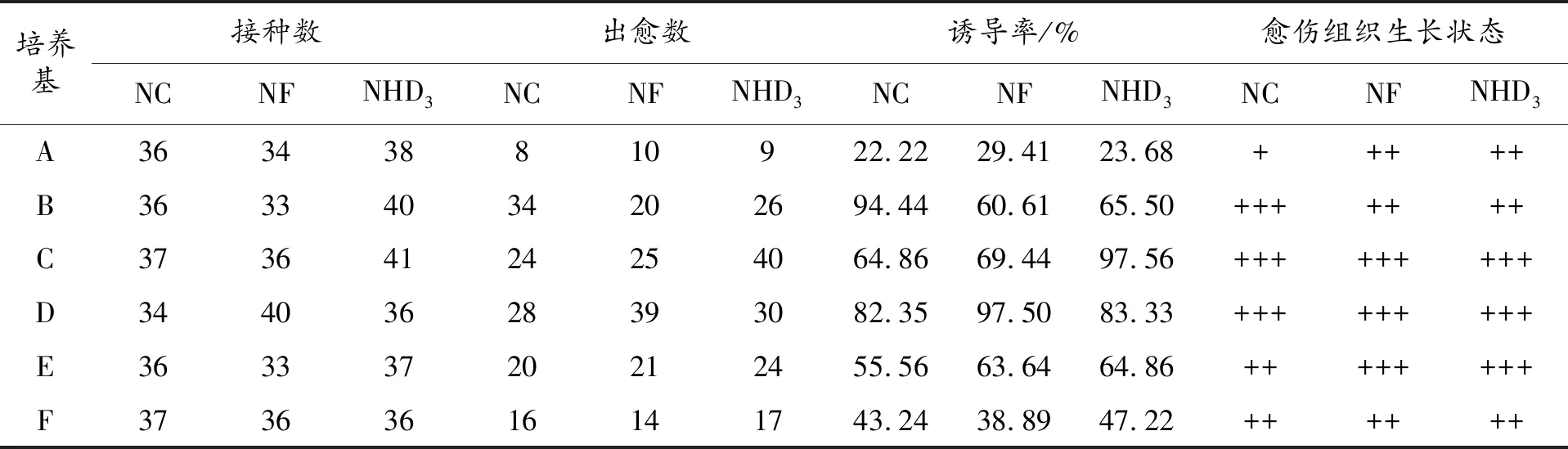
表1 马铃薯茎段愈伤诱导结果统计
注:+++:生长呈新绿色,结构致密;++:生长呈浅绿色,结构较为致密 +:生长呈浅绿色,结构疏松。
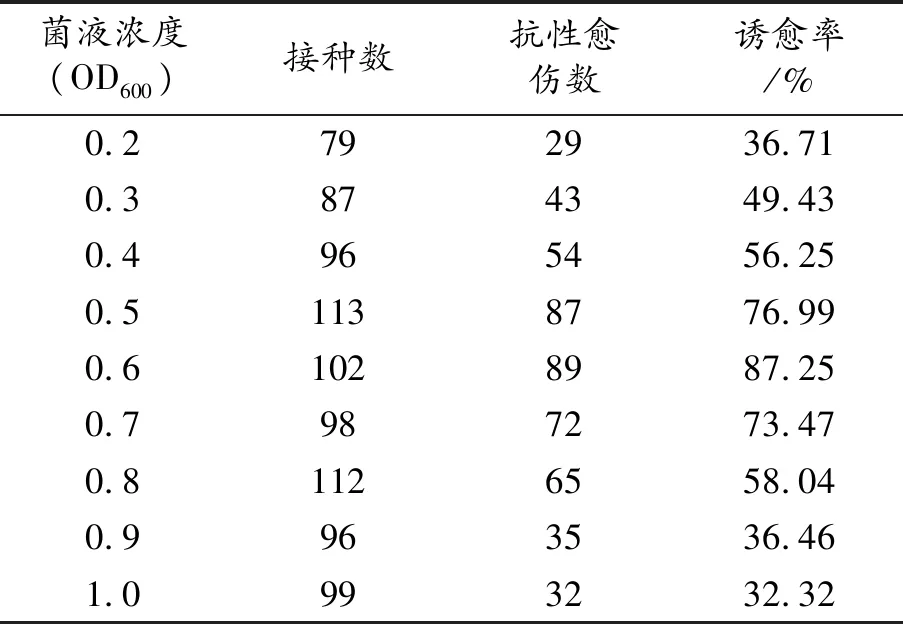
表2 菌液浓度影响愈伤组织形成统计
3.3 预培养时间的影响
农杆菌侵染前对外植体进行短时间的预培养,可缓解侵染时农杆菌伤害外植体,促进细胞分裂,使其更容易整合外源DNA,提高转化效率[6]。由表3可知,茎段抗性愈伤率达最高,预培养的最佳时间为2 d。
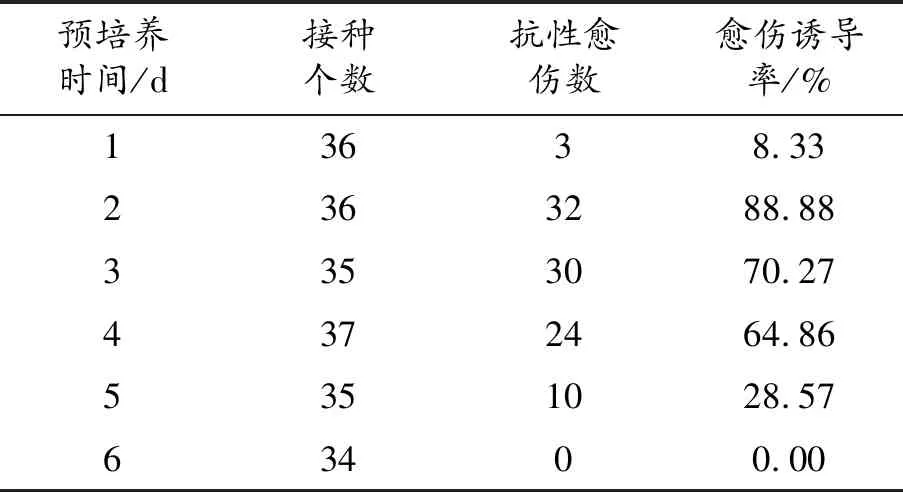
表3 预培养时间影响愈伤组织形成统计
3.4 共培养时间的影响
外植体被农杆菌浸染后受体细胞不能立即整合外源基因,需经过一定时间的来完成转移整合[7]。共培养时间过短或过长,均会影响到转化效率。所以,确定共培养时间是形成愈伤转化的重要因素。由表4可知,共培养2 d,愈伤组织诱导率最高。
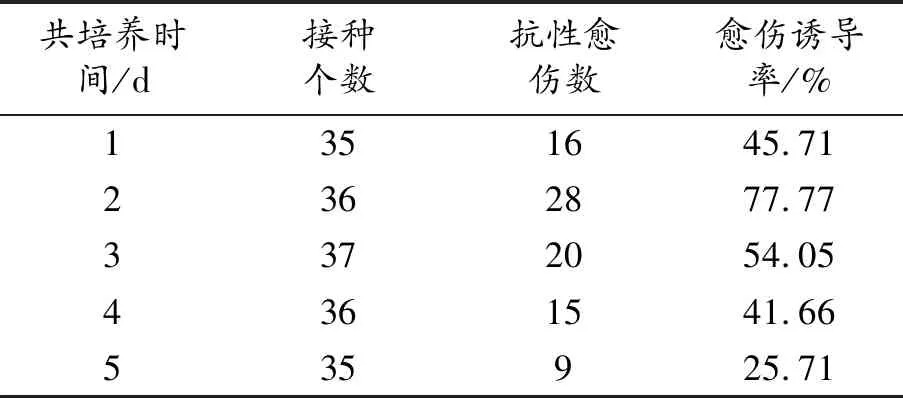
表4 共培养时间影响愈伤组织形成统计
4 小结与讨论
(1)实验通过组织培养的方法研究马铃薯茎段的再生能力,以便建立高效的马铃薯再生体系,为后续实验奠定基础。研究表明诱导不同品种马铃薯茎段形成愈伤组织需要不同种类的激素及浓度[8~9],使用较多的激素种类为6-BA 、NAA、IAA等,其中6-BA的浓度范围为1.0~2.0 mg·L-1,本实验中确定6-BA 的使用浓度为1.0 mg·L-1。而细胞生长素在NAA中活力高,且耐高温、高压不易被光分解破坏,所以本实验选用NAA。从试验结果来看,“NC”、“NF”、“NHD3”品种在6-BA浓度一致、培养时间为20 d左右时,分别以NAA 为0. 2 mg·L-1、0.3mg·L-1、0.4 mg·L-1时愈伤组织的诱导效果较好。本试验结果与李娟等报道[13]的相一致。
(2)研究影响转化效率因素得出结论:① 转化马铃薯茎段需要适当时间的预培养。预培养可促进外植体细胞分裂[10],使受体细胞易于整合外源DNA,提高转化效率[11-13]。②确定共培养时间是遗传转化效率重要的影响因素,是实现外源基因向外植体转化成功的关键[14]。③合适的农杆菌浓度会影响到外植体形成转化植株[15]。本实验在浓度为OD600= 0.6的农杆菌菌液中浸染10 min,抗性愈伤诱导率最高,达87.25%。

