SA-hIL-21修饰磁珠的合成及其生物学功能的研究
茹道平,高基民
(温州医科大学 检验医学院&生命科学学院,浙江 温州 325035)
癌症已经严重威胁到人类的健康.手术、化疗以及放射疗法等治疗肿瘤的传统方法在应用上都有它们的局限性[1].近年来,随着免疫学和基因工程的不断发展,免疫治疗癌症的方法得到了国内外学者的追捧[2].该方法在临床治疗上显示出了特异性强、靶向性强和持续作用等优点,从而被广泛使用[3].过继性免疫效应细胞疗法(adoptive cell transfer therapy),是一种相对疗效比较好、比较安全的肿瘤免疫疗法.体外扩增免疫细胞是过继性免疫效应细胞疗法的一个重要环节[4].
免疫细胞的增殖、分化和功能受到包括白细胞介素家族在内的一系列细胞因子的调节[5].白细胞介素-21(interleukin-21, IL-21)是一种主要由活化的CD4+T细胞分泌的细胞因子,在人体免疫系统抵御和消灭病毒感染细胞和肿瘤细胞方面起着重要作用[6].IL-21能够诱导肿瘤相关性抗原特异性细胞毒性淋巴细胞(CTL)转变为一种稳定的、非辅助细胞依赖性的细胞表型[7].IL-21也能使人外周血中自然杀伤细胞(NΚ)和 CD8+T细胞中穿孔素、颗粒酶B、干扰素-γ和趋化因子受体3的mRNA表达上调[8].IL-21可以通过维持和增强CD8+T细胞应答实现持久的肿瘤免疫反应而发挥抗肿瘤作用[9].以往的研究表明,IL-21能够有效促进NΚ、CTL等多种淋巴细胞的分化和增殖[10].由于IL-21不会产生活化诱导的细胞死亡(AICD)且能减少抗原特异性T细胞的程序性死亡,与IL-2、IL-15相比,IL-21能更有效持久地增强CTL的胞毒活性[11]和增加抗原特异性CD8+T细胞的数量[12].
IL-21与IL-21R/γc结合后主要通过JAKs-STATs通路发挥生物学功能[10].γc在IL-21R复合物中的细胞内信号转导是必须的[13].依赖于细胞系的不同,IL-21R/γc可以激活不同的下游靶因子包括Jak1、Jak3、Stat1、Stat3、Stat4和Stat5[14].IL-21与IL-21受体的亲和常数Kd为定值时,根据Kd=(CIL-21·CIL-21R)/CIL-21与IL-21R结合物公式,IL-21与IL-21受体的结合随着IL-21浓度增高而增加.然而,提高细胞培养基IL-21的浓度,必然对培养基溶氧量、pH缓冲能力、渗透压以及培养基中其他营养成分造成一定的影响.这些因素有可能限制了IL-21促进其靶细胞增殖的效率.我们猜想: 如果能够实现在细胞表面较小空间范围内富集IL-21,而不是提高整个培养基溶液中IL-21的浓度,就可以突破上述因素的限制,从而可能找到一种更高效的体外扩增免疫细胞方法.
链亲和素(streptavidin, SA)是由Streptomycesavidinii菌分泌的一种非糖基化的蛋白质,它由4条相同的肽链组成,分子量约为66kDa,其氨基酸组成中的丙氨酸和甘氨酸的含量较多,结合生物素的活性基团是肽链中的色氨酸残基.每个SA分子可以结合4个生物素(biotin)分子[15].生物素又称为维生素H,是一种水溶性B族维生素.根据生物素与亲和素之间高亲合力牢固结合的原理[16],我们尝试将SA-IL-21融合蛋白锚定到已生物素化的磁珠上,得到SA-IL-21修饰磁珠,从而探索一种实现在细胞表面较小空间范围内富集IL-21的方法.
外周血淋巴细胞(peripheral blood lymphocyte)是血液循环中的淋巴细胞,主要由T细胞、B细胞和NK等免疫细胞组成.研究表明,外周血单核细胞(PBMC)、T淋巴细胞、B淋巴细胞和NK来源的细胞系均表达IL-21受体.人外周血淋巴细胞可由人外周血分离获得.由于人外周血淋巴细胞主要由表达IL-21受体的免疫细胞组成,并易于获得,人外周血淋巴细胞可作为研究SA-IL-21修饰磁珠促进免疫细胞体外扩增的理想细胞模型.
1 材料与方法
1.1 试剂与材料
pET24a-SA-hIL-21载体,E.coliRosetta(DE3)株,MB49膀胱癌细胞均为本实验室保存.DEAE-Sephrose Fast Flow(DEAE SFF)柱购买于美国GE公司.胰蛋白酶,鼠抗人SA-hIL-21单克隆抗体,羊抗鼠IgG购买于碧云天生物技术研究所.血球计数板购买于德国MARIENFELD公司.人IL-21标准品购买于美国R&D公司.CCK-8检测试剂盒购买于上海圣尔生物科技有限公司.NHS-PEG4-biotin购买于上海恪敏生物科技有限公司.BeaverBeadsTMMag NH2磁珠购买于上海希言科学仪器有限公司.人外周血来源于本实验室志愿者.
1.2 方法
1.2.1 pET24a-SA-hIL-21工程菌发酵培养
取5μL保存于-80℃冰箱中的E.coliRosetta(DE3)菌种接种于5mL含有10μg/mL卡那霉素的LB液体培养基中,放于37℃水平摇床上250r/min培养过夜.然后,取一次活化的菌液5mL再次接种到500mL含有卡那霉素的LB液体培养基中并放于37℃水平摇床上250r/min培养12h.菌液OD600的值达到1.5~2.0时,取500mL菌液接种于10L发酵培养基中,待菌液OD600=3时即进入发酵的诱导阶段,设置诱导阶段的温度为32.5℃,pH=7.0,起始DO 50%,添加终浓度为0.5mmol/L诱导剂IPTG后继续发酵10h,然后结束发酵收集菌液.
1.2.2 SA-hIL-21的纯化与复性
将DEAE SFF柱用平衡液进行2个柱体积的平衡,当流出的液体的pH值稳定时进行上样.将样品以1mL/min的速度泵入DEAE SFF柱中,然后以5mL/min的速度依次泵入复性液和洗脱液进行洗脱.每种液体至少过足2个柱体积.收集洗脱峰蛋白用膜包进行浓缩.然后用10% SDS-PAGE对收集的蛋白进行纯化复性鉴定.
1.2.3 SA-hIL-21对生物素化MB49细胞的锚定率测定
取生长状态比较良好的MB49细胞,用胰蛋白酶消化后制备MB49细胞悬液,再用PBS洗涤3次,稀释细胞浓度为2×106/mL,加入Sulfo-NHS-LC-LC-Biotin使其终浓度为1mg/mL(PBS配制,现配现用),37℃反应1h,PBS洗涤3次后,加入SA-hIL-21融合蛋白,37℃反应1h,PBS洗涤细胞3次,加入鼠抗人SA-hIL-21单克隆抗体(PBS 1∶100稀释),37℃反应0.5h,PBS洗涤细胞3次,加入10μL PE标记的羊抗鼠IgG(PBS 1∶100稀释),37℃避光反应0.5h.离心洗涤后每管取300μL PBS重悬细胞,转入流式检测管,用美国BD FACS Arial流式细胞仪进行分析,测定融合蛋白对生物素化MB49细胞的锚定修饰率.其中空白对照组只加入MB49细胞.
1.2.4 SA-hIL-21刺激外周血淋巴细胞增殖能力的测定
将人外周血淋巴细胞转移入15mL离心管中,1000r/min,离心8min.加入适量的R/MINI-1640完全培养基,重悬细胞,血球计数板计数并调整细胞密度为2×105/mL左右,用排枪依次在96孔细胞培养板中每孔加入100μL的细胞悬液.将复性后的SA-hIL-21融合蛋白和hIL-21标准品分别倍比稀释(2×),每孔加入100μL,每个浓度设3个复孔,其中阴性对照组中加入培养基和细胞,空白对照组只加入培养基.于37℃、5% CO2培养箱培养72h,期间要在日本Nikon TS100倒置显微镜下观察细胞的增殖情况.3d后每孔加入20μL CCK-8,37℃、5% CO2培养箱继续培养3h,Bio-Tek ELx800酶标仪检测450nm下吸光度值(OD450).
1.2.5 SA-hIL-21与磁珠的锚定
吸取6μL浓度为1mol/μL的磁珠溶液置于磁力架上的流式管中,用PBS洗3遍.根据每摩尔磁珠加入200ng生物素的原则,将1.2μg生物素溶于PBS中,配得100μL浓度为12ng/μL的生物素试剂.将配好的100μL生物素试剂加到含磁珠的流式管,室温反应30min.向流式管中加入200μL PBS清洗磁珠,用加样枪轻轻混匀,在磁力架上沉降10min,吸走上清液,注意不要吸走磁珠.重复两次.将SA-hIL-21融合蛋白(浓度1μg/μL)稀释为100ng/μL,即稀释10倍,取原液5μL加入45μL PBS.根据磁珠生物素之比,1mol磁珠需加入100ng蛋白进行反应,因此共需蛋白600ng,即加入配置好的蛋白溶液6μL.加PBS补足50μL体系,反应40min.向流式管中加入200μL PBS清洗磁珠,用加样枪轻轻混匀,在磁力架上沉降10min,吸走上清液,重复两次.
1.2.6 SA-hIL-21对磁珠的锚定率测定
在SA-hIL-21修饰磁珠溶液中加入鼠抗人SA-hIL-21单克隆抗体,按1∶100的比例稀释.37℃反应30min.向流式管中加入200μL PBS清洗磁珠,用加样枪轻轻混匀,在磁力架上沉降10min,吸走上清液,注意不要吸走磁珠.重复两次.向流式管中加入PE标记的羊抗鼠IgG,按1∶100的比例稀释.37℃避光反应0.5h.通过流式细胞仪分析,测定SA-hIL-21融合蛋白对生物素化磁珠的锚定修饰率.其中空白对照组只加入生物素化磁珠.
1.2.7 SA-hIL-21修饰磁珠的生物学活性测定
依次在96孔细胞培养板中用排枪每孔加入100μL的人外周血淋巴细胞悬液.将SA-hIL-21修饰磁珠和hIL-21标准品分别倍比稀释(2×),每孔加入100μL,每个浓度设3个复孔.hIL-21蛋白标准品组最高刺激浓度为0.5μg/mL.由于锚定修饰磁珠时,每摩尔磁珠加入100ng SA-hIL-21融合蛋白,我们设置SA-hIL-21修饰磁珠实验组的最高刺激浓度为5mol/mL.将细胞置于5% CO2、37℃培养箱中培养72h.将孔内的培养基吸走,每孔加入20μL胰蛋白酶,37℃反应2min,加入180μL完全培养基,重悬细胞.SA-hIL-21修饰磁珠组的细胞悬液放到磁力架上磁力沉降磁珠10min,吸走细胞悬液,铺到新的96孔板内.hIL-21标准品组的细胞悬液直接铺板.每孔加入20μL CCK-8试剂,5% CO2、37℃培养箱继续培养3h,用Bio-Tek ELx800酶标仪检测OD450吸收光值.
2 结果与分析
2.1 SA-hIL-21工程菌的制备

图1 IPTG诱导前后菌液蛋白的SDS-PAGEFig.1 SDS-PAGE of proteins’ expression before and after treated with IPTG1. 蛋白质Marker;2. IPTG诱导前;3. IPTG诱导后A;4. IPTG诱导后.
将重组载体pET24a-SA-hIL-21转进感受态细胞E.coliRosetta(DE3)中,培养在含10μg/mL卡那霉素的固体LB培养基中.次日,LB固体培养基上长出若干单克隆菌落.挑取单克隆菌落培养于5mL LB液体培养基中,待培养基OD600达到3后,加入IPTG进行诱导表达.SDS-PAGE电泳结果如图1所示,转入载体pET24a-SA-hIL-21的E.coliRosetta菌株经过IPTG诱导后能大量表达SA-hIL-21(分子量约34kDa),说明已成功制备SA-hIL-21工程菌.
2.2 SA-hIL-21的表达
将SA-hIL-21工程菌进行一次活化和二次活化,将二次活化后的发酵种子液接种到10L发酵罐中发酵培养.期间每隔1.5h取一次样测量菌体的OD600值.菌体生长曲线如图2所示.结果发现菌体在培养4.5h以后,OD600值达到3,即进入IPTG诱导阶段.继续发酵培养,9h后菌体的表达量不再发生改变即判断菌体的生长进入了稳定期,结束发酵并收集菌液[17].将采集的各个时间段的样本与上样缓冲液混匀制备成样品后进行SDS-PAGE电泳鉴定,结果如图3所示.电泳显示在34kDa左右表达有与SA-hIL-21蛋白大小相同的蛋白条带,同时经过称量菌体湿重约为282g.

图2 发酵菌种生长曲线Fig.2 The growth curve of fermentation bacterial species
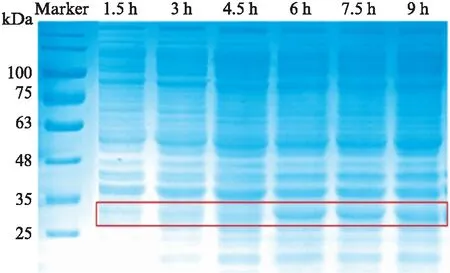
图3 SA-hIL-21蛋白发酵后表达的SDS-PAGE检测Fig.3 SDS-PAGE of SA-hIL-21 expression after fermentation
2.3 SA-hIL-21的纯化与复性
溶解的包涵体离心后,取上清进行DEAE SFF弱阴离子交换纯化,并进行柱上复性.AKTA纯化仪显示有多个较小的穿透峰和一个较明显的洗脱峰,如图4所示.经SDS-PAGE电泳分析,穿透峰多为杂蛋白,洗脱峰主要为目的蛋白,SA-hIL-21融合蛋白主要以多聚体和单体的形式存在.通过RP-HPLC分析,SA-hIL-21融合蛋白的纯度可达到90%以上,如图5所示.通过BCA法测得SA-hIL-21融合蛋白浓度为1mg/mL.

图4 目标蛋白的洗脱曲线Fig.4 The eluting curve of the objective protein

图5 SA-hIL-21融合蛋白的RP-HPLC纯度分析Fig.5 The purity of SA-hIL-21 fusion protein analyzed by RP-HPLC
2.4 SA-hIL-21双功能融合蛋白生物学功能的鉴定
用hIL-21单克隆抗体及FITC标记的二抗,经流式细胞仪检测SA-hIL-21锚定已生物素化MB49细胞的效率.结果显示: SA-hIL-21融合蛋白能锚定修饰表面已生物素化的MB49细胞,锚定效率可达到97.8%,说明获得的SA-hIL-21融合蛋白具备与生物素高亲合力牢固结合的生物学特性,如图6所示.
将复性后的SA-hIL-21融合蛋白和hIL-21标准品分别倍比稀释(2×),分别对体外培养的外周血淋巴细胞进行刺激.培养72h后用CCK-8法检测细胞活性,检测所得OD450值应用GraphPad Prism5软件分析,根据量-效关系方程,将SA-hIL-21融合蛋白组及hIL-21蛋白标准品组促进外周血淋巴细胞增值的实验数据进行拟合,直接得到了二者对外周血淋巴细胞的增值率的量-效曲线,如图7见第196页所示.分析得到: hIL-21蛋白标准品的半数有效浓度EC50=1.154;SA-hIL-21融合蛋白的半数有效浓度EC50=1.334.
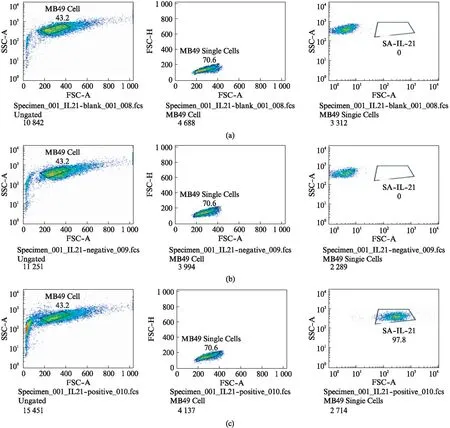
图6 流式细胞术检测SA-hIL-21对生物素化MB49细胞的锚定效率Fig.6 Modified rate of SA-hIL-21 on biotinylated MB49 cells by FACS(a): MB49细胞;(b): MB49细胞+SA-hIL-21;(c): MB49细胞+生物素+SA-hIL-21.
2.5 SA-hIL-21对磁珠的锚定率
孵hIL-21抗体及FITC标记的二抗后,经流式细胞仪检测SA-hIL-21融合蛋白锚定已生物素化磁珠的效率.结果显示: SA-hIL-21融合蛋白能锚定修饰表面已生物素化的磁珠,锚定效率可达到87.0%,大部分的磁珠上已经修饰了SA-hIL-21融合蛋白,说明我们已经成功得到了SA-hIL-21融合蛋白修饰磁珠,结果如图8见第196页所示.
2.6 SA-hIL-21修饰磁珠促进人外周血淋巴细胞增殖的能力
细胞培养72h后,镜下观察加入SA-hIL-21修饰磁珠组及SA-hIL-21标准蛋白组均有促进细胞增殖的作用,且其增值程度呈现梯度变化,重复组之间未发现有明显差异.除去磁珠,加入CCK-8后3h,肉眼观察加入SA-hIL-21修饰磁珠组及SA-hIL-21标准蛋白组从第一个孔到最后一孔颜色逐渐变浅,呈梯度变化.将hIL-21蛋白标准品组及SA-hIL-21修饰磁珠组促进外周血淋巴细胞增值的实验数据进行拟合,直接得到了二者对外周血淋巴细胞的增值率的量-效曲线,结果如图9见第196页所示.Top值是药物浓度处于最佳刺激浓度时产生的最大效应.根据GraphPad Prism5软件分析,hIL-21蛋白标准品组的Top值为1.332;SA-hIL-21修饰磁珠组的Top值为1.797.

图7 SA-hIL-21融合蛋白的生物学活性测定Fig.7 Bioactive assays of SA-hIL-21 fusion protein

图8 SA-hIL-21对生物素化磁珠锚定效率Fig.8 Modified rate of SA-hIL-21 on biotinylated magnetic beads


图9 hIL-21标准蛋白组与SA-hIL-21修饰磁珠组的量-效曲线Fig.9 Dose-dependence curve of hIL-21 protein and magnetic beads
3 讨 论
我们利用生物素-链亲和素高亲和力紧密结合的原理,将同时具有SA和hIL-21生物学活性的SA-hIL-21融合蛋白锚定到生物素化的磁珠上.经流式细胞仪检测,SA-hIL-21融合蛋白能锚定已生物素化的磁珠,锚定效率可达到87.0%,即是87.0%的磁珠上已经修饰了SA-hIL-21融合蛋白,说明我们已经成功得到了SA-hIL-21融合蛋白修饰磁珠.
我们分别用获得的SA-hIL-21修饰磁珠和hIL-21标准蛋白去刺激外周血淋巴细胞增殖.hIL-21标准蛋白组设置了2-1~2-7μg/mL 7个梯度浓度.由于SA-hIL-21锚定修饰磁珠时,磁珠: SA-hIL-21融合蛋白=1mol∶0.1μg,5mol/mL磁珠理论上结合了0.5μg SA-hIL-21融合蛋白.因此,我们设置了SA-hIL-21修饰磁珠组5×20~5×2-6mol/mL 7个梯度浓度,与hIL-21标准蛋白组相对应.磁珠修饰的过程中,不可能所有加入的SA-hIL-21融合蛋白都能结合到磁珠上,必然存在部分SA-hIL-21融合蛋白丢失.因此,5mol/mL SA-hIL-21修饰磁珠上实际结合的SA-hIL-21融合蛋白必然少于0.5μg,依次类推,SA-hIL-21修饰磁珠组各个梯度浓度中的实际蛋白量少于理论.尽管如此,我们由图9可以看到,SA-hIL-21修饰磁珠组各个梯度浓度的效应均强于对应的hIL-21标准蛋白组各个梯度浓度的效应.最重要的是,当SA-hIL-21修饰磁珠浓度处于最佳刺激浓度时促进外周血淋巴细胞的增殖的最大效应比hIL-21标准蛋白的最大效应强56.59%.
SA-hIL-21修饰磁珠促进外周血淋巴细胞的增殖的最大效应强于hIL-21标准蛋白有以下3方面原因.其一,细胞培养基hIL-21的浓度提高到一定程度,必然对培养基溶氧量、pH缓冲能力、渗透压以及培养基中其他营养成分造成一定的影响.这些因素有可能限制了hIL-21促进其靶细胞增殖的效率,细胞增殖不再随着hIL-21的浓度的提高而增强.SA-hIL-21修饰磁珠,实现在细胞表面较小空间范围内富集hIL-21,而不是提高整个培养基溶液中hIL-21的浓度,就可以突破上述因素的限制,从而可以在体外更高效地促进hIL-21靶细胞的增殖.其二,与游离的hIL-21蛋白相比,锚定在磁珠上的SA-hIL-21活动的空间范围受到限制,与IL-21受体结合后不易于解离.因此,SA-hIL-21修饰磁珠能够更持久、稳定地促进靶细胞的增殖.其三,SA-hIL-21修饰磁珠与靶细胞接触可能可以模拟细胞胞间接触,从而促进外周血淋巴细胞的增殖和分化.细胞胞间接触和相互作用在免疫细胞的增殖和分化过程中发挥着重要的作用,尤其是T细胞和Nκ细胞.因此,SA-hIL-21修饰磁珠可能通过模拟细胞胞间接触的方式促进外周血中的T细胞和Nκ细胞的增殖和分化.
IL-21的靶细胞包括多种免疫应答中发挥重要作用的免疫细胞,例如T细胞、B细胞、NK细胞等[18].SA-hIL-21修饰磁珠的获得有望进一步改进体外扩增以上免疫细胞的方法,从而对过继性免疫效应细胞疗法的发展具有重要意义.同时,SA-hIL-21修饰磁珠的获得有助于其他细胞因子锚定修饰磁珠的研究,为以后将一种或同时多种细胞因子锚定到磁珠上提供经验.
综上所述,我们成功获得了锚定率达到87.0%的SA-hIL-21融合蛋白修饰磁珠,并测得所得的SA-hIL-21融合蛋白修饰磁珠能够高效促进外周血淋巴细胞的增殖,其最大效应比hIL-21标准蛋白的最大效应强56.59%.我们发现了一种比以往更高效体外扩增外周血淋巴细胞的方法,为后续体外大规模培养外周血中某种或多种免疫细胞及与hIL-21靶细胞相关的免疫疗法奠定了基础,也为锚定修饰其他磁珠提供经验.

