硝化抑制剂对酸性红壤硝化作用及氨氧化微生物丰度和群落结构的影响
黄 琼,王 庆,吴启华,李 爽,黄 莹,陈迪文,江 永
(1广东省生物工程研究所(广州甘蔗糖业研究所) 广东省甘蔗遗传改良与生物炼制重点实验室,广东广州510316;2国家糖业质量监督检测中心,广东广州510316)
0 引言
硝化过程是指在有氧条件下由硝化微生物参与将 NH3氧化生成 NH2OH和 NO2-,然后氧化生成NO3-的过程。氨氧化过程是硝化过程的限速步骤,它是指在 amoA基因编码的氨单加氧酶(Ammonia monooxygenase,AMO)的催化下由氨氧化微生物(AOA和AOB)将NH3转化成NO2-的过程[1]。氨氧化细菌(AOB)大都属于 β-或者 γ-变形菌纲,而氨氧化古菌(AOA)则属于奇古菌门[2]。N2O是硝化过程的副产物,它的温室效应大约是CO2的300倍,引发全球变暖,它同时也是一种能破坏大气臭氧层的重要的痕量气体[3]。硝化过程不仅影响土壤氮素供应以及植物的吸收利用,而且过量施用氮肥还会导致土壤酸化,硝化过程产生的NO3-通过地下水渗透以及地表径流能够污染水源,危害人类健康。据报道,到 2030年为止,农业生产中氮肥的使用将会增加35%~60%[4]。因此,人们迫切需要探明土壤硝化过程作用机理并寻求一种有效的减排措施用于减少氮肥使用带来的环境问题以及经济损失。
在农业生产过程中,氮肥中添加硝化抑制剂可减缓铵态氮在土壤中的氧化过程,对于提高氮肥利用率,降低环境污染风险具有重要的意义。大量研究显示,硝化抑制剂不仅可显著降低土壤硝化作用速率和硝态氮累积,减少土壤中硝态氮的淋溶损失,而且可减少N2O等温室气体的释放[5-6]。目前常用的硝化抑制剂有双氰胺(DCD)和乙炔(C2H2)等。DCD是一种铜离子螯合剂,它能有效地结合氨单加氧酶(AMO)从而使其失去活性。但是它的抑制效果受多种因素的影响如土壤类型[7]、温度[8]和水分等[9]。C2H2被称为“自杀性”底物,在低浓度(10 Pa)时就可通过与NH3竞争性的与AMO相结合来抑制自养硝化作用[10]。已有报道发现在酸性土壤中C2H2对硝化作用的抑制效果非常明显[11],但是它在不同类型土壤中的作用是否保持高效仍旧少有报道。此外,土壤类型和 pH是影响氨氧化微生物分布的重要因素[12]。Jia和Shen研究发现在中碱性土壤中AOB对硝化过程起主导作用,乙炔显著抑制了 AOB的活性[13-14]。Gubry-Rangin和Zhang研究发现在酸性红壤中AOA是硝化过程的主要参与者,DCD和C2H2处理抑制了AOA的生长,土壤类型可能是影响硝化抑制剂作用效果的关键因素[15]。
本研究选取南方典型旱地土壤(红壤)开展为期28天的室内培养实验。运用定量PCR技术和末端限制性片段多态性(T-RFLP)分析技术研究氨氧化微生物群落丰度和群落结构,结合培养过程中硝化速率变化,比较不同硝化抑制剂(DCD和C2H2)对酸性土壤硝化过程的作用机制。
1 材料与方法
1.1 土壤样品
微宇宙室内培养实验选取了湖南祁阳地区(26˚24΄26˝ N,112˚00΄45˝ E)典型酸性旱地土壤(红壤),该地区为亚热带湿润季风性气候,年平均降雨量为1288 mm,年平均温度18.1℃。在每个地点,分别在土壤表层(0~15 cm)采集10个土样,混合后过2 mm筛,并保存于4℃冰箱以备微宇宙培养实验用。另外部分样品在实验室风干后用于土壤理化性质测定。
1.2 土壤基本理化性质测定
土壤pH值(土壤和水的比值为1:2.5)使用Detla 320 pH 仪(Mettler-Tolede Instruments Co.,Shanghai,China)测定。土壤总氮(TN)和总碳(TC)采用杜马斯燃烧法利用元素分析仪(Vario EL III,Elementar,Hanau,Germany)测定。土壤铵氮(NH4+-N)和硝氮(NO3--N)浓度采用2 mol/L KCl溶液浸提并利用连续流动分析仪测定(AA3,SEAL analytical)。土壤有机碳(Soil organic carbon,SOC)含量采用低温外热重铬酸钾氧化比色法进行测定。土壤质地采用快速筛分法进行测定。红壤的基本性质:pH:6.2;SOC含量:22.4 g/kg;TN含量:1.51 g/kg;NH4+-N含量:3.0 mg/kg;NO3--N含量:27.8 mg/kg;土壤质地:砂粒4.3%,粉粒53.2%,粘粒42.5%。
1.3 试验设计
培养实验中,称取相当于20 g干土重的土壤样品至120 mL玻璃血清瓶中。向土壤中添加适量的灭菌去离子水,使土壤含水量达到40% WFPS,放置于25℃培养箱中黑暗培养7天。本实验设置如下4个处理:对照(Control);(NH4)2SO4(NH4+);(NH4)2SO4+DCD (NH4++DCD);(NH4)2SO4+C2H2(NH4++C2H2),其中硫酸铵的施用量是150 mg/kg,DCD的施用量为铵氮施用量的 10%,C2H2的添加量是0.1%(v/v)。每个处理设置3个重复。在进行正式培养时,将处理所需的硫酸铵和DCD溶解于灭菌去离子水中并均匀滴加于土壤表面,最后补充水分使土壤含水量达到55% WFPS。对于乙炔处理的样品,首先我们把所需要的硫酸铵溶于灭菌去离子水中,然后调节土壤水分使之达到55% WFPS,最后盖上胶塞密封好后加入低浓度的乙炔(0.1% v/v),并在30℃培养箱中黑暗培养28天。在培养过程中每隔2~3天打开瓶塞通气20 min,然后补充水分和乙炔。在培养开始后的0、7、14、28天进行土壤破坏性采样。大约10 g土壤用于NH4+-N和NO3--N的浸提与分析。剩余土样用于土壤 DNA提取和后续分子实验。
根据Persson和Wiren(1995)提出的用于计算净硝化速率的方程[16]。我们计算了前7天、14天和整个28天的土壤净硝化速率。

注:(NO3--N)d0,(NO3--N)d7,(NO3--N)d14和(NO3--N)d28分别是第0、7、14和28天土壤NO3--N的浓度。
1.4 土壤DNA提取和定量PCR分析
使用 MoBio PowersoilTMDNA提取试剂盒(MoBio Laboratories Inc,Carlsbad,CA)对 DNA 进行提取,每个样品称取0.4 g土壤。DNA的浓度和纯度采用 Nanodrop ND-1000 (NanoDrop Technologies,Wilmington,DE,USA)测定。DNA样品保存在-80℃备用。
定量PCR在Bio-Rad CFX96 optical定量PCR仪(Bio-Rad,USA)上进行,数据由软件Bio-Rad IQ5 V2.0 进行分析。所有样品都做了 3个重复。AOA定量 PCR引物为 CrenamoA23f/CrenamoA616r[17],AOB的定量PCR引物为amoA-1F/amoA-2R[15]。反应体系为 25 µL,包含 12.5 µL SYBR Premix Ex Taq(TaKaRa Biotechnology,Otsu,Shiga,Japan),0.5 µL 的前后引物(10 µM),2 µL 5 倍稀释的 DNA模板(1~10 ng)。PCR反应条件为:94℃预变性 5 min,95℃变性 30 s,55℃(AOA)和 57℃(AOB)退火30 s,72℃延伸1 min;83℃收集数据15 s。每轮定量PCR扩增完成后通过溶解曲线和琼脂糖凝胶电泳检测扩增产物的特异性。
1.5 末端限制性片段多态性分析(T-RFLP)
AOA和AOB的群落结构T-RFLP技术进行分析,所用引物分别为 CrenamoA23f(FAM-labelled)/CrenamoA616r和amoA-1F(FAM-labelled)/amoA-2R。反应体系(50 µL)包括:25 µL 2× Premix Taq,2 µL 5倍稀释的DNA模板(1~10 ng),正反向引物各1µL,最后加灭菌去离子水补足至 50 µL。对于 AOA和AOB,PCR扩增程序为95℃ 5 min,95℃ 40 s,55℃ 30 s,72℃ 1 min,最后再72℃延伸8 min。每个基因的 PCR产物通过 Wizard SV Gel and PCR Clean-Up System(Promega,SanLuis Obispo,CA,USA)纯化回收,然后采用限制性内切酶进行酶切。AOA amoA基因 PCR产物采用 HpyCH4Ⅴ酶切,AOB amoA基因采用RsaⅠ酶切。酶切体系为20 µL,大约包括200 ng PCR产物、10 U的限制性内切酶、0.2 µL 的 BSA 和 2 µL 10×NEB buffer。酶切体系在37℃条件酶切1 h,65℃使内切酶失活,然后送至测序公司测序。获得的数据使用Peak Scan 2.0(Applied Biosystems,Inc)软件进行 T-RFLP图谱分析,所选的片段限于50~600 bp之间。每个样品中低于最高峰高值2%的峰从后续分析中剔除,片段长度差异小于2 bp的2个峰合并为1个峰进行分析。
1.6 统计分析
AOA和AOB amoA基因的丰度转化成对数进行后续分析。不同处理之间 amoA基因拷贝数和净硝化速率的差异显著性通过单因素方差分析(ANOVA)进行检验。所有统计分析使用 SPSS 19.0软件(IBM Co,Armonk,NY,USA)实现。Spearman相关分析用于分析amoA基因拷贝数和NO3--N浓度之前的关系。P<0.05表示他们之间相关性极显著。不同处理之间微生物群落结构的差异通过计算基于不同TRFs相对丰度的Bray-Curtis相似性指数进行表示,然后利用主坐标分析(PCoA)对样品之间的Bray-Curtis相似性指数进行可视化分析。
2 结果分析
2.1 NH4+-N和NO3--N以及净硝化速率的动态变化
在红壤中,对照处理的土壤 NH4+-N浓度在整个培养过程中保持在很低的水平,并且大约维持在3 mg/kg保持不变(图 1A)。硫酸铵处理的土壤NH4+-N浓度随着培养时间的延长而降低。NH4+-N的浓度在第7天时从147.5 mg/kg (m氮/m土壤)降低至102.6 mg/kg (m氮/m土壤),并且NH4+-N的浓度在培养结束时(28天)降低至最低水平。硝化抑制剂DCD和C2H2处理显著地抑制NH4+-N的降低,但是这2种硝化抑制剂的抑制效果存在明显差异。乙炔处理土壤的 NH4+-N浓度没有减少,由于土壤矿化产生的氨源源不断地释放出来,反而增加了土壤 NH4+-N的浓度,而DCD的添加显著地减缓了NH4+-N的消耗速度。
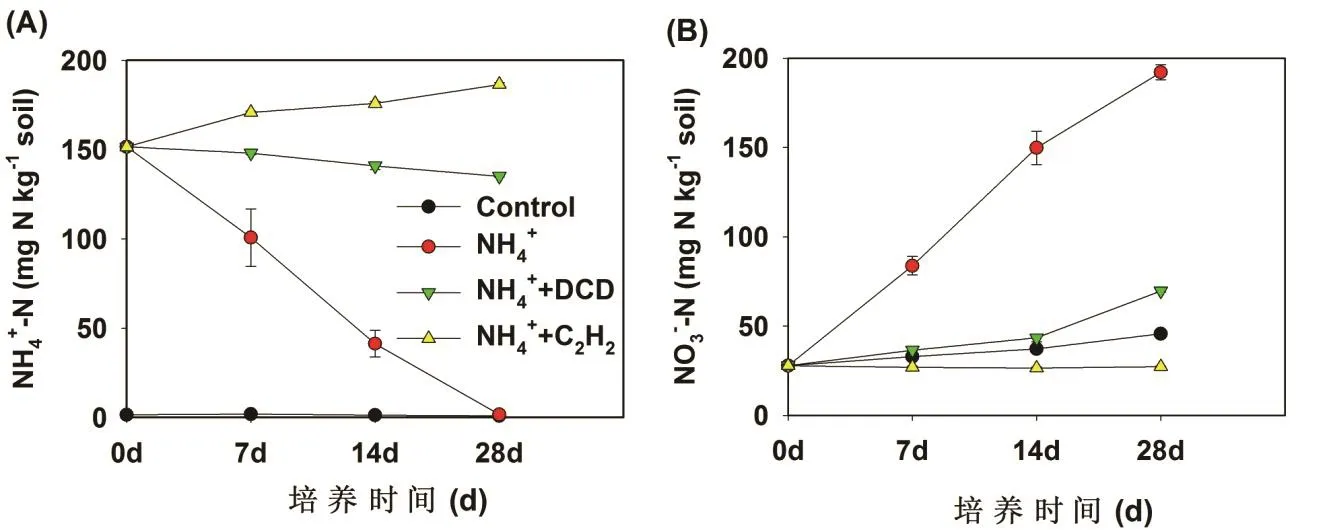
图1 红壤(A,B)中铵氮和硝氮在不同处理中的动态变化
在红壤中,对照处理下NO3--N的浓度随着培养时间的进行而逐步的增加,这是由于有机氮矿化产生的NH3被氧化成NO3--N(图1B)。硫酸铵的添加显著地增加了NO3--N的浓度,并且NO3--N的增加与NH4+-N的降低同时发生,处于此消彼长的动态变化过程。硝化抑制剂的添加明显地抑制了NO3--N的生成,C2H2和DCD处理的NO3--N含量变化有所差异,C2H2处理完全阻止了NO3--N的增加,而DCD处理
减缓了NO3--N的增加。硫酸铵添加处理的净硝化速率在第7天时达到9.16 mg/kg/d,DCD处理的土壤硝化速率大约是1.53 mg/kg/d,DCD的抑制效率大概在83.30%(表1)。在整个培养过程中,DCD的抑制率大约是 72.70%。C2H2处理完全抑制了硝化过程,抑制率达到100%。因此,相对DCD来说,C2H2是一种抑制作用更强的硝化抑制剂。
2.2 AOA和AOB amoA基因丰度的变化
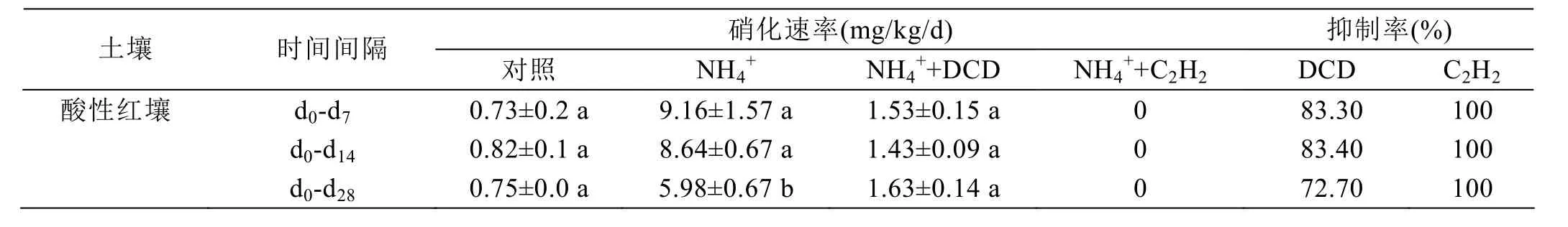
表1 红壤中硝化抑制剂对硝化活性的抑制效果
本文分别以培养第0、7和28天的土壤样品作为研究对象,测定氨氧化微生物功能基因的丰度,比较了不同培养时间和不同处理中 AOB和 AOA amoA基因丰度变化(图2)。培养初期添加硫酸铵处理的 AOB amoA基因丰度显著高于对照处理(P<0.01),但是硝化抑制剂C2H2与DCD的添加均显著降低了AOB amoA基因丰度(P<0.01)。硝化抑制剂处理下AOB amoA基因丰度在整个培养过程中与对照相比没有明显差异(图2A)。
AOA amoA基因丰度均高于AOB amoA基因丰度。对照处理中AOA可以利用土壤有机氮矿化产生的微量的NH3作为底物生长,因此,AOA amoA基因丰度在整个培养过程中逐渐的增加,而硫酸铵的添加显著地降低了AOA amoA基因丰度。AOA amoA基因丰度在DCD和C2H2处理之间没有明显差异(图2B)。
我们将AOB和AOA amoA基因丰度与NO3--N浓度进行线性回归分析,结果显示AOB amoA基因丰度与NO3--N浓度呈极显著正相关关系(r=0.64,P<0.001)(图3A)。而AOA amoA基因丰度与NO3--N浓度呈极显著负相关关系(r=-0.43,P<0.05(图3B)。结果说明在硫酸铵处理下 AOB是土壤硝化过程发生的主要驱动者。
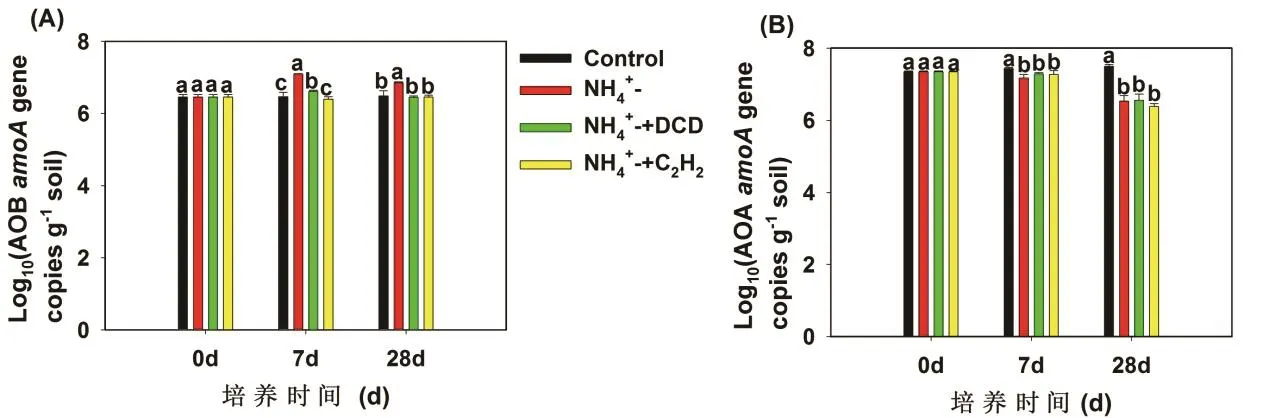
图2 红壤中AOA(A)和AOB(B) amoA基因丰度的动态变化
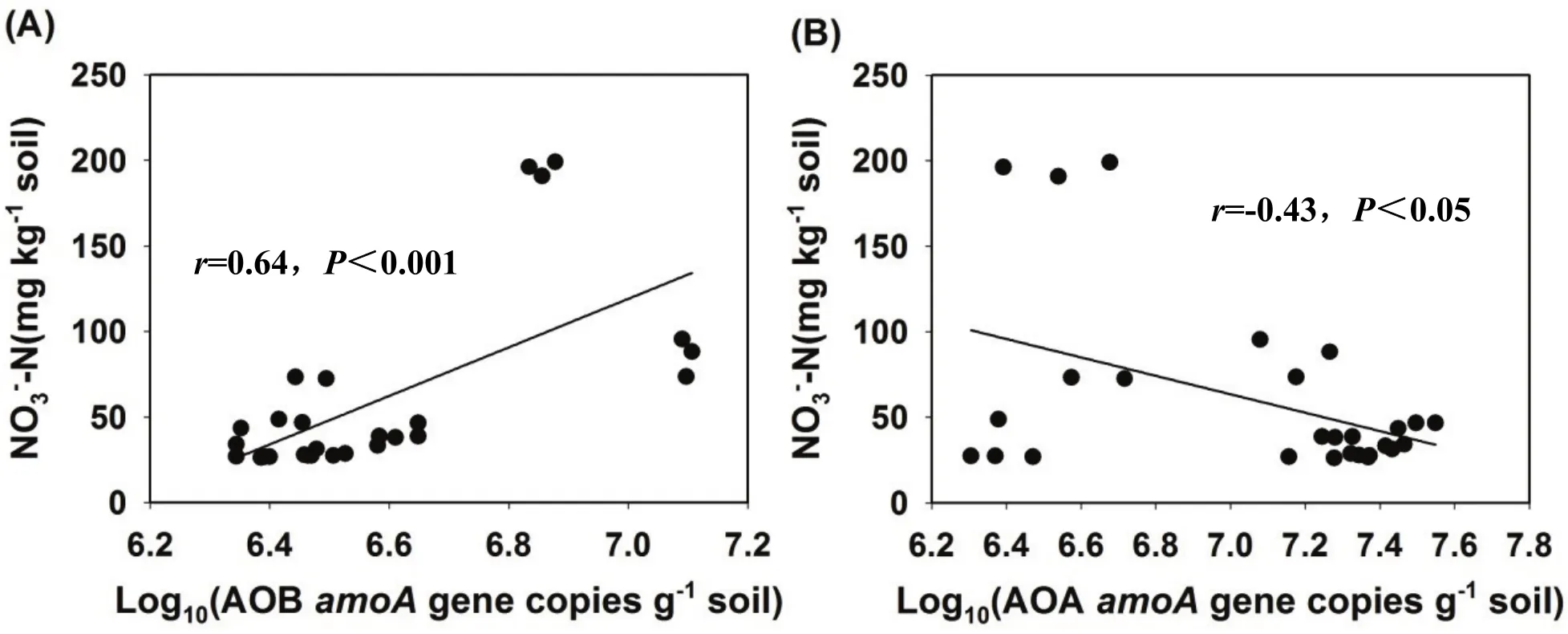
图3 红壤(A,B)中NO3-浓度和AOA以及AOB amoA基因丰度之间的关系
2.3 AOB和AOA群落结构分析
在培养结束后,AOB和AOA的群落结构使用T-RFLP手段进行分析(图4)。在红壤中,AOB amoA基因的PCR产物采用RsaⅠ限制性内切酶进行酶切分析,分别能够得到5个不同的TRFs类型(图4A)。在红壤中,TRF-211、TRF-251和TRF-255是最主要的片段类型。研究发现不同AOB TRFs对氮肥的影响不同,例如红壤中TRF-255和TRF-270的相对丰度在是施氮处理中显著增加,而 TRF-211、TRF-251则显著降低。基于不同AOB TRFs相对丰度的 Bray-Curtis指数分析发现硫酸铵处理对 AOB群落结构具有明显影响(图5A)。而硝化抑制剂处理的土壤 AOB的群落结构与对照处理之间没有显著差异。
在 HpyCH4V限制性内切酶的作用下,AOA amoA基因PCR产物被酶切成8个不同的TRFs类型,其中TRF-76、TRF-156和TRF-166是最主要的3个片段类型(图 4B)。与对照相比,硫酸铵处理的TRF-76、TRF-156和TRF-218片段类型丰度显著增加,而TRF-90、TRF-166和TRF-204片段类型丰度显著减少。硝化抑制剂处理的AOA amoA TRFs片段类型的相对丰度与对照处理相比没有显著差异,这说明硝化抑制剂施用没有改变AOA的群落结构。基于不同AOA TRFs相对丰度的Bray-Curtis指数分析发现硫酸铵处理与其他处理中的 AOA群落结构明显不同(图5B)。与对照相比,硝化抑制剂处理对土 壤AOA群落结构没有显著影响。

图4 不同处理下AOB(A)和AOA(B) amoA基因末端限制性片段(T-RF)的相对丰度

图5 基于主坐标(PCoA)的氨氧化细菌(A)和古菌(B)群落结构分析
3 讨论
3.1 硝化抑制剂DCD和C2H2对酸性土壤硝化速率的影响
NH4+作为硝化作用的第一步氨氧化作用的底物,可通过硝化微生物的作用转化成NO3-。在选择研究的红壤中,硫酸铵处理下 NH4+的减少伴随着NO3-的增加,这说明土壤发生了硝化反应。硝化抑制剂DCD或C2H2处理有效抑制了NH4+转化为NO3-的过程,但是这2种硝化抑制剂的抑制效果有所不同。DCD处理部分抑制了硝化反应的进行,NH4+缓慢降低,NO3-逐步升高。而C2H2处理则完全抑制了土壤硝化反应的发生,由于有机氮矿化产生大量的NH3无法被利用,因而累计下来导致NH4+浓度的升高,而NO3-的浓度保持不变,C2H2对硝化过程的抑制效果要显著强于DCD。这可能归因于以下几点原因:首先,C2H2是一种自杀性底物,它能够和NH3竞争性的与氨氮加氧酶(AMO)相结合,从而达到抑制氨氧化过程的目的。已有报道发现低浓度的乙炔(10 Pa)能够 100%的抑制自养硝化过程并且持续很长时间[2,20]。其次,DCD极易溶于水以及在土壤剖面中移动性强而易发生与NH4+分离的现象,进而影响其硝化抑制效果[18],而且它可作为氮源被微生物利用,当土壤温度高于25℃时,极易发生微生物的降解现象[19]。在本研究中,培养温度设置的是30℃,我们推测DCD的生物降解可能是其低有效性的一个原因[20]。
3.2 硝化抑制剂 DCD和 C2H2对酸性土壤氨氧化微生物丰度的影响
氨氧化过程由AOA和AOB参与完成,而究竟谁在其中扮演更加重要的角色仍旧是讨论的焦点,这可能与某种土壤中硝化抑制剂的有效性有关。在本研究的酸性农田土壤中,AOA的丰度要明显高于AOB的丰度,这与之前的报道相一致[21]。先前的研究表明影响 AOA和 AOB分布的主要因素有 pH、水分、土壤类型以及土壤铵氮含量等。本研究发现施铵氮肥刺激了 AOB而不是 AOA的生长,导致AOB amoA基因丰度增加。Di和Jia指出适合AOB和AOA生长的土壤铵氮浓度不同,AOB生长在高铵氮环境,在营养丰富的中碱性土壤中丰度较高,是硝化作用的主要参与者[9,13];而AOA更加倾向于营养贫瘠的低铵氮与低 pH的环境,它主要利用土壤有机氮矿化释放的少量的NH3生长,高铵氮环境反而抑制 AOA的活性[22-23]。在本实验选择的红壤中,硫酸铵的施加降低了AOA amoA基因丰度。此外,分析结果显示 AOB amoA基因丰度与 NO3--N浓度具有极显著的正相关关系,我们还发现AOA的丰度与NO3--N浓度呈显著负相关。这表明AOB与硝化作用速率的关系比AOA更紧密,这也与已有研究指出的农田土壤氨氧化作用是由AOB而非AOA主导的观点一致[13]。此外,C2H2对 AOB丰度的抑制效果要明显高于DCD,而硝化抑制剂对AOA丰度没有显著影响。Shen推测与AOB相比,AOA对硝化抑制剂并不敏感,这是由于它们在细胞结构和代谢途径上存在明显的差异[24]。在本研究中,硝化抑制剂通过抑制AOB的生长而抑制硝化过程。本研究初次发现与 DCD相比,C2H2对硝化过程以及AOB的丰度表现出更强的抑制效果。
3.3 硝化抑制剂 DCD和 C2H2对酸性土壤氨氧化微生物群落组成的影响
在本研究中,T-RFLP和PCoA分析发现施氮改变了AOA的群落结构,这一结果表明氮肥浓度可能是影响氨氧化微生物群落结构的重要因素。硝化抑制剂乙炔和DCD的添加并没有显著影响AOA的群落组成。Gong研究发现AOA的群落对硝化抑制剂DCD或DMPP响应并不明显[7]。
T-RFLP和PCoA分析还发现施氮改变了AOB的群落结构。然而,Avrahami则发现在硫酸铵处理下培养4~6周,农田土壤中AOB的群落结构并没有显著变化[25]。我们认为导致这一差异的原因是高浓度的铵氮肥能够刺激AOB的生长从而改变AOB的群落结构[5,13]。但是硝化抑制剂 DCD和 C2H2处理并没有显著影响 AOB的群落组成。O’Callaghan同样也发现草原土壤中 AOB的群落结构对氮肥和硝化抑制剂的处理没有显著的响应[26]。已有研究发现硝化抑制剂对 AOB群落的影响与土壤类型有关[7,27]。
4 结论
本研究比较了硝化抑制剂DCD和C2H2对土壤硝化过程以及氨氧化微生物丰度与群落结构的影响。结果发现硫酸铵处理刺激了土壤硝化过程,硝化抑制剂处理显著抑制了硝化作用并且 C2H2对硝化过程的抑制比DCD更强。本研究还发现AOB的丰度与NO3-浓度呈显著正相关关系。硫酸铵处理显著改变AOB和AOA的群落组成。然而,硝化抑制剂处理对氨氧化微生物群落结构没有影响。这些结果表明AOB是土壤硝化过程的主要参与者,硝化抑制剂通过抑制AOB的生长从而抑制硝化过程。

