CCL23在肝细胞癌中的表达及其对预后的影响
汪建业 赵之聪 侯嘉杰 夏强
趋化因子在多种生物学过程中发挥着重要作用,例如白细胞转移、免疫应答、细胞迁移和细胞增殖等[1,2]。近年来,趋化因子在肝癌中的作用受到广泛关注,它们一方面可以募集免疫细胞增强免疫反应发挥抗肿瘤作用,另一方面也可以促进肿瘤的增殖、迁移和侵袭。CCL23(又称MPIF-1,MIP-3或CKβ-8)基因位于染色体17q12,最早是从人主动脉内皮细胞和人单核细胞系THP-1中发现的,在多种组织中表达,包括阑尾,结肠和胆囊等。它通过受体CCR1对单核细胞、树突状细胞和T淋巴细胞具有趋化活性,并对粒-单核系祖细胞的增殖具有抑制作用[3-5],但CCL23在恶性肿瘤中的作用鲜有报道。本研究从公用数据库中筛选出在肝癌和癌旁肝组织中表达差异明显的CCL23,通过实时荧光定量PCR及免疫组织化学法进一步验证CCL23在肝癌组织中的表达。
资料和方法
一、基于肝细胞癌的数据分析
通过GEO数据库(https://www.ncbi.nlm.nih.gov/geo/)检索并下载公共肝癌芯片数据(GSE14520,GSE25097,GSE57957,GSE57958,GSE64041),TCGA-LIHC数据库获取(http://tcgadata.nci.nih.gov)374例肝癌及50例正常肝组织基因表达谱,通过Perl语言生成“基因表达矩阵文件”,并分析相关基因变化。
二、临床样本选取及随访
收集2014年2月至2016年2月上海交通大学医学院附属仁济医院的196例行根治性肝切除术的肝癌患者组织标本及临床病理资料,并制作肝癌组织芯片。另外随机选择82个HCC组织标本,同时选取配对的癌旁正常组织标本。肝癌组织选择:①术前临床诊断为原发性肝癌及术后病理确诊为肝细胞肝癌;②临床病理资料完整;③癌旁正常组织距肝癌组织>2 cm。④排除非肿瘤原因死亡者。术后以门诊和电话形式进行随访,从手术日开始计算存活时间和无复发存活时间。
三、免疫组织化学
将组织芯片脱蜡,水合,通过柠檬酸盐抗原修复溶液(用PBS稀释)在微波条件下修复,CCL23单克隆抗体(英国Abcam公司,ab171751)以1∶100稀释,并用1%BSA稀释为阴性对照,辣根过氧化物酶标记的山羊抗兔的二抗(购自美国Jackson公司)以1∶200稀释。染色评估:使用Image pro plus 软件读取图像IA值,并根据IA值来评价肝组织中的CCL23的表达强度。
四、实时荧光定量聚合酶链反应
随机选择82对癌与癌旁组织。根据Biotech RNA提取试剂盒说明书提取总RNA,并反转录成互补的脱氧核糖核酸(cDNA)。Nanodrop 2000分光光度计(Thermo Scientific,美国)测量RNA浓度及纯度,并根据SYBR Green I Master Mix方案,反应体系10 μL,β-actin作为内参进行实时荧光定量PCR。 PCR:95℃ 5 min; 95℃ 10 s,60℃ 30 s,72℃ 20 s,40个循环; 95℃,5 s,65℃,1 min。引物序列为: CCL23正向引物:5′-CATCT-CCTACACCCCACGAAG-3′,反向引物:5′-GGGT-TGGCACAGAAACGTC-3′;β-actin正向引物:5′-GGGAAATCGTGCGTGACAT-TAAG-3′,β-actin反向引物:5′-TGTGTTGGCGTA-CAGGTCTTTG-3′。
五、统计分析
使用GraphPad Prism 7.0或SPSS 23.0软件进行统计学分析。配对t检验用于分析肝癌及癌旁组织中CCL23表达的差异,Kaplan-Meier和Log-rank检验用于生存分析,单因素和多因素Cox回归模型用于分析CCL23表达水平对于预后的影响,卡方检验用于分析CCL23表达水平与临床病理学特征之间的关系。P<0.05为差异有统计学意义。
结 果
一、不同趋化因子在肝癌中的表达
为了筛选出在肝癌发展中起重要作用的趋化因子,研究了GSE25097队列以及TCGA中所有趋化因子基因的表达谱,将配对肝癌和癌旁的表达谱进行差异表达分析,结果显示,与正常组织相比,GSE14520及TCGA数据库中分别有35、38种趋化因子基因表达发生显著下调。见表1。在这两个队列中,除去CXCL14后(其在数据库中对患者总体预后影响并不明显),CCL23的差异倍数(foldchange, FC)及差异的显著性变化都最为明显(TCGA:FC=0.132873932,P值=2.31217E-88; GSE25097:FC=0.130784185,P值=1.15E-72)。
二、CCL23在公共数据库中的表达、与临床病理相关性及患者预后的关系
进一步验证队列(GSE57957,GSE64041)发现CCL23在肝癌组织中的表达普遍下调(所有数据经标准化处理)(图1 A)。在TCGA以及GSE14520队列中,将患者分为高表达和低表达组,并绘制Kaplan-Meier曲线,结果提示,CCL23高表达组的总体生存率(TCGA:P=0.0026,GSE14520:P=0.0014)(图2 B)和无复发生存率(TCGA:P=0.0306,GSE14520:P=0.0189)(图1 C)均显著延长。其与临床病理指标构建四个表并做卡方检验发现,肝癌中的CCL23表达水平仅与肿瘤数目(P=0.019)明显相关。此外,在GSE14520队列中,通过单因素及多因素分析发现,CCL23表达水平(P=0.002)、肝硬化(P=0.020)和BCLC分期(P<0.01)是总生存时间的影响因素,而CCL23表达水平(P<0.01)和性别(P=0.024)是影响肝癌患者无瘤生存时间的影响因素。见表2,3。

表1 公共数据库中趋化因子基因差异表达
三、CCL23在肝癌患者中的表达及与患者预后的关系
通过qRT-PCR对82例肝癌及配对癌旁组织中进一步验证CCL23 mRNA的表达水平,结果显示肝癌组织中CCL23表达明显低于癌旁组织(P<0.01)(图2 A)。此外,通过免疫组织化学染色发现,在已有的70对癌和癌旁肝组织芯片中,CCL23阳性强度明显高于癌旁组织(图2 D)。根据染色强度,将肝癌组织中CCL23分为高表达(n=97)和低表达(n=99)两组,结果显示,CCL23高表达者的总生存时间和无瘤生存时间上都明显优于CCL23低表达的患者(P<0.01)(图2 B&C);与各项临床病理指标构建四格表并做卡方检验发现,肝癌中的CCL23表达水平与病理分级(P=0.003)明显相关,而与年龄、性别、HBV、肿瘤大小甲胎蛋白、肿瘤数目、ALT、卫星病灶及肝硬化无关(表4)。另外,将各项病理指标分别做单因素COX回归分析,然后将差异有统计学意义的指标纳入多因素COX回归分析发现,肝癌组织中CCL23水平(P=0.002)、肿瘤大小(P<0.01)、肿瘤数目(P=0.005)和甲胎蛋白(P=0.041)是影响肝癌患者术后总生存时间的独立危险因素,而CCL23水平(P<0.01)、肿瘤大小(P<0.001)和甲胎蛋白(P=0.015)是影响肝癌患者术后无瘤生存时间的独立危险因素(表5)。

表2 GSE14520中CCL23和临床病理学特征之间的相关性

注:A.在公共数据库中,CCL23在肝癌与癌旁组织中的差异;B.在 TCGA-LIHC队列; C.GSE14520队列中,肝癌组织中CCL23表达与患者预后的关系
图1CCL23在公共数据中的表达及与患者预后的关系
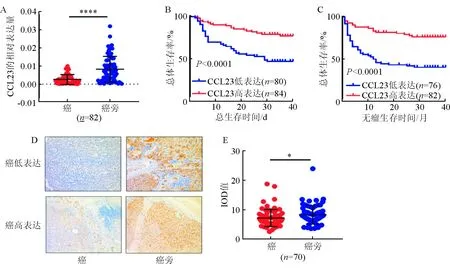
注:A.82例肝癌患者中,CCL23在肝癌与癌旁组织中的差异; B和C.肝癌组织中的CCL23高表达与患者预后的关系; D.CCL23在肝组织中的免疫组织化学染色(左:肝癌组织;右:配对癌旁组织:左上:肝癌组织中的CCL23低表达患者;左下:肝癌组织中CCL23高表达患者,放大倍数:200倍)

图2 CCL23在肝癌患者中的表达及与患者预后的关系
注:NA为未被采纳

表4 HCC中CCL23和临床病理学特征之间的相关性
讨 论
目前已经在多种疾病中发现趋化因子的重要作用,尤其是在肝癌的发生发展过程中。例如,Zhang等[6]分析人肝癌的预后生物标志物的微阵列发现,CCL14明显下调,并且对肝癌细胞增殖有影响。Wang等[7]通过分析TCGA数据库发现多个趋化因子是肝癌预后的独立危险因素,其中XCR1对肝癌患者预后影响最显著。此外,在肝癌的发生发展中,趋化因子配体-受体的相互作用发挥着重要作用,例如CXCL12-CXCR4/CXCR7可以促进肝癌的增殖[8,9],CX3CL1-CX3CR1可抑制肝癌细胞的增殖[10],CCL20可以增强肝癌细胞的增殖和转移能力等[11]。
本研究首先在GSE14520队列探讨各个趋化因子在肝癌及癌旁组织中的表达水平,然后在其他公共数据库中验证发现,CCL23的表达差异最为显著。已知CCL23可以特异性募集静息T淋巴细胞和单核细胞、抑制髓系祖细胞增殖、促进血管形成,还可以负性调节人脐带血CD34+细胞的增殖等[12]。本研究证实了CCL23在肝癌组织中表达明显下调,其表达水平与肿瘤数目及病理分级相关,提示其可能参与肿瘤细胞的分化和增殖,其中高表达者的总生存时间及无瘤生存时间显著延长,表明CCL23可能抑制肝癌的发生发展。此外,CCL23与其受体CCR1结合,可以募集单核细胞,树突状细胞和T淋巴细胞,并且可通过CCR1诱导内皮细胞迁移和血管生成,但CCL15-CCR1轴可增强肝癌细胞的转移[13]、CCL3-CCR1轴可促进肝癌细胞增殖和侵袭[14],表明在肝癌中CCL23可能不是主要通过CCR1发挥作用。综上所述,趋化因子CCL23可以作为肝癌术后远期生存复发的预测指标,为今后的肝癌治疗靶点提供理论基础。

表5 HCC中CCL23的单因素和多因素Cox回归分析