大鼠脑缺血再灌注时右美托咪定对JAK1/STAT1信号通路的影响
谢桂玲 王东伟 张丽丽 魏嘉楠 王俞婷
佳木斯大学附属第一医院,黑龙江省佳木斯市 154007
JAK/STAT途径广泛参与神经元生长、分化、凋亡等过程,并且脊髓损伤时,JAK1/STATl信号通路的激活能够诱发促炎因子释放、神经元细胞凋亡及髓鞘脱失,从而加重脊髓损伤,诸多研究已证明,JAK/STAT信号通路与脊髓损伤的神经生长和胶质瘢痕形成具有直接关系。而且在大脑缺血后STAT1被激活,引起大脑缺血性损伤,并且在心肌缺血再灌注损伤中[1]也发现STAT1激活引起细胞凋亡。右美托咪定为α2-肾上腺素受体激动剂美托咪定的右旋异构体,本品对中枢α2-肾上腺素受体激动的选择性更强,从而发挥镇静、镇痛的作用,研究表明,右美托咪定广泛应用于神经保护麻醉,对脑组织的缺血缺氧性损伤也具有明显的保护效应[2-3],因此本文将探讨大鼠脑缺血时右美托咪定对JAK1/STAT1信号通路的影响。
1 材料与方法
1.1 动物与分组 选取体重220~260g,SD大鼠40只,由佳木斯大学动物实验中心提供,随机分为5组,每组8只,术前12h禁食,不禁水:假手术组(C组)、缺血再灌注组(I/R组)、右美托咪定25μg/kg组(D1组)、右美托咪定50μg/kg组(D2组)、右美托咪定75μg/kg组(D3组),实验开始时,C组仅进行外科操作暴露颈外动脉而不造成脑缺血,I/R组进行脑缺血操作30min前腹腔内注射无菌生理盐水1ml,D1组、D2组、D3组分别脑缺血操作30min前腹腔内注射右美托咪定25μg/kg、50μg/kg、75μg/kg。缺血120min后,实现缺血再灌注处理。
1.2 大鼠大脑中动脉缺血再灌注模型制备 采用改良线栓法制备大鼠左侧大脑中动脉缺血再灌注模型(Middle cerebral artery obstruction,MCA)[4]诱发大脑中动脉(MCA)供血区域的局灶。腹腔麻醉大鼠,剪去大鼠颈部绒毛备皮,旁正中切口3~4cm,暴露胸锁乳突肌,分离左侧颈总动脉,向上分离至左颈外动脉(External carotid artery,ECA)远端1cm,结扎颈外动脉及其分支,用蛙心夹夹闭颈内动脉(Internal carotid artery , ICA)近心端及颈总动脉(Common carotid artery,CCA)近心端,在ECA结扎处近端与CCA分叉处之间做一小切口,将选取好的栓线自左ECA插入CCA分叉处,从切口处将线栓插入左ICA,松开蛙心夹,轻柔推进,稍感阻力即止,此时插入深度为16~20mm,阻断2h后,拔出栓线,行CCA,ICA再灌注。观察大鼠眼虹膜,当颜色变浅时出现神经缺损症状认为模型制备成功。
1.3 大鼠学习记忆功能测评评分标准(Neurological deficit scores) 动物模型建立待大鼠苏醒后,于相应时段由一位不了解分组情况的观察者参照Zea-Longa[4]的5分制评分标准,进行评估并记录神经功能缺损评分,具体评分标准如下:0分:无任何神经功能缺损症状;1分:轻微神经功能缺损,不能完全伸展缺血灶对侧(左侧)前爪;2分:中度局灶性神经功能缺损,行走时向缺血灶对侧(左侧)转圈;3分:重度局灶性神经功能缺损,站立时向缺血灶对侧(左侧)倾倒;4分:不能自发行走,甚至意识丧失。神经功能缺损达1~3分者纳入实验。
1.4 Western blotting法检测蛋白表达水平 大鼠于再灌注24h时断头取脑,在冰上分离缺血侧顶叶皮层大脑组织,匀浆,提取蛋白。蛋白定量后,每孔加样量为50μg蛋白。上样于8%聚丙烯酰胺凝胶电泳,转膜,封闭,加入p-JAK1兔多克隆抗体(1∶100,由SANTACRUZ公司提供)、p-STAT1鼠单克隆抗体(1∶1 000,由EPITOMICS公司提供)及抗β-cation(1∶500,由碧云天公司提供)抗体,4℃过夜。洗膜,加入二抗(山羊抗兔/兔抗小鼠IgG 1∶5 000,由碧云天公司提供)孵育,发光,记录结果。蛋白条带进行相对密度扫描并分析。
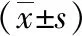
2 结果
2.1 右美托咪定对缺血再灌注损伤大鼠神经功能的影响 假手术组大鼠神经功能正常,脑缺血再灌注组大鼠表现出明显神经功能缺损症状,而右美托咪定组大鼠神经功能缺损症状均获不同程度的改善,I/R组与C组比较差异具有统计学意义(P=0.007),D1组、D2组、D3组与I/R组比较差异具有统计学意义(P=0.001、0.00、0.00)。见表1。

表1大鼠的神经功能评分
注:与C组比较,aP<0.05;与I/R组比较,bP<0.05。
2.2 不同组别大鼠脑组织中p-JAK1、p-STAT1的表达 Western-blotting法检测C组未见明显p-JAK1、p-STAT1蛋白的表达,I/R组脑缺血再灌注区脑组织p-JAK1、p-STAT1蛋白表达明显增多,D1组、D2组、D3组p-JAK1、p-STAT1蛋白的表达均有所减少。I/R组与C组比较差异具有统计学意义(P<0.05),D1组、D2组、D3组与I/R组相比差异具有统计学意义(P<0.05),D1组、D2组、D3组,两两组间相比差异具有统计学意义。见表2及图1、2。
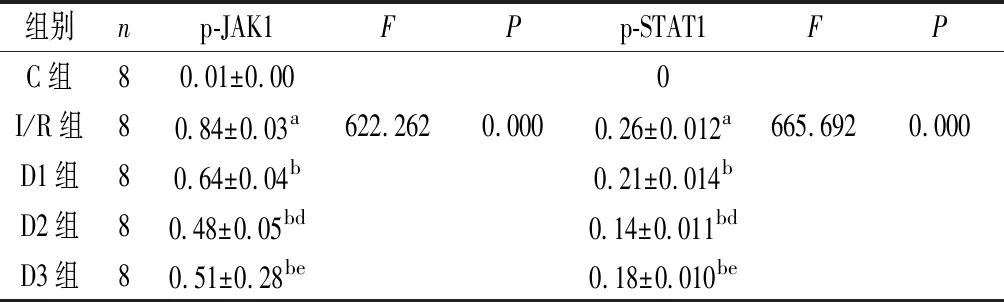
表2大鼠脑组织p-JAK1,p-STAT1蛋白的表达
注:与C组比较,aP<0.05;与I/R组比较,bP<0.05;与D1组比较,d、eP<0.05;与D2组比较,eP<0.05。
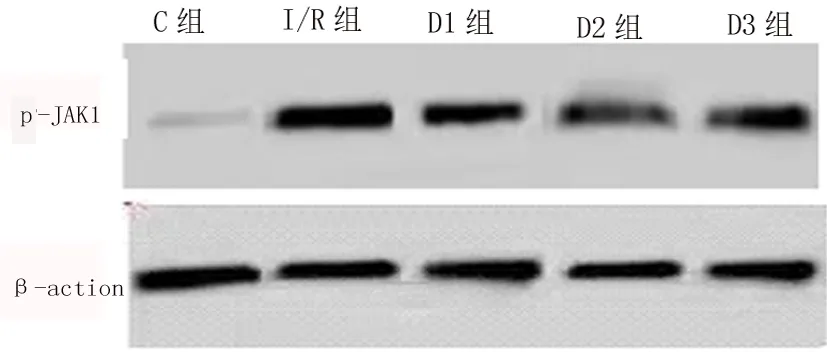
图1大鼠脑组织p-JAK1蛋白表达
图2大鼠脑组织p-STAT1蛋白表达
3 讨论
脑缺血再灌注损伤是一个极为复杂的病理生理过程,如何抑制脑缺血再灌注损伤己成为研究的热点。这个过程目前认为涉及到ATP的生成障碍、兴奋性氨基酸毒性作用、细胞内酸中毒、钙离子超载、炎性因子的释放及凋亡调控基因激活等诸多机制。
Mascareno等[5]曾报道过JAK/STAT3通路参与了心肌缺血再灌注损伤的病理过程,近年来JAK2/STAT3通路也被证实参与神经元损伤的病理过程,这一观点现已被很多研究证实,Oshima等[6]也曾研究证实STAT3在心肌缺血再灌注损伤诱导的脑损伤这一病理过程起着重要调节作用。JAK1几乎在所有细胞中表达,是一种重要的酪氨酸蛋白激酶,其与γ链亚单位受体家族(IL-2、IL-4、IL-7、IL-21)及gp130亚单位受体家族(IL-6、IL-11、CNF、G-CSF)均可发生偶联反应。研究表明大量细胞因子如IL-6-JAK1-STAT3、GM-CSF-JAK1-STAT5信号的转导途径过程中均可促使JAK1介导不同下游因子STATs,从而激活不同信号转导通路[7]。脑组织局部创伤主要原因之一是发生脑功能障碍时引起相关炎症因子(TNF-α、 IL-6、IL-1等)释放增多进而导致炎症性损伤。研究发现[8],右美托咪定能显著改善大鼠神经功能缺失评分,通过降低缺血性脑损伤模型的血清炎症因子浓度水平,减小大鼠脑梗死面积,起到神经保护的效应。根据本文结果显示,右美托咪定50μg/kg时,脑皮质JAK1/STAT1信号通路表达显著减少,由于试验数量限制,右美托咪定对脑缺血损伤保护的最有利剂量仍有待研究,同时,右美托咪定剂量对脑缺血损伤的保护是否呈相关性还有待研究,由于右美托咪定对脑缺血再灌注的保护机制研究众多,本研究只是其中之一,其他机制还有待进一步研究。

