核桃CBF基因在低温胁迫中表达
宋静武 彭 磊
(1.秭归县林业局 林业科学技术推广中心 宜昌 443600; 2.云南农业大学 园林园艺学院 昆明 650201)
1 实验目的
核桃(JuglansregiaL.)又被称为胡桃、羌桃,是一种胡桃科植物。核桃极具营养价值,核桃中脂肪和蛋白质含量较高,又含有人体所需很多种矿物质和微量元素,又富含多种维生素。核桃是一种极为重要的经济树种,能为我国核桃产区带来极大地经济效益。核桃树抗寒能力较弱,在受到低温冻害、寒害以及晚霜等非生物胁迫时会造成花芽枯死和枝条抽干,这会影响树体的正常生长结实,会造成严重的经济损失,并限制了良种核桃的地理分布。为了提高核桃的经济和产业价值,研究人员利用现代基因工程技术和分子生物学方法,希望能够改良核桃品质、探索核桃抗寒机制的分子机理、运用转基因技术培育高抗性核桃新品种等工作进行研究。
CBF/DREB1(C-repeat binding factors /dehydration response element binding factors1)蛋白是植物体内低温信号传导途径中研究最为广泛的转录因子基因[1]。这个家族在抗寒,抗碱,抗盐方面有很大作用[2]。拟南芥作为一种常用模式植物,Yamaguchii[3]在极端的干旱和低温胁迫的条件下对拟南芥进行研究时,发现拟南芥的RD29A基因的启动子区域中分离出了了DRE顺式作用元件(1994),这些元件含有相同的CCGAC序列。随着研究发现CRT/DRE和其核心序列,常出现在冷诱导以及干旱诱导基因的启动子中,这是冷诱导过程中必要的一类基因[4]。2002 年,Haake等又分离出了这个家族的第 4 个成员CBF4,CBF4的转基因植物能观测与表达和CBF1一样具有抗寒性显著提高结果[5]。氨基酸序列分析表明,CBF中含有AP2结构区,AP2结构域第一个DNA结合区,它的作用是结合CRT/DRE顺式作用元件,诱导相关基因表达,通过合成膜稳定蛋白、脯氨酸、糖类等物质,改变细胞生理环境进而提高植物的抗寒性[6]。CBF基因的冷诱导不会受自身调节影响,所以这个转录因子应该是其他蛋白,他们假设这种转录因子为ICE(inducer of CBF expression)。正常条件下ICE不处于活动状态,植物体可能通过某种条件将ICE隔离在体内,当植物受到冷刺激时ICE会被释放出来,从而激活一条信号途径,使CBF基因能够进行表达[7]。Chinnusamy等在2003年首次分理出ICE1基因[8],经过数据查询发现ICE1的C端含有一个近似MYCbHLH(MYC-likebasic helix-loop-helix)结构域,这个结构与bHLH蛋白相似,bHLH蛋白能够识别DNA中的某些元件,而CBF3中含有多个这样的元件[9],这也说明了ICE能特异的与CBF3中的特定识别序列结合。LOS4-1是CBF基因的一个正向调控因子,是由Guo研究拟南芥突变体时发现的(2002),这种基因突变的拟南芥对低温的抵抗能力比野生型在24H内降低了40%[10]。LOS基因编码一种能够抑制STZ/ZAT10的活性的生物活性酶(STZ/ZAT10能够抑制冷诱导基因RD29的表达)[11],但是LOS的一个突变LOS4-2却会增强CBF及其靶基因的表达[12]。Lee[13]等发现了一个与渗透压相关的CBF负调节因子称为HOS1(high expression of osmoticstress regulated gene expression 1),HOS编码环脂蛋白,当受到低温刺激时会在细胞核内大量积聚,抑制CBF基因表达。Liu等的研究表明,正常状况下PtrHOS1基因在枳(Poncirus trifoliata (L.) Raf.)茎叶、根部都有很强的表达,经过低温处理后出现了短暂的下调,说明HOST1基因表达受到低温影响[14]。SFR6蛋白(sensitive to freezing 6)是一种对低温敏感的蛋白也是一个特例,这种蛋白是CBF下游正调节因子,能够下调那些启动子结构不含有CRT/DRE元件的基因[15~17]。在植物受到低温刺激时,CBF基因转录水平会迅速提高,随后含有CRT/DRE调节元件的COR基因启动子会与CBF基因结合进一步促进COR表达。COR基因在低温条件系会对基因表达进行调节,会降低细胞内的一部分多余物质的含量,从而提高植物抗寒性[18~19]。COR是一种冷应答蛋白,当植物受到干旱盐碱寒冷的胁迫时会被诱导产生[20]。目前对于COR类基因的研究较多,如拟南芥的COR78基因启动子常用于非生物胁迫诱导启动子来增强植物抗逆性,这种启动子比组成型启动子更能减小植物生长中的一些负面作用[21]。COR15a基因表达产生的物质会与叶绿体结合,形成一种能够保护原生质体和叶绿体的物质,进而提高植物细胞的抗寒性[22]。 有关研究表明,CBF基因为AP2/EREBP 超家族的DREB家族成员,是从拟南芥、甘薯等植物中发现的基因,在植物抗寒性研究中都起到关键性的作用。
CBF/DREB1蛋白是一种广泛存在于植物体内的控制植物体内低温信号传导的一类转录因子基因,也是现在研究最为广泛的基因之一。近年来,随着基因工程学科的不断发展,从核桃中成功克隆出了许多影响核桃抗寒性的功能基因,相关研究只在研究单一低温核桃相关基因的表达,但CBF基因在不同温度处理表达的研究未见报道,因此,该课题对前人的研究进行了深入和完善,这对研究核桃抗寒机制是十分必要的。为了了解核桃内CBF基因对不同寒冷温度的响应的变化,采用不同低温梯度进行处理,利用RT-PCR技术研究了在不同时间不同温度下下‘阳光’‘云新’核桃叶片内CBF基因在寒冷胁迫下表达量的变化规律,为以后选育核桃优良抗寒品种等提供更多的参考依据。
2 材料与方法
2.1 试验材料
2.1.1 试验材料
试验于2015年12月~2017年3月在云南农业大学园林园艺学院果树生理实验室进行。试验材料为云南农业大学园艺植物育种实验室盆栽‘阳光’、‘云新’核桃幼苗叶梢对生叶片,树龄0.5 a,处于幼年期,树高1 m,没有严重病害,在正常生长条件下‘阳光’长势优于‘云新’核桃,但‘阳光’核桃更易受自然低温和病害影响。‘云新’为云南薄壳与新疆核桃早实丰产杂交品种,‘阳光’为云南省选育的新品种。其中无病害室温盆栽核桃作为空白对照,将整株核桃幼苗放入恒温冰箱内进行活体2、4、6、8℃低温胁迫处理,处理时间为2、4、8、24 h。处理完成后采摘新鲜叶片用锡纸包裹放入液氮浸泡,后放入超低温冰箱保存。另一部分生理实验材料,对处理后的新鲜核桃叶片立刻进行杀青、晒干、研磨成粉状放入塑封袋密封保存。
2.1.2 试验试剂
植物RNA提取试剂盒;cDNA第一链合成试剂盒、10×Loading Buffer、Marker为DL2000;2×Power Taq PCR MasterMix;氯仿、琼脂糖等为国产分析纯试剂。
2.1.3 仪器
移液器、大号研钵、冷冻离心机、水平电泳仪、凝胶成像系统,eppendorf荧光定量系统;将清洁后的研钵等用锡纸包裹后,置于200℃以上烤箱烘烤处理;96孔0.2 mL PCR管盒、巴洛克无RNA酶枪头、八连管、1.5 mL离心管、1.5 mL离心管盒、0.2 mL PCR管、96孔冷冻铝板。
2.1.4 PCR 引物设计与合成
进入NCBI网站,在GenBank数据库中输入物种拉丁名Juglans regia L.及相关基因名称CBF获得取该基因的DNA或mRNA序列后,以其为模板使用Primer Premier 5.0进行引物设计。引物设计完成后,委托昆明硕擎生物科技有限公司合成。
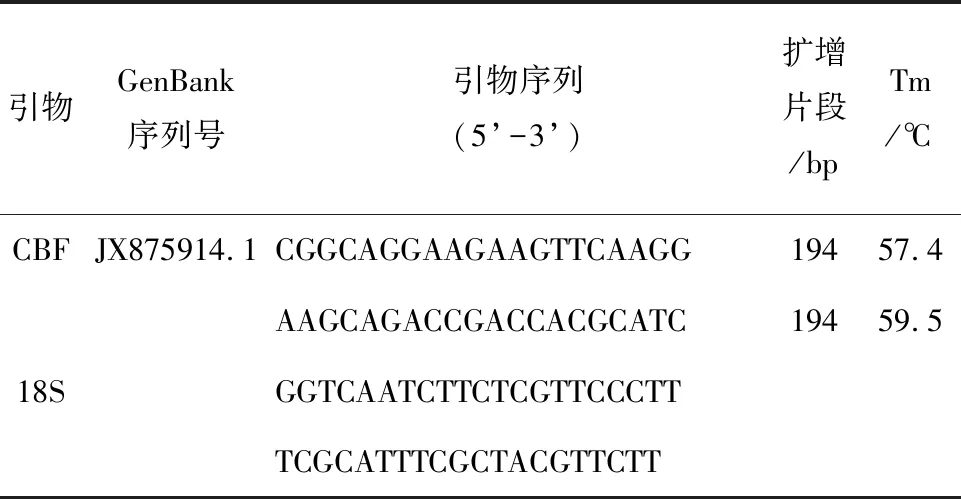
表1 qRT-PCR引物信息
2.2 方法
2.2.1 核桃叶片总 RNA 的提取
液氮覆盖核桃新鲜叶片将其研磨成细粉末,待液氮挥发完后,用离心管估算装取0.1 g样品(可使用离心管称取),加入1 mL细胞裂解液,在振荡器上振荡30秒后使其混匀后取1 mL匀浆物转移至干净的1.5 mL离心管中;在离心管加入300 μL去蛋白液和200 μL氯仿,在振荡器上振荡30 秒左右混匀;在常温12 000 转/分离心8分钟后,将上清液转移入干净的1.5 mL离心管中,加入等体积的漂洗液,充分颠倒混匀,将混合物分2次在12 000 r/min常温条件下离心1分钟,弃去穿透液;加入500 μL洗柱液,12 000 r/min常温离心1 分钟,弃穿透液,重复一次该操作,然后常温12 000转/分离心1分钟;将离心吸附柱转移到干净的1.5 mL离心管中,加入50 μL RNA洗脱液,放置片刻,12 000 r/min常温离心1分钟,离心管中溶液即为RNA样品。分装成5份,每份10 μL存放于超低温冰箱待用。
2.2.2 RNA样品电泳分析
取5 μL RNA样品与等量的Buffer混匀,在1.5%琼脂糖凝胶,1×TAE为电泳缓冲液,电压为80 V的条件下电泳25 min,在凝胶成像仪上观察RNA条带呈像情况、并采集照片数据。
2.2.3 合成 cDNA 第一链
第一条链cDNA的合成按照PrimeScript RT reagent Kit with gDNA Eraser (TaKaRa公司)试剂盒说明书进行。
2.2.4 基因特异引物的PCR
验证以cDNA为模板,用表1中的引物进行PCR扩增。PCR反应设定合适的循环参数,反应结束后4℃保存;扩增产物进行凝胶电泳检测。
2.2.5 实时荧光定量PCR
样本的制备后,上机进行样品检测。
2.2.6 数据处理
所有试验重复3次,利用软件DPS 7.05对组间进行单因素方差分析,利用Duncan’s 新复极差测验。
3 结果与分析
3.1 核桃抗寒相关基因在‘阳光’‘ 云新’核桃叶片受到不同温度和时间胁迫后的表达分析
3.1.1 总RNA质量及cDNA质量检测
由图1和图3可见,RNA 28S和18S条带亮度的比例约为2∶1,泳道无明显背景表明RNA样品的完整性较好、纯度较高,无明显降解,可用来接下来的的反转录。

1:2℃2H;2:2℃4H;3:2℃8H;4:2℃24H;5:4℃2H;6:4℃4H;7:4℃8H图1 ‘阳光’核桃总RNA提取凝胶电泳图像

1:6℃2H;2:6℃4H;3:6℃8H;4:6℃24H;5:8℃2H;6:8℃4H;7:8℃8H图3 ‘阳光’核桃总RNA提取凝胶电泳图像
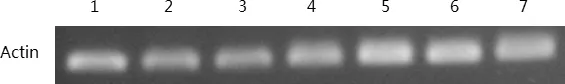
1:2℃2H;2:2℃4H;3:2℃8H;4:2℃24H;5:4℃2H;6:4℃4H;7:4℃8H图4 ‘阳光’核桃样品cDNA质量检测凝胶呈像
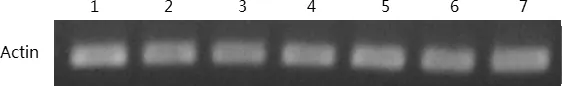
1:4℃24H;2:6℃2H;3:6℃4H;4:6℃8H;5:6℃24H;6:8℃2H;7:8℃4H图5 ‘阳光’核桃样品cDNA质量检测凝胶呈像

1:8℃8H;2:8℃24H;3:常温1号;4:常温2号;5:常温3号图6 ‘阳光’核桃样品cDNA质量检测凝胶呈像

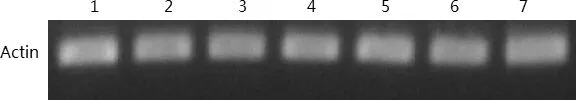
1:2℃2H;2:2℃4H;3:2℃8H;4:2℃24H;5:4℃2H;6:4℃4H;7:4℃8H图7 ‘云新’核桃样品cDNA质量检测凝胶呈像
1:4℃24H;2:6℃2H;3:6℃4H;4:6℃8H;5:6℃24H;6:8℃2H;7:8℃4H图8 ‘云新’核桃样品cDNA质量检测凝胶呈像
1:8℃8H;2:8℃24H;3:常温1号;4:常温2号;5:常温3号图9 ‘云新’核桃样品cDNA质量检测凝胶呈像
如图7和图9所示,以加入上述提取的‘云新’核桃叶片cDNA为模板,可扩增获得1条清晰的片段,说明此方法提取的总RNA能够满足实时荧光定量PCR等以RNA为基础的分子生物学实验。
3.1.2 CBF基因在‘阳光’‘云新’核桃叶片受不同温度胁迫后随时间变化在叶片内的表达量分析
通过对‘阳光’核桃叶片组织进行实时荧光定量PCR检测,发现CBF在核桃叶片中有表达,在三个不同时间CBF在核桃叶片内表达量均无明显变化(图10)。以核桃 18S 基因为内参,利用实时荧光定量PCR方法分析‘阳光’核桃叶片CBF在2、4、6、8℃四个低温胁迫下随时间延长核桃叶内基因表达量变化情况。其中在2℃条件下‘阳光’核桃叶片内的CBF基因表达量在随着处理时间延长有较小幅度的升高,并在2 h处理时达到最高值,在4 h时有小幅下降,在8 h时又有小幅升高,处理24 h后基本不再变化(图11)。4℃条件下‘阳光’核桃叶片内的CBF基因表达量在随着处理时间延长有小幅变化,且变化并不明显(图12)。6 ℃条件下‘阳光’核桃叶片内的CBF基因表达量在随着处理时间延长在2 h升高达到最高值后在4 h降低,处理8 h后又有小幅升高,24 h后又出现小幅降低(图3-13),其中2 h处理与0、4、24 h处理相比差异性显著。8 ℃条件下‘阳光’核桃叶片内的CBF基因表达量在随着处理时间延长先升高,后随着时间延长逐步降低,并在2H处理时达到最高值(图14)与8 h、24 h处理相比差异性显著。
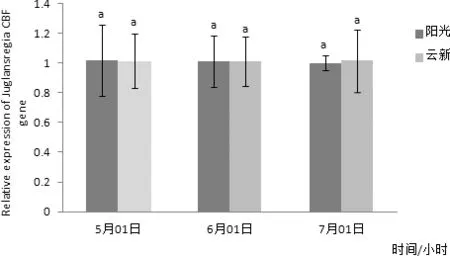
图10 CBF基因在常温下不同时间在两个品种核桃叶片内表达量差异
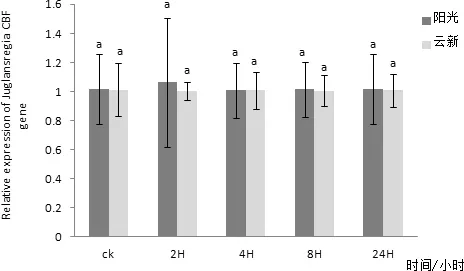
图11 CBF基因在2℃处理不同时间在两个品种核桃叶片内表达量差异
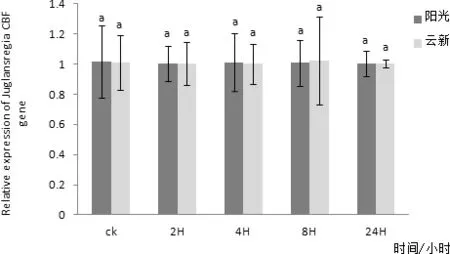
图12 CBF基因在4℃处理不同时间在两个品种核桃叶片内表达量差异
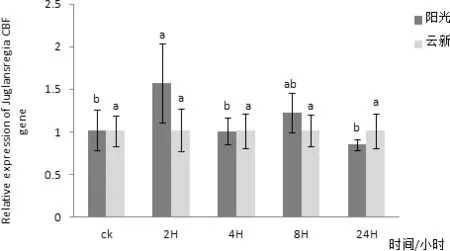
图13 CBF基因在6℃处理不同时间在两个品种核桃叶片内表达量差异
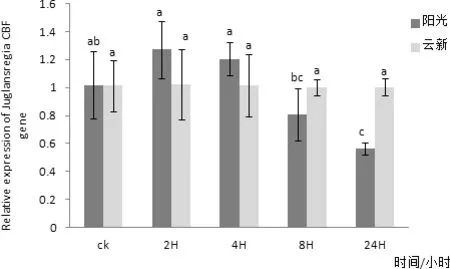
图14 CBF基因在8℃处理不同时间在两个品种核桃叶片内表达量差异
通过对‘云新’核桃叶片组织进行实时荧光定量PCR 检测,发现CBF在核桃叶片中有表达,在三个不同时间CBF在核桃叶片内表达量均无明显变化(图3-11)。以核桃 18S基因为内参,利用实时荧光定量PCR方法分析‘云新’核桃叶片CBF在2、4、6、8 ℃四个低温胁迫下随时间延长核桃叶内基因表达量变化情况。但在2、4、6、8 ℃四个低温条件下‘云新’核桃叶片内的CBF基因表达量在随着处理时间延长均只有小幅变化,且变化不明显(图12~图14)。在2℃低温条件下‘云新’核桃叶片内的CBF基因表达量在随着处理时间延长先降低后升高,然后趋于稳定。在4 ℃低温条件下‘云新’核桃叶片内的CBF基因表达量在随着处理时间延长先降低后升高之后再次降低,并在8 h达到最高值。在6 ℃低温条件下‘云新’核桃叶片内的CBF基因表达量出现很小幅变化,在2 h达到最高值。在8 ℃低温条件下‘云新’核桃叶片内的CBF基因表达量在随着处理时间延长先升高后降低,并在2 h时达到最高值。
由以上实验数据显示,CBF在‘阳光’核桃低温胁迫中起作用,在‘云新’核桃低温胁迫中有表达,但表达量变化并没有阳光核桃明显。
CBF抗寒途径是在高等植物中广泛存在的抗寒抗旱、抗盐碱信号传导通路,植物通过CBF转录因子,激活下游COR、LTI、KIN基因的表达来提高植物抗寒性。李勇鹏从香樟中低温诱导分离出了4种类CBF基因找到了控制香樟抵御逆境胁迫的重要转录因CcCBFa、CcCBFb、CcCBFc和CcCBFd[23]。吴纯倩将拟南芥CBF3和CR15a冷诱导基因转入烟草,提高了烟草的抗寒性及在低温时的光合作用率[24]。雷恒久等通过平欧杂交榛克隆出ChaCBF1基因,通过研究发现该基因会使植株积累较高水平的可溶性糖和游离脯氨酸来提高自身抗寒能力[25]。冯勋伟等将从结缕草中克隆出了CBF同源基因ZjCBF转入拟南芥中,发现即使不进行冷驯化ZjCBF过量表达的植株也比野生型抗寒性强[26]。张建朋等从麻核桃中克隆出jhCBF,序列分析说明JhCBF与桦木科白桦的亲缘关系最近,优先聚为一类[27]。近些年来,研究者们从茶树、巨桉(Eucalyptusgrandis)、葡萄、番茄(LycopersiconesculentumMill.)、扁桃(AmygdaluscommunisLinn.)等中都克隆出了类CBF基因,这些成果对研究抗低温品种改良优化起着重要作用[28-32]。雷恒久[25]等对平欧杂交榛叶片进行4℃低温处理发现ChaCBF1表达量随时间延长均有升高。徐丽[33]等对‘香玲’核桃叶片在4℃胁迫后发现JrCBF基因随处理时间延长出现了先升高后降低的趋势。这些研究均说明CBF基因在植物抗寒过程中起到了重要作用。
‘阳光’核桃中CBF基因在6℃和8℃低温胁迫下表达量有所升高,这暗示CBF基因在低温胁迫过程中发挥重要作用。但‘阳光’核桃中CBF基因在4℃胁迫下并无明显的表达量变化,而是在6℃和8℃时出现明显变化,但受冷胁迫刺激后基因表达量变化趋势相同。徐丽等所处的地区为山东省地理气候环境与云南省地理气候环境差异较大,是否能够说明不同地域的不同品种的核桃的抗寒能力存在不同,所以导致CBF基因受低温刺激表达变化的温度区间不同。本实验就云南省广泛种植的‘云新’‘阳光’两种核桃中CBF基因进行了低温胁迫下表达量的研究。在实验最后讨论时发现‘云新’核桃在2℃~8℃CBF基因变化量不明显,现阶段并不能对讨论所做的假设下定论。希望进一步实验能够对两种核桃的综合性抗寒指标进行测定,并选用不同树龄植株材料,提供更大量的数据参考及使用更多品种核桃进行冷胁迫基因表达量分析,来推断这种特殊情况是否只在‘云新’这个品种出现。
4 结论
结论:‘阳光’‘云新’核桃CBF基因在叶片不同温度处理下均有表达,但各个时间段表达量之间有一定的差异。其中‘云新’核桃在2 、4、6、8 ℃四个处理温度中表达量较为平均,没有明显变化,而‘阳光’核桃在6 ℃处理组中2 h处理后和8 ℃处理组中2 h处理后CBF基因的表达量较高。各个核桃产地均处于独特的地理气候环境中,也都有适应本土条件的核桃良种,核桃分子领域的研究基本为空白,希望通过这些研究为研究本土良种核桃抗寒生理及选育优良抗性核桃品种提供一定参考与思路。

