Oct4 mRNA在非小细胞肺癌患者肿瘤组织的表达与病理特征的相关性分析
刘天艺
肺癌为常见的肺原发性恶性肿瘤,主要分为小细胞肺癌与非小细胞肺癌(non-small cell lung cancer, NSCLC),其中NSCLC包括鳞癌、腺癌等,约占所有肺癌的80%[1]。近年来其发病率和病死率在诸多地区逐年上升,居恶性肿瘤首位[2]。随着医学的不断进步与发展,靶向治疗药物表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinase inhibitor, EGFR-TKIs)等在NSCLC诊疗方面取得了很大进展,但NSCLC患者整体生存水平仍不容乐观[3]。因此,从分子标志物角度分析NSCLC发病机制可为该病的早期诊断及预后提升寻找有效帮助。八聚体结合转录因子4(octamer-binding transcription factor 4, Oct4) 为干细胞多能性调节基因,可与含八聚体基序(ATGCAAAT)的八核苷酸结合而调节干细胞分化过程中的基因表达[4]。 Oct4与肿瘤微血管密度呈正相关,而肿瘤微血管密度与肿瘤的生物学行为密切相关,Oct4表达上调可预测肺癌的发生[5-7]。但目前国内关于Oct4 mRNA在NSCLC患者肿瘤组织的表达及其与病理特征关系的研究报道较少。基于此,本文通过检测Oct4 在NSCLC组织及其相应癌旁正常组织的表达水平,旨在分析NSCLC组织中Oct4表达与NSCLC患者临床病理特征的关系,并探讨Oct4对NSCLC患者预后的影响。
材料与方法
一、临床资料
经本院伦理委员会批准,选取2015年7月至2017年7月在我院确诊的92例NSCLC患者的癌组织及距癌组织>5.0 cm的癌旁正常组织。入选标准:①经病理检查确诊为NSCLC,且无其他肿瘤病史;②肝肾功能及凝血功能正常;③随访资料完整;④病理检查前未接受过放化疗、靶向药物治疗;⑤所有研究对象及家属签署知情同意书。排除标准:①血常规检测结果不正常;②肝肾功能不全;③心电图不正常;④在本次治疗前接受抗癌治疗;⑤患者依从性不好。92例患者中,男性51例,女性41例;年龄45~65岁,中位年龄为52岁,年龄<52岁55例,≥52岁37例;组织分化程度:中高分化52例,低分化40例;病理类型:腺癌56例,非腺癌36例。
二、研究方法
1. 实验试剂: 总RNA提取试剂盒(上海远慕生物科技有限公司)、荧光定量PCR试剂盒(青岛巴特菲生物科技有限公司)、无水乙醇(湖北卓奥环保科技有限公司)、氯仿(北京北化精细化学品有限公司)、Oct4引物(北京翰科生物科技有限公司)、琼脂糖(上海迪奥生物科技有限公司)、PCR反应液(武汉益普生物科技有限公司)、DEPC水(北京金石百优科技有限公司)、Trizol溶液(上海慧颖生物科技有限公司)、兔抗人浓缩型Oct4单克隆抗体(上海田源生物技术有限公司)、10%中性甲醛溶液(上海源叶生物科技有限公司)、苏木精染色液(上海舜田生物科技有限公司)、PBS磷酸缓冲液(环凯微生物科技公司)、DAB显色试剂盒(北京百奥莱博科技有限公司)、通用型二抗(上海立瑶生物有限公司)、免疫组织化学SP试剂盒(武汉纯度生物科技有限公司)、二甲苯(上海恒远生物科技有限公司)。
2. 荧光定量PCR法: 取92例NSCLC患者的癌组织与癌旁正常组织,按照总RNA提取试剂盒操作步骤提取总RNA,检测RNA完整性,逆转录成cDNA,以GAPDH为内参照,采用荧光定量PCR试剂盒检测细胞总RNA中Oct4 mRNA表达量。PCR反应条件:95 ℃预变性3 min,94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸50 s,35次循环,整个PCR过程在ABI7900HT PCR反应系统上完成,荧光信号用SDS2.3软件分析。Oct4 mRNA相对表达量计算方法:基因相对表达量=2-ΔΔCt,ΔΔCt=(CtOct4-CtGAPDH)-Avg.(CtOct4-CtGAPDH)。
3. 免疫组织化学方法: 对92例NSCLC患者的癌组织与癌旁正常组织采用10%中性甲醛溶液进行固定,脱水,用石蜡包埋成块,切成4 μm连续切片,依次脱蜡、抗原修复、PBS漂洗、过氧化物酶阻断,滴加兔抗人浓缩型Oct4单克隆抗体(浓度1︰100),4 ℃冷藏过夜,PBS漂洗,再滴加通用型二抗,25 ℃孵育30 min,PBS漂洗,经显色、复染、封片,用于观察Oct4蛋白表达。判定标准:由2位有经验的病理科医生评定和复核。染色强度:0分为不着色,1分为浅黄色,2分为棕黄色,3分为棕褐色;染色细胞百分率:0分为阳性细胞率<5%,1分为阳性细胞率5%~25%,2分为阳性细胞率26%~50%,3分为阳性细胞率>50%。两项之积为最终得分:乘积<4分判定为阴性表达,乘积≥4判定为阳性表达。
4. 评价指标: ①比较Oct4 mRNA在NSCLC组织与癌旁正常组织中的表达量;②比较Oct4蛋白在NSCLC组织与癌旁正常组织中的表达水平;③NSCLC组织中Oct4表达与NSCLC患者性别、年龄、肿瘤直径、分化程度等临床病理特征的关系;④采用门诊复查及电话的方式随访1年,记录并比较NSCLC患者中Oct4阳性表达与Oct4阴性表达者的预后情况,包括脉管浸润率、1年生存率、远处转移等。
三、统计学方法
采用spss22.0软件进行统计分析。计量资料比较采用t检验,计数资料比较采用χ2检验,生存分析采用Kaplan-Mier法。P<0.05表示差异具有统计学意义。
结 果
一、Oct4 mRNA及Oct4蛋白在NSCLC组织与癌旁正常组织中的表达
Oct4 mRNA在NSCLC组织中的表达量(3.19±0.20)明显高于Oct4 mRNA在癌旁正常组织中的表达量(1.50±0.08),有统计学差异(P<0.05)。NSCLC组织与癌旁正常组织中的Oct4蛋白均在细胞核中表达,呈棕黄色颗粒。Oct4 蛋白在NSCLC组织中的阳性表达率73.91%(68/92)明显高于Oct4 mRNA在癌旁正常组织中的阳性表达率9.78%(9/92),有统计学差异(P<0.05)。
二、Oct4表达与NSCLC患者临床病理特征的关系
TNM分期、分化程度、病理类型不同的NSCLC患者,其癌组织中Oct4阳性表达率差别明显,有统计学差异(P<0.05);性别、年龄、肿瘤直径不同的NSCLC患者,其癌组织中Oct4阳性表达率差别不明显,无统计学差异(P>0.05),见表1。
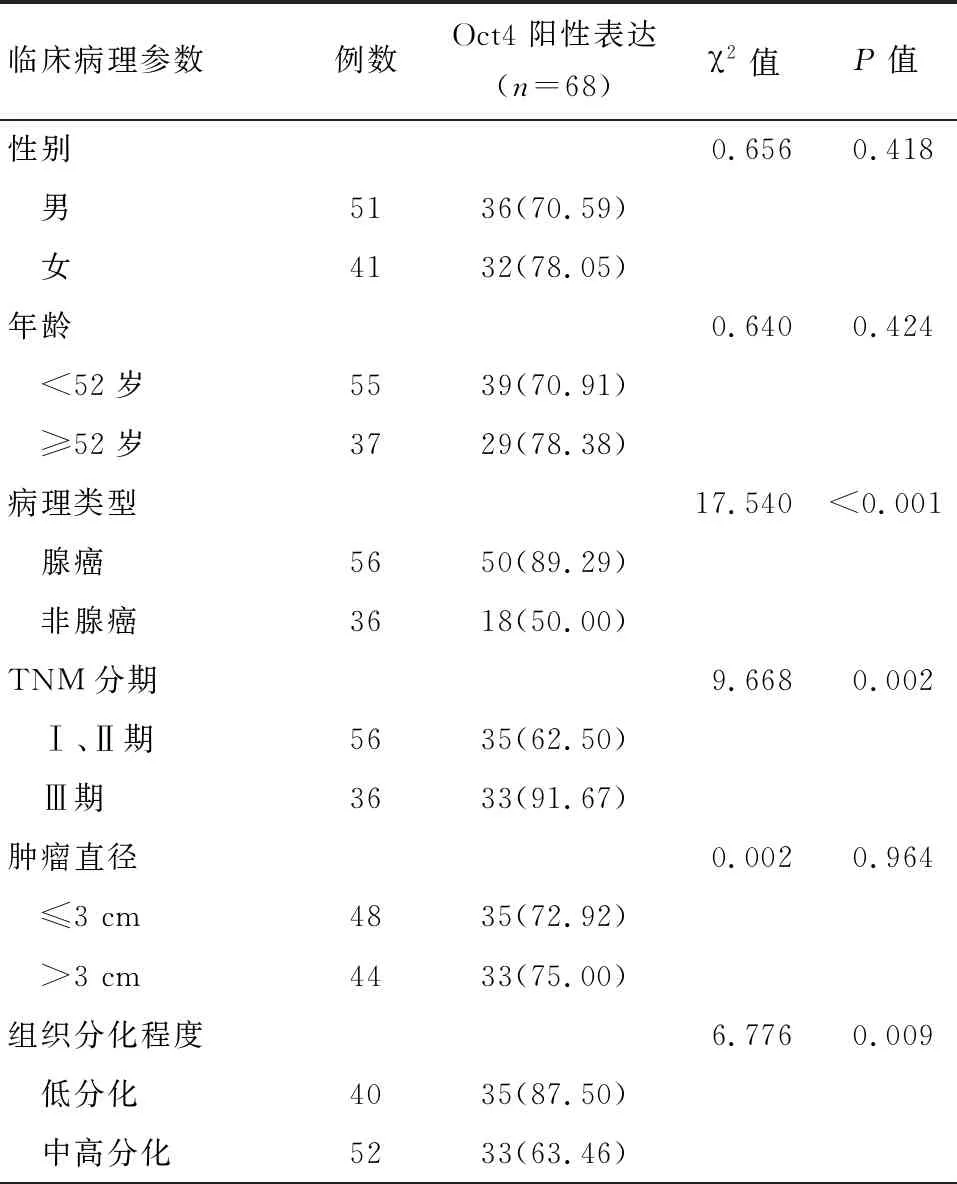
表1Oct4表达与NSCLC患者临床病理特征的关系 [n(%)]
三、NSCLC患者Oct4表达对其预后的影响
NSCLC患者Oct4阴性表达者脉管浸润率、远处转移明显低于Oct4阳性表达者,有统计学差异(P<0.05);NSCLC患者Oct4阴性表达者1年生存率明显高于Oct4阳性表达者,有统计学差异(P<0.05),见表2。
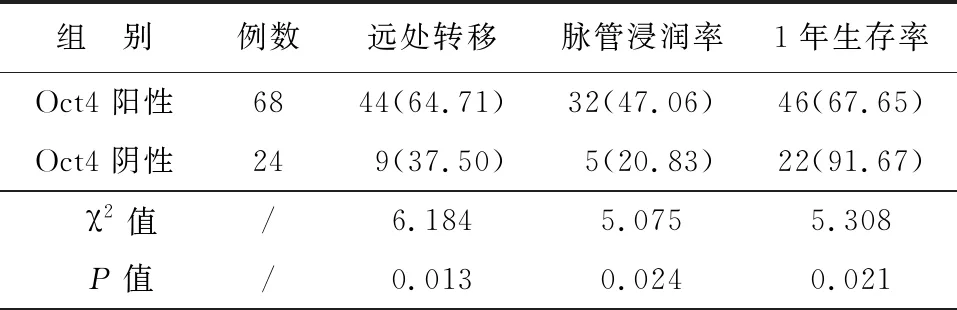
表2NSCLC患者Oct4表达对其预后的影响[n(%)]
讨 论
NSCLC是目前全球范围内发病率最高的恶性肿瘤,胸部胀痛、低热、咳嗽、痰血为其早期临床症状,晚期则出现呼吸困难、体质量减轻、咯血等[8-10]。引发NSCLC的因素很多,吸烟已被Bayalige等[11]证实是NSCLC最重要的高危因素,烟草中的亚硝胺和多链芳香烃类化合物(如苯并芘)可通过多种机制损伤支气管上皮细胞总DNA,导致抑癌基因(如APC、Rb、nm23、P53、FHIT等基因)失活与癌基因(如myc、Ras、src、myb等基因)激活,进而发生癌变[12-14]。同时,NSCLC的发生亦与职业环境、遗传因素、电离辐射、肺部慢性感染等密切相关[15]。随着医学技术的不断更新,低剂量螺旋CT筛查及分子靶向治疗成功应用于NSCLC的临床治疗,为进展期的NSCLC患者带来希望,但因NSCLC生物学特性复杂,早期症状不明显,恶性程度高,且易发生远处转移,其5年生存率依在10%左右[16.17]。这与NSCLC早期缺乏特异度较高的肿瘤诊断标志物有关,目前临床常用的肿瘤标志物灵敏度不高,且对肿瘤诊断及预后评估的意义不大[18-19]。
传统观念认为,肿瘤是由局部组织细胞增生形成的可以无限生长的新生物[20]。而有研究认为肿瘤干细胞(tumor stem cell, TSC)与肿瘤生长、转移及复发密切相关[21]。TSC是存在于恶性肿瘤细胞中为数极少却具有无限增殖能力并能自我更新的肿瘤细胞,具有维持肿瘤细胞生命力、促进肿瘤细胞转移、多向分化能力、耐药性强等生物学特性[22-23]。因此,其对以抑制肿瘤细胞增殖为靶向治疗的方式并不敏感,这也是肿瘤治疗困难或复发的原因之一。Oct4为TSC中最重要的维持人类胚胎干细胞自我更新的基因之一,该基因位于人类6号染色体上,由4个内含子和5个外显子组成,可转录不同的mRNA亚型,从而翻译成多种蛋白质,翻译的蛋白质含有1个保守的DNA结合结构域,该结合域可与靶基因启动因子中的八核苷酸结合从而激活或抑制干细胞分化过程中基因表型的转变[24-25]。研究显示,Oct4在正常细胞中不表达,仅表达于原发肿瘤细胞、胚胎干细胞(embryonic stem cell, ESC)、胚胎生殖细胞中[26-27]。Oct4与肿瘤发生、发展有一定联系,随着胚胎干细胞不断分化,Oct4基因在原始内胚层及滋养层外胚层中表达减少,而大量表达于肿瘤细胞及胚胎生殖细胞中。研究显示,Oct4蛋白在膀胱癌组织中的阳性表达率(66.75%)显著高于正常膀胱组织(25.38%),且Oct4蛋白在G1、G2、G3级膀胱癌中的阳性表达率分别为39.23%、70.21%、92.35%,由此提示Oct4表达上调可预测膀胱癌的发生及病情进展[28]。同时Soria等[5]发现Oct4与肿瘤微血管密度呈正相关,两者可共同参与肿瘤微血管生成、浸润及血行转移,提示Oct4可作为肺癌诊断的一个标志物。上述研究结论在本文中也得到了证实,本文结果显示Oct4 mRNA及蛋白在NSCLC组织中的表达水平均明显高于癌旁正常组织,因而NSCLC组织中可能存在具有无限增殖能力并能自我更新的TSC细胞,其中Oct4 参与了NSCLC的发生、侵袭及转移等。在Oct4表达与NSCLC患者临床病理特征及预后的相关性方面,Li等[29]的研究结果显示Oct4蛋白在有淋巴结转移、临床病理分期高患者中的阳性表达明显多于无淋巴结转移、临床病理分期低的患者。Li等[30]的生存分析结果显示NSCLC患者中Oct4高表达组总生存率(overall survivalrate, OS)显著低于Oct4低表达组。本文结果显示,TNM分期、分化程度、病理类型不同的NSCLC患者,其癌组织中Oct4阳性表达率差别明显,NSCLC患者Oct4阴性表达者脉管浸润率、远处转移明显低于Oct4阳性表达者,NSCLC患者Oct4阴性表达者1年生存率明显高于Oct4阳性表达者,这与Li 等[16]及Li 等[17]的研究结果相似。提示Oct4在NSCLC患者肿瘤组织中的表达与NSCLC患者TNM分期、分化程度、病理类型及预后有相关性。分析其原因可能是,Oct4高表达可增加TSC细胞多样性及上皮间质转化(epithelial-mesenchymal transition, EMT),而EMT为肿瘤侵袭与转移的关键过程。
综上所述,Oct4在NSCLC患者肿瘤组织中呈高表达,且与NSCLC患者TNM分期、分化程度、病理类型及预后有相关性。

