长脐红豆幼苗生长对不同土壤氮磷添加的响应及其对土壤养分的反馈
解亚鑫, 林明献, 许涵, 王中清, 李意德
长脐红豆幼苗生长对不同土壤氮磷添加的响应及其对土壤养分的反馈
解亚鑫, 林明献, 许涵*, 王中清, 李意德
中国林业科学研究院热带林业研究所 海南尖峰岭森林生态系统国家野外科学观测研究站, 广东, 广州 510520
以热带豆科树种长脐红豆(Drake)幼苗为研究对象, 开展苗期控制试验, 共设置了5个添加氮(N, N1—N5)和2个添加磷(P, LP—HP)梯度, 观察长脐红豆在不同土壤N、P添加条件下的生长表现及对土壤养分的反馈。测定的植物和土壤响应指标包括: 植株地上和地下生长量、叶面积、叶和根的N、P含量、根际和非根际土壤N、P含量等。结果表明: (1)从苗高、总叶面积、地上生物量、地下生物量、总根长和根表面积这6个指标总体来看, 在低磷(LP)条件下, 中、高浓度的N添加(N4、N5)对长脐红豆生长有抑制作用; 高磷(HP)条件下, 高浓度的N添加(仅有N5)对长脐红豆生长有抑制作用; 表明长脐红豆的最适生长N浓度会随P添加浓度增加而升高; (2)随着N添加浓度的增加, 根和叶的全N含量呈先增加后减小的趋势, N4处理条件下达到最大; 根和叶的全P含量却呈现相反趋势, 符合元素稀释效应。叶的N:P>16, 且P浓度<1.0 mg·g-1, 表明长脐红豆生长受P限制; (3)基于氨态氮、硝态氮和有效P这3个肥力指标, 长脐红豆苗期非根际土壤肥力>根际土壤肥力, 表明豆科树种长脐红豆在其幼苗期共生根瘤尚未明显形成时期, 需补充适量N、P养分供给。
豆科; 长脐红豆; 生长指标; 组织氮磷含量; 氮磷比; 根际和非根际土壤
0 前言
土壤环境中的氮(N)、磷(P)是植物生长所必需的大量营养元素, 在植物生长、发育和繁殖等过程起到重要作用。但在热带亚热带地区, 土壤N特别是P分布极为不均匀, 很多植物的生长过程乃至生态系统生产力都表现为N、P限制或者两者共同限制[1-2], 从而影响植物的生长。
豆科植物在热带亚热带地区是一个重要的分类群, 它们有着广泛的用途。著名红木类大部分来自豆科, 例如降香黄檀、大果紫檀等, 它们还可以作为绿肥、起到提高土壤肥力的作用[3-4]。这很大一部分是由于它们不仅是生物固氮的主要树种, 也能调节植物根系土壤的有效磷含量。豆科植物通过共生固氮把大气中的氮气转换为生物可利用的形式来克服土壤可利用N的不足, 所以, 在N不足的生态系统中, 共生固氮是提升生态系统功能的重要驱动因素[5-6]。但是共生固氮也需要花费较高的成本, 即固氮植物需要投入更多的碳(C)和P来支持共生微生物[5]。因此, 理论上固氮植物在低N、高P的环境中更有竞争优势, 在高N、低P的环境中具劣势。
然而, 固氮的乔木树种在土壤N不足的温带和高海拔的森林中相对来说比较稀少, 但是在土壤N相对丰富的热带和低海拔地区比较常见[7-9]。这一矛盾就引出了一个问题: 为什么共生固氮树种在高N低P具有竞争劣势的热带雨林中反而丰富?解决这一悖论对理解全球范围内的树木固氮模式的多样化和预测森林对一系列自然和人为干扰的响应很关键, 也对于理解豆科植物能否作为有利的互作树种很重要[10-13]。这就说明对不同豆科植物在不同土壤N、P环境下的生长表现进行观测的必要性。
豆科树木主要分布在热带、亚热带地区, 例如在海南尖峰岭生长着不少豆科树木, 主要是红豆属和猴耳环属树木[14]。目前, 对于豆科植物生物固氮作用的研究集中在农作物, 例如大豆、紫花苜蓿、三叶草等, 以树木为研究对象的偏少[15]。海南尖峰岭60 hm2大样地内豆科树木有7种: 肥荚红豆、猴耳环、亮叶猴耳环、长脐红豆、软荚红豆、木荚红豆和薄叶猴耳环[14]。前期研究表明红豆属和猴耳环属植物的许多种类都能够固定空气中的氮, 包括本试验研究对象长脐红豆[16-17]。
本研究选取海南热带山地雨林常见豆科树种长脐红豆为代表进行苗期控制试验, 将其种植在不同土壤N、P添加环境条件下, 观察其地下、地下部分的生长表现, 以及其对根际和非根际土壤N、P等养分的影响, 以期为探索在不同N、P条件下物种的生境选择与适应机制, 为豆科与非豆科树木间植、土壤改良、立地选择和施肥管理提供科学依据。
1 材料和方法
1.1 试验地概况
研究区位于海南尖峰岭林区(18°20′—18°57′N, 108°41′—109°12′E), 地处热带北缘, 属低纬度热带岛屿季风气候[18]。苗木栽培试验在尖峰岭国家级自然保护区试验区内开展, 所在地海拔820 m。根据尖峰岭国家级森林生态系统定位研究站设在海拔820 m处26年的天池气象站资料显示, 年均气温19.8 ℃, 年均地面温度22.8 ℃, ≥10 ℃年积温7203.9 ℃, ≥15℃年积温6639.2 ℃, 最冷月1月份平均气温14.8 ℃, 最热月7月份平均气温23.0 ℃, 年均降水量2449 mm, 年均蒸发量1249 mm, 年均风速1.2 m.s-1, 年均相对湿度为88.8 %, 土壤类型为砖黄壤[19]。
1.2 试验设计
本试验采用大棚盆栽控制试验法。栽培土壤、种子和试验地均来源于海拔800—850 m的热带山地雨林范围。首先在天然林中随机选取3株长脐红豆成年树, 在以树为中心的树冠范围内挖取表层0—25 cm的土壤, 除去较大的石块、树根等杂质, 混合均匀后装入培养盆。培养盆底径20 cm, 高18 cm, 每盆土壤质量4 kg, 盆内套有保鲜袋, 防止浇水时带走所添加的N、P养分。
长脐红豆树木种子来源于海南尖峰岭原产地, 采集同一株母树种子, 挑选其中大小均一的成熟种子, 用质量分数为98.3%的浓硫酸处理30 min, 以腐蚀种皮, 然后用清水冲洗干净并浸泡种子至吸水吸胀, 放入培养盆中沙培, 每天傍晚用花洒喷水以补充水分。待种子发芽长出一个月时, 选取长势良好、苗木高度基本一致的幼苗移栽到花盆中, 并用锡箔纸覆盖土壤表面, 减少水分蒸腾。一个月后, 幼苗生长基本稳定后开始施肥。长脐红豆移栽时间为2016年11月22日, 待幼苗生长稳定后自2017年1月1日起算。
施肥试验设有5个N梯度, 2个P梯度, 每个处理6个重复, 生长期为8个月。氮肥选用硝酸铵(NH4NO3), 设置5个N添加(N1、N2、N3、N4、N5)浓度梯度: 0 mg N·kg–1、75mg N·kg–1、150 mg N·kg–1、300mg N·kg-1、600 mg N·kg–1; 磷肥选用磷酸(H3PO4), 设置2个P添加(低磷LP、高磷HP)浓度梯度: 0 mg P·kg–1、50 mg P·kg–1。这种大范围的N、P梯度浓度设置既考虑长脐红豆的原初适生土壤环境, 也考虑原初土壤环境的N、P浓度可能不足的情况, 添加的最大N、P浓度远超其生长所需。
硝酸铵和磷酸分别配置成10 mol·L–1的母液, 每次施肥时用移液枪吸取相应的量, 加100 ml水稀释, 以画圆方式均匀倒在花盆里。在生长期的第2-4个月施肥, 每半月施一次肥, 共8次, 之后的4个月生长期留下充足时间给幼苗吸收养分, 只浇水。
田间持水量计算: 幼苗种植之前, 取3个装好一致重量土的花盆(漏水的), 傍晚浇水浇透, 底下孔流水出来, 然后第二天早上称重, 这个重量减去之前土和花盆的重量, 就是这个土的饱和持水量, 这个水的量乘以70%, 就基本是适宜植物生长的田间持水量。试验过程按照营养梯度, 定期浇水, 保证一致的持水量。本试验1—4个月保持60%的田间持水量, 5—8个月保持70%的田间持水量, 以免浸泡到苗木的根系, 影响生长。
1.3 数据采集
每月中旬测量苗高。8个月生长期后全株收获, 按器官分为根、茎、叶测定; 用便携式叶面积仪(LI-3000C)测量幼苗的叶面积; 再将茎和叶分别称量鲜重, 之后装入信封, 烘箱中105 ℃杀青30 min, 再70℃烘干至恒重, 称其干重; 最后将烘干的叶片磨碎, 过80目(0.18 mm)尼龙筛, 测量叶片的全N、全P含量。
根用清水冲洗干净, 用吸水纸巾将根系表面水分吸干, 称其鲜重; 放入根系扫描仪扫描整个根系, 摆放根系时尽量避免根系的重叠和交叉, 采用根系分析软件WinRHIZO(Pro 2013a, Regent Instrument Inc.)分析根系扫描图片获得总根长、根表面积; 再把根装入信封, 放入烘箱70 ℃烘干至恒重, 称其干重; 把烘干的根系样品磨碎, 过80目(0.18 mm)尼龙筛, 测定根系的全N、全P含量。
在全株收获同时采集土壤样品, 包括: 根际土壤样品(即根系1 cm范围内的土壤)和非根际土壤样品(远离根系的土壤范围, 随机取3处混合均匀), 各取50 g。新鲜土壤样品在-20 ℃冷冻保鲜, 以备用于测定土壤中的氨态氮和硝态氮; 剩下的土壤放在阴凉处风干, 过100目(0.15 mm)筛, 用来测土壤pH、全N、全P和有效P。pH采用玻璃电极法测定; 全N用凯氏蒸馏滴定法测定; 全P用氢氧化钠融-钼锑抗比色法测定; 氨态氮和硝态氮用氯化钾溶液提取-氧化镁-代氏合金蒸馏滴定法测定; 有效P用盐酸-氟化铵提取-钼锑抗比色法测定[20]。
1.4 数据分析
用Excel2007对数据进行整理、SPSS19.0统计软件进行数据分析和作图。对各指标进行单因素方差分析(One-way AVONA), 多重比较采用最小显著差异法(LSD), 显著水平设定为0.05; 两因素之间的对比差异分析用t检验; 本试验中的土壤和叶片营养元素N: P比采用质量比。
2 结果与分析
2.1 土壤N、P添加对植物生长指标的影响
在LP处理下(图1), 随着N浓度的增加, 长脐红豆幼苗总叶面积表现出先升高后下降的趋势(图1b),在N2浓度达到最高, 随后下降, 但N1与N2之间没有显著性差异, N1、N2分别与N3、N4、N5有显著性差异。苗高、地上生物量、地下生物量、总根长和根表面积这5个指标都是随着N浓度的增加表现出下降的趋势, N1处理最大, N5处理最小。图1a中, N5与N1、N2、N3、N4有显著性差异, 图1c中, N1、N2与N3、N4、N5有显著性差异, 图1d、图1e和图1f中, N1、N2与N4、N5有显著性差异, 而N1与N2之间无显著差异, 以上表明高浓度的N添加(N4、N5)对长脐红豆生长有抑制作用。
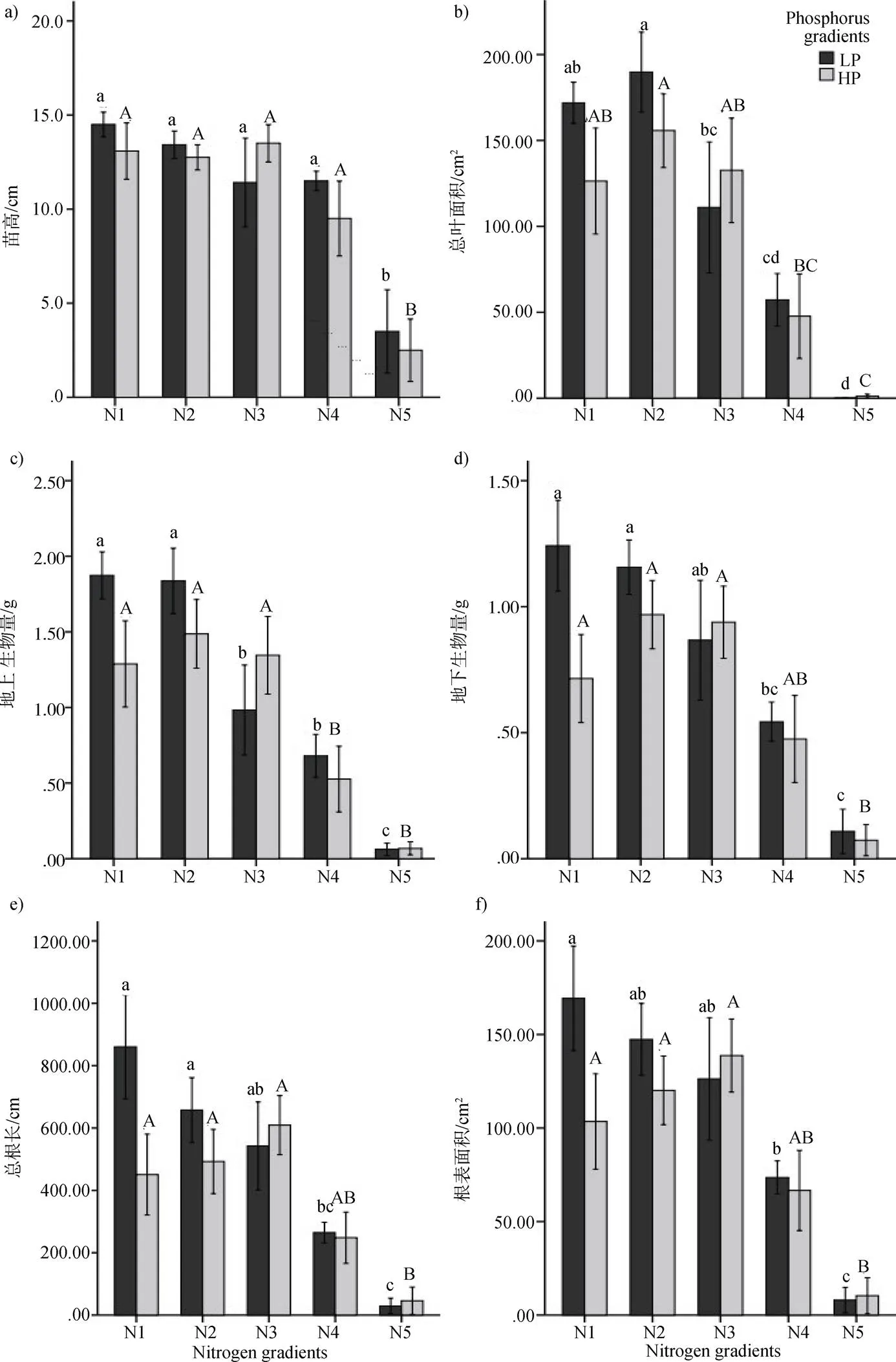
图 1 不同氮磷处理对长脐红豆幼苗生长指标的影响。条形柱上标有不同字母表示各生长指标氮肥处理间差异显著(P<0.05), 反之差异不显著(P>0.05)。小写字母(a, b, c)用于区分低磷(LP)处理之间的差异显著性, 大写字母(A, B, C)用于区分高磷(HP)处理之间的差异显著性。
Figure 1 Effects of nitrogen and phosphorus additions on different growth indices ofseedlings. Different letters above the bars indicate significant differences between different growth indices under nitrogen addition treatment (<0.05), otherwise not significant differences (>0.05). The lowercase letters (a, b, c) are used to indicate if there are significant differences among low phosphorus (LP) addition treatments, and the capital letters (A, B, C) are used to indicate if there are significant differences among high phosphorus (HP) addition treatments.
在HP处理下(图1), 随着N浓度的增加, 苗高、总叶面积、地上生物量、地下生物量、总根长和根表面积这6个指标都表现出先升高再下降的趋势, 基本上在N2或N3浓度下达到最高, 随后下降, 但N1、N2、N3之间没有显著性差异, 表明N2、N3浓度的N添加对植物生长没有实质性的抑制作用。图1a中, N5与N1、N2、N3、N4有显著性差异, 图1c中, N4、N5与N1、N2、N3有显著性差异, 图1b、图1d、图1e和图1f中, N5与N1、N2、N3有显著性差异, 以上表明高浓度的N添加(N5)对长脐红豆生长有抑制作用。
对比LP和HP处理, P的添加令植物生长指标的趋势不同, 且在N1处理(没有N添加对照)下, LP与HP差距最大, 在N3处理下HP高于LP。
2.2 土壤N、P添加对植物组织N、P含量的影响
在LP处理下(表1), 随着N浓度增大, 长脐红豆幼苗根和叶的全N含量均呈现先升高后降低的趋势, 均在N4处理达到最大, 在N4和N5处理下根的全N含量较大。不同N处理对叶全P含量无显著影响, 根全P含量呈现先下降后上升趋势, N1、N2、N3处理下叶全P含量较高; 根的全N和全P表现出相反趋势。
在HP处理下(表1), 随着N浓度增大, 根和叶的全N含量均呈现先升高后降低的趋势, 均在N4达到最大, 叶片的全N含量均比根高。根和叶全P含量均呈现先下降后上升趋势, 均在N3处理下达到最小; N4处理下, 根全P含量较高。根、叶的全N和全P含量表现出相反趋势。

表1 不同土壤N、P添加处理下长脐红豆幼苗的组织N、P含量及N: P比(平均值±标准偏差)
注: 没有字母标注表示各处理间均无显著差异。
对于根和叶的N: P来说(表1): 在LP处理下, 根的N、P含量呈现先升高后下降的趋势, 在N3达到最大, N1、N5与N2、N3、N4有显著差异; 叶片N:P无显著差异, 在N5处理下最大。在HP处理下,根和叶的N: P呈现先升高后下降的趋势, 在N3达到最大。
2.3 土壤N、P添加对根际和非根际土壤pH、N、P的影响
不同N、P处理对长脐红豆幼苗的根际和非根际土壤pH产生显著影响。LP处理下, 根际土壤的pH在N添加后减小, 即N1与N2、N3、N4、N5有显著性差异。非根际土壤pH随N添加浓度增加而下降, N1、N5分别与N2、N3、N4有显著差异。根际土壤的pH比非根际土壤的pH要大。HP处理下, 根际和非根际土壤pH变化与LP处理无显著差异(图2b)。
不同N、P处理对根际和非根际土壤全N含量也产生显著影响, 即随着N添加浓度增加, 根际和非根际土壤全N含量增加。图2c中, N1、N2、N3、N4处理下, 根际土壤较非根际土壤全N含量大, N5处理下相反; 图2d中, N1、N3、N4处理下, 根际土壤较非根际土壤全N含量大, N2、N5处理下相反。
不同N、P处理对根际和非根际土壤氨态氮、硝态氮含量均产生显著影响, 都随N添加浓度的增加而增加。图2g、2h、2i和2j中, 非根际土壤的氨态氮、硝态氮含量均比根际土壤高。
不同N、P处理对根际和非根际土壤全P含量无显著影响。HP处理下, 根际和非根际土壤全P含量都表现出先升高后降低的趋势, 根际土壤在N2处理达到最大, 非根际土壤在N4达到最大。
在LP处理下, 不同N添加处理对根际土壤有效P含量产生显著影响(图2k), N1与N2、N3、N4、N5有显著差异, 表明N肥的添加可以提高根际土壤有效P含量; 非根际土壤有效P含量无显著差异, N3、N4、N5与N1处理相比, 有增加的趋势。HP处理下, 根际土壤有效P含量呈现先升高后下降趋势, 在N4处理下, 根际土壤有效P含量较高, 非根际土壤有效P含量几乎没有变化。
3 讨论
3.1 不同氮磷的供应与长脐红豆自身需求的平衡机制
N作为生态系统最为重要的营养物质, 不仅是生物有机体蛋白质和核酸的重要组成元素, 也是生态系统净初级生产力的限制因子[21]。P是生物固氮作用所必需的营养元素, P的有效性低时可显著影响豆科植物的产量[22-23]。因此N、P是植物生长发育不可或缺的两种关键营养元素, 且具有调节植物生长的作用。本实验表明, 在LP处理下, 长脐红豆在低N添加的 N1、N2处理下生长较好, 中N添加的N3、N4处理下次之, 高N添加的N5处理有明显的抑制作用, 在苗木生长后期, N5处理下的长脐红豆开始出现枯落叶及萎蔫的情况, 这些都表明长脐红豆属于低N需求植物, 这与长脐红豆在海南尖峰岭60 hm2大样地中分布在土壤低N区域的情况相符[14]。在HP处理下, 长脐红豆的最适生长N浓度在N2、N3处理下生长较好。根据植物生长最小因子限制定律[24], 植物的生长取决于处在最小量的必须物质, 在适当提高P浓度情况下, 最适N浓度会增大, 与本试验结果相符。
可以进行共生固氮的豆科植物有个鲜明的特点: 大多数情况下, 具有较高的平均组织N浓度; 而且固氮和非固氮的豆科植物都比非豆科植物的叶片N含量要高[25-30]。McKey[25]假设这种高组织N浓度是豆科植物之前共生固氮的进化策略的反应, 进一步表明高组织N浓度是豆科植物所必须的。植物根、茎、叶中的N、P含量受土壤可利用养分含量及自身需求双方面的影响, 因此植物组织的养分比率常常会趋向固定的比值, 这一比值可以反映植物体内养分的利用状况[31]。本试验表明, 随着N浓度的增加, 不论是LP还是HP处理, 根和叶的全N含量均出现先升高后下降的趋势, 在N4处理下达到最大; 根的全P含量出现先下降后上升趋势; 叶的全P含量在LP处理下出现下降趋势, 在HP处理下呈现先下降后上升趋势。这与营养元素稀释效应[32]相符, 即, 当某一营养元素供应水平增加时, 会明显促进植物生长和该元素含量的增加, 但对其它稳定供应的营养元素的含量造成相对稀释的作用, 使其在植物体内的含量降低。
3.2 化学计量比与养分限制的诊断
N和P作为植物生长的必需营养元素和生态系统常见的限制性营养元素, 在植物体内存在功能上的联系[33], 通常用N: P比来计量。根据植物营养平衡理论, 从水生生态系统的研究发展起来的植物组织N: P比化学计量比被广泛应用于陆地植物N、P限制的诊断[34]。叶片是植物生理代谢最为活跃的器官, 被认为是对土壤养分供应水平最为敏感的部位[35]。所以一般可根据植物鲜叶中的N、P含量及N: P可以推断出植物所受营养的限制状况, Koerselman et al.[36-37]研究表明, 植物鲜叶N: P比<14, 且N浓度<20.0 mg·g-1, 受N限制; N: P比>16, 且P浓度<1.0 mg·g-1, 受P限制; 而当14
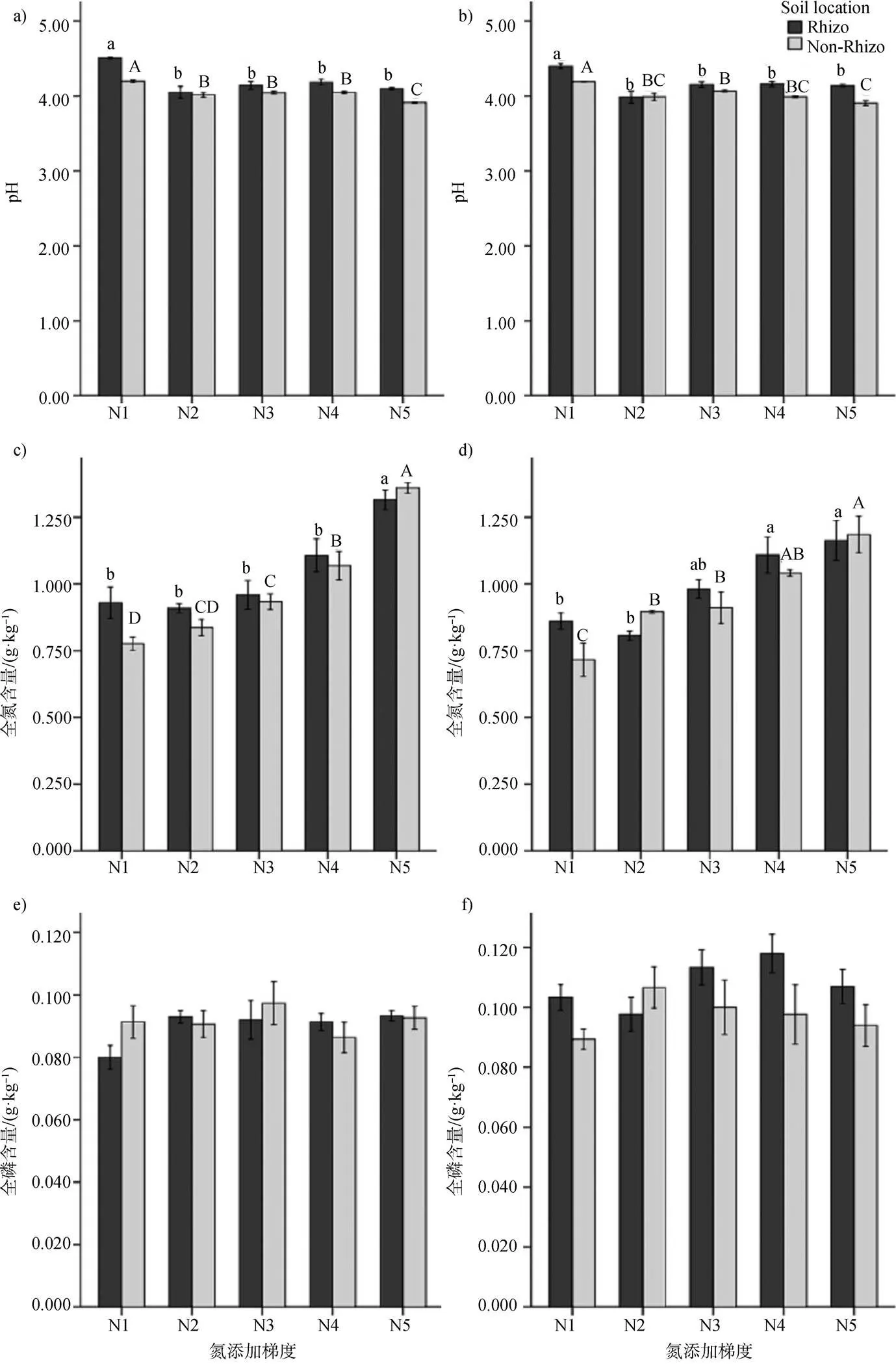
图 2 不同氮磷处理对根际和非根际土壤各指标的影响。a)、c)、e)、g)、i)、k)为LP处理, b)、d)、f)、h)、j)、l)为HP处理。条形柱上标有不同字母表示氮肥处理间差异显著(<0.05), 反之差异不显著(>0.05)。小写字母(a, b, c)表示根际土壤(Rizoshpe)之间显著性差异, 大写字母(A, B, C)表示非根际土壤(non-Rizo)之间显著性差异。没有字母标注表示各处理间均无显著差异。
Figure 2 Effects of nitrogen and phosphorus additions on the rhizosphere and non-rhizosphere soil nutrients. a), c), e), g), i), k) under LP treatment; b), d), f), h), j), l) under HP treatment. Different letters above the bars indicate significant differences between different soil indices under nitrogen addition treatment (<0.05), otherwise not significant differences (>0.05). The lowercase letters (a, b, c) are used to indicate if there are significant differences among rhizosphere soil (Rhizo) treatments, and the capital letters (A, B, C) are used to indicate if there are significant differences among non-rhizosphere soil (non-Rhizo) treatments. No letters indicate there are not significant differences among rhizosphere or non-rhizosphere soil treatments.
虽然Koerselman et al.[36]的试验是通过40个野外施肥控制试验对湿地生态系统的植物在群落水平上得出N: P比限制的结论, 许多文章已经直接应用这一结果来检验群落受N、P限制程度[38-39], 但目前对于将该N: P比推广应用到一般生态系统目前还有不同的观点[40]。关于N: P比临界值的确定, 基于不同地区、不同群落水平, 不同学者总结出不同的N: P比临界值。例如, Gusewell[41]通过大量研究结果得出类似诊断标准: N: P比<10时, 受N限制; N: P比>20时, 受P限制。Zhang et al.[42]通过对内蒙古草原区草本植物的施肥试验得出: N: P比<21时, 受N限制; N: P比>24时, 受P限制。因此, 目前N、P临界比值在水生生态系统中应用比较成熟, 但在陆地生态系统中尚有争议, 由于陆地生态系统中土壤异质性高, 纬度、温度等环境因子影响大, 植被或群落或物种的研究尺度不同, 很难得到一个统一的N、P临界比值, 还需进一步的研究总结[43]。
3.3 关于豆科树木幼苗能否改善土壤肥力问题
本试验中, N、P添加改变了土壤的养分含量, 但不同处理间存在差异。全N、氨态氮、硝态氮这3个指标都随N添加浓度的增加而增加, 其中氨态氮和硝态氮增加幅度较大且明显。然而, N、P的添加对土壤全P无显著影响; LP处理下, 根际和非根际土壤有效P含量随N添加浓度增加而提高; HP处理下, N添加处理对非根际土壤有效P无显著影响, 变化不大, 但根际土壤的有效磷呈先上升后下降趋势; 这说明了长脐红豆对土壤P的需求是与对土壤N的需求相适应的。
根际是研究植物、土壤、微生物之间相互联系的重要生态领域[44], 豆科植物可以通过根系次生代谢物的分泌, 对根际土壤养分产生反馈或改良作用。进一步考虑长脐红豆是否对N、P添加产生反馈, 本文将非根际土壤N、P含量指标视为根际土壤N、P含量的对照, 通过两者的差异比较分析, 探讨随着N添加浓度的增加, 根系对根际土壤的氨态氮、硝态氮、有效P在幼苗期有无显著的改良作用。结果显示, 基于氨态氮、硝态氮、有效P这3个肥力指标来看, 非根际土壤肥力>根际土壤肥力, 这说明长脐红豆对根际土壤养分产生了明显的吸收利用, 从而导致根际土壤养分浓度的降低, 说明试验期内长脐红豆幼苗对土壤肥力并没有显著的改良作用, 因为在苗木8个月收获时其根系并没有观测到明显的根瘤, 即何时能够形成共生而对土壤肥力有改善作用的时间尚不能确定。这与生长期短的豆科农作物明显不同, 以往基于农作物系统的研究来看, 豆科固氮植物能尽快地对土壤肥力产生改良作用[45-47]。因此, 在豆科树木的苗木培育中, 仍需要考虑不同种类间差异补充适量的N、P等养分。本试验仅针对一种豆科树木苗期阶段进行观测分析, 下一步应开展更长期的控制试验, 深入探讨多种豆科树木根系与根瘤共生的形成时间以及成年豆科树木是否具有改善土壤肥力的作用等科学问题。
4 结论
总体上看, 本研究揭示了豆科植物长脐红豆在不同土壤N、P添加条件下的生长变化规律, 及其对根根际和非根际土壤N、P等营养元素的反馈调节。结果支持该植物是一种中低N需求的植物, 其对土壤P的需求会随着外界土壤N的浓度变化而变化。而且, 该植物在幼苗期并未表现出明显的利它作用, 即提高植株邻近土壤的有效养分浓度, 该植物在幼苗期还是以对土壤养分的需求为主, 而非供给。
试验中得到了陆俊琨、黄凤林、彭儒明和李永玲等人的帮助, 一并致谢。
[1] ELSER J J, HAMILTON A. Stoichiometry and the new biology: The future is now[J]. PLOS Biology, 2007, 5(7): e181.
[2] VITOUSEK P M, PORDER S, HOULTON B Z, et al. Terrestrial phosphorus limitation: Mechanisms, implications, and nitrogen-phosphorus interactions[J]. Ecological Application, 2010, 20(1): 5–15.
[3] SUTER M, CONNOLLY J, FINN J A, et al. Nitrogen yield advantage from grass-legume mixtures is robust over a wide range of legume proportions and environmental conditions[J]. Global Change Biology, 2015, 21: 2424– 2438.
[4] Gei M G, Powers J S. Do legumes and non-legumes tree species affect soil properties in unmanaged forests and plantations in Costa Rican dry forests? [J] Soil Biology and Biochemistry, 57(3): 264–272.
[5] VITOUSEK P M, HOWARTH, R W. Nitrogen limitation on land and in the sea: How can it occur? [J]. Biogeochemistry, 1991, 13(2): 87–115.
[6] VITOUSEK P M, CASSMAN K, CLEVELAND C C, et al. Towards an ecological understanding of biological nitrogen fixation[J]. Biogeochemistry, 2002, 57(1): 1–45.
[7] TER STEEGE H., PITMAN N.C.A., PHILIPS O.L., et al. Continental-scale patterns of canopy tree composition and function across Amazonia[J]. Nature, 2006, 443(7110): 444–447.
[8] HEDIN L O, BROOKSHIRE E N J, MENGE D N L, et al. The nitrogen paradox in tropical forest ecosystems[J]. Annual Review of Ecology Evolution & Systematics, 2009, 40(1): 613–635.
[9] MENGE D N L, BATTERMAN S A, HEDIN L O, et al. Why are nitrogen-fixing trees rare at higher compared to lower latitudes? [J] Ecology, 2017, 98(12): 3127–3140.
[10] LAI H R, HALL J S, BATTERMAN S A, et al. Nitrogen fixer abundance has no effect on biomass recovery during tropical secondary forest succession. Journal of Ecology, 2018, doi: https://doi.org/10.1111/1365–2745.12979.
[11] MENGE D N L, CHAZDON R L. Higher survival drives the success of nitrogen-fixing trees through succession in Costa Rican rainforests. New Phytologist, 2016, 209(3): 965–977.
[12] MENGE D N L, BATTERMAN S A, LIAO W, et al. Nitrogen-fixing tree abundance in higher-latitude North America is not constrained by diversity. Ecology Letters, 2017, 20(7): 842–851.
[13] TAYLOR B N, CHAZDON R L, BACHELOT B, et al. Nitrogen-fixing trees inhibit growth of regenerating Costa Rican rainforests. Proceedings of the National Academy of Sciences of the United States of America, 2017, 114(33): 8817–8822.
[14] 许涵, 李意德, 骆土寿, 等. 海南尖峰岭热带山地雨林——群落特征、树种及其分布格局[M]. 北京: 中国林业出版社, 2015.
[15] LIU Yanyan, WU Lianhai, BADDELEY J A, et al. Models of biological nitrogen fixation of legumes. A review[J]. Agronomy for Sustainable Development, 2011, 31(1): 155–172.
[16] NG A Y S. Symbiotic nitrogen fixation by native woody legumes(leguminosae) in Hong Kong, China[J]. HKU Theses Online, 2009.
[17] NG A Y S, HAU B C H. Nodulation of native woody legumes in Hong Kong, China[J]. Plant and Soil, 2009, 316: 35–43.
[18] 李意德, 许涵, 骆土寿, 等. 中国生态系统定位观测与研究数据集: 生物特种数据集[M]. 北京: 中国农业出版社, 2012.
[19] 周璋, 李意德, 林明献, 等. 海南岛尖峰岭热带山地雨林区26年的气候变化特征—— 光、水和风因子[J]. 生态学报, 2009, 29(3): 1112–1120.
[20] 鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000.
[21] BASHKIN V N. Modern Biogeochemistry[M]. Secaucus, NJ, USA: Kluwer Academic Publishers, 2002.
[22] HØGH-JENSEN H, SCHJOERRING J K, SOUSSANA J F. The influence of phosphorus deficiency on growth and nitrogen fixation of white clover plants[J]. Annals of Botany, 2002, 90(6): 745–753.
[23] MIAO Shujie, QIAO Yunfa, HAN Xiaozeng, et al. Nodule formation and development in soybeans (L.) in response to phosphorus supply in solution culture[J]. Pedosphere, 2007, 17(1): 36–43.
[24] 沈国英, 施并章. 海洋生态学[M]. 北京: 科学出版社, 2002.
[25] MCKEY D. Legumes and nitrogen – the evolutionary ecology of a nitrogen demanding lifestyle. In: Sprent J I, McKey D, eds. Advances in legume systematics, Part 5: the nitrogen factor[M]. Kew, UK: Royal Botanic Gardens, 1994: 211–228.
[26] TOWNSEND A R, CLEVELAND C C, ASNER G P, et al. Controls over foliar N:P ratios in tropical rain forests[J]. Ecology, 2007, 88(1): 107–118.
[27] FYLLAS N.M., PATIÑO S., BAKER T.R., et al. Basin- wide variations in foliar properties of Amazonian forest: Phylogeny, soils and climate[J]. Biogeosciences, 2009, 6(11): 2677–2708.
[28] NASTO M K, ALVAREZ-CLARE S, LEKBERG Y., et al. Interactions among nitrogen fixation and soil phosphorus acquisition strategies in lowland tropical rain forests[J]. Ecology Letters, 2014, 17(10): 1282–1289.
[29] ADAMS M A, TURNBULL T L, SPRENT J I, et al. Legumes are different: Leaf nitrogen, photosynthesis, and water use efficiency[J]. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(5): 4098–4103.
[30] BHASKAR R, PORDER S, BALVANERA P, et al. Ecological and evolutionary variation in community nitrogen use traits during tropical dry forest secondary succession[J]. Ecology, 2016, 97(5): 1194–1206.
[31] PTACNIK R, JENERETTE G D, VERSCHOOR A M, et al. Applications of ecological stoichiometry for sustainable acquisition of ecosystem services[J]. Oikos, 2005, 109(1): 52–62.
[32] 彭少麟, 任海, 张倩媚. 退化湿地生态系统恢复的一些理论问题[J]. 应用生态学报, 2003, 14(11): 2026–2030.
[33] REICH P B, OLEKSYN J. Global patterns of plant leaf N and P in relation to temperature and latitude[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(30): 11001-11006.
[34] 赵琼, 曾德慧. 林木生长氮磷限制的诊断方法研究进展[J]. 生态学杂志, 2009, 28 (1): 124–130.
[35] TAMM C O, ARONSSON A, POPOVIC B. Nitrogen saturation in a long-term forest experiment with annual additions of nitrogen[J]. Water Air & Soil Pollution, 1995, 85(3): 1683–1688.
[36] KOERSELMAN W. The vegetation N:P ratio: a new tool to detect the nature of nutrient limitation[J]. Journal of Applied Ecology, 1996, 33(6): 1441–1450.
[37] GUSEWELL S, KOERSELMAN W, VERHOEVEN J T A. Biomass N: P rations as indictors of nutrient limitation for plant populations in wetland[J]. Ecological Applications, 2002, 13(2): 372–384.
[38] 陈钦程. 施肥对华北落叶松人工林土壤与植株氮磷钾的影响[D]. 杨凌: 西北农林科技大学, 2015.
[39] 于钦民. 秦岭华北落叶松人工林叶茎根氮磷含量动态变化与N:P化学计量学特征研究[D]. 杨凌: 西北农林科技大学, 2014.
[40] 高三平. 天童常绿阔叶林不同演替阶段N、P化学计量学研究[D]. 上海: 华东师范大学, 2008.
[41] GUSEWELL S. N:P ratios in terrestrial plants: variation and functional significance[J]. New Phytologist, 2004, 164(2): 1469–8137.
[42] ZHANG Lixia, BAI Yongfei, HAN Xinguo. Different responses of N:P stoichiometry ofandto N addition in a steppe ecosystem in Nei Mongol[J]. Acta Botanica Sinica, 2004, 46(3): 259– 270.
[43] 高三平, 李俊祥, 徐民策, 等. 天童常绿阔叶林不同演替阶段常见种叶片N、P化学计量学特征[J]. 生态学报, 2007, 27(3): 947–952.
[44] 安韶山, 李国辉, 陈利顶. 宁南山区典型植物根际与非根际土壤微生物功能多样性[J]. 生态学报, 2011, 31(18): 5225–5234.
[45] 邱权, 李吉跃, 王军辉, 等. 西宁南山4种灌木根际和非根际土壤微生物、酶活性和养分特征[J]. 生态学报, 2014, 34(24): 7411–7420.
[46] 李金辉, 卢鑫, 周志宇, 等. 不同种植年限紫穗槐根际非根际土壤磷组分含量特征[J]. 草业学报, 2014, 23(6): 61– 68.
[47] 袁雪红, 高照良, 张翔, 等. 不同豆科植物对黄土高原弃土场的改良效果[J]. 中国水土保持科学, 2016, 14(4): 121–127.
Growth performance ofseedlings and their feedbacks on the soil nutrient under varied soil nitrogen and phosphorus addition conditions
XIE Yaxin, LIN Mingxian, XU Han*, WANG Zhongqing, LI Yide
Research Institute of Tropical Forestry, Chinese Academy of Forestry and Jianfengling National Key Field Research Station For Tropical Forest Ecosystem, Hainan Island, China, Guangdong, Guangzhou 510520, China
By the greenhouse control experiment, the growth performance ofseedlings and their feedbacks on the soil nutrients were observed under five nitrogen (N, N1-N5) gradients and two phosphorus (P, LP-HP) addition gradients. Aboveground and belowground growth indices, total leaf area, N and P concentration of leaves and roots, rhizosphere and non-rhizosphere soil N and P concentration were measured after seedlings were harvested. The results are as follows. (1) By considering shoot height, total leaf area, shoot biomass, root biomass, root length and root surface area together, under the low phosphorus addition (LP) condition,seedlings were inhibited by the middle N addition concentration of N4 treatment and high N addition concentration of N5 treatment. Under the high phosphorus addition (HP) condition,seedlings were only inhibited by the high N addition concentration of N5 treatment. Therefore, the optimal growth N concentration ofseedlings increased with the increase of P addition. (2) With the increase of N addition concentration, the total N concentration of roots and leaves increased firstly and then decreased, reaching the maximum at the N4 treatment. However, total P concentration showed the opposite trend, which was consistent with the dilution effect of nutrients. Moreover, leaf N:P ratio > 16 and leaf P concentration was less than 1.0 mg·g-1, which indicated thatseedlings were limited by the P. (3) In terms of three soil fertility indices including soil ammonium nitrogen, nitrate nitrogen and available P, non-rhizosphere soil fertility> rhizosphere soil fertility, it indicated thatdid not significanlty change the soil fertility at the seedling stage and needed extra fertilization to facilitate their growth.
legume;; growth index; tissue nitrogen and phosphorus concentration; N:P ratio; rhizosphere and non-rhizosphere soil
10.14108/j.cnki.1008-8873.2019.02.009
S718.5
A
1008-8873(2019)02-056-11
2018-03-26;
2019-02-23
中国林业科学研究院中央级公益性科研院所基本科研业务费专项资金(RITFYWZX201505); 国家自然科学基金(31670628); 尖峰岭国家级森林生态站运行费
解亚鑫(1992—), 女, 河北邢台人, 硕士研究生, 主要从事森林生态学研究, E-mail: 2678269608a@sina.com
许涵, 男, 博士, 研究员, 主要从事森林生态学研究, E-mail: hanxu81@gmail.com
解亚鑫, 林明献, 许涵, 等. 长脐红豆幼苗生长对不同土壤氮磷添加的响应及其对土壤养分的反馈[J]. 生态科学, 2019, 38(2): 56-66.
XIE Yaxin, LIN Mingxian, XU Han, et al. Growth performance ofseedlings and their feedbacks on the soil nutrient under varied soil nitrogen and phosphorus addition conditions[J]. Ecological Science, 2019, 38(2): 56-66.

