小型猪颌下腺放射性损伤模型IVIM MRI及与病理的对照研究
王鹏,马婕,欧阳高雄,左志超,金观桥,苏丹柯,罗宁斌
放射治疗是头颈部恶性肿瘤的主要治疗手段之一,不仅能够有效地缩小原发灶,还能明显减少肿瘤的复发和转移,所以其疗效在临床实践中被广泛认可。但由于放射线具有辐射作用,尤其在反复多次的放射治疗过程中,癌灶周围正常组织也会因辐射而发生放射性损伤。在鼻咽癌的放射治疗过程中,唾液腺发生放射性损伤尤为多见。颌下腺作为三大唾液腺之一,唾液分泌量约占静息状态下唾液总量的70%[1],且其组织构成中的浆液性腺泡细胞对放射线敏感,多次放疗患者会因放射剂量的累积效应导致浆液性细胞发生急性凋亡[2],从而造成患者唾液腺功能降低和唾液量减少,导致患者的生活质量下降。因此,临床上应对颌下腺的放射性损伤给予足够的重视,准确客观地评价颌下腺的放射性损伤,有利于临床合理制定放疗计划,降低颌下腺的放射性损伤程度,对于改善患者的生活质量具有重要意义。传统影像学评估手段中X线造影、CT及ECT检查均具有一定创伤性,而超声检查的操作难度较大。近年来,MR-IVIM序列作为双指数模型扩散加权成像技术,主要应用于肿瘤的诊断和鉴别诊断、复发监测以及疗效评价等[3],同时在唾液腺放射性损伤的评估方面也表现出较大优势[4],但其在颌下腺放疗损伤的评估及其与病理的相关性研究鲜有文献报道。因此,本研究通过建立小型猪颌下腺放射性损伤模型,运用IVIM-MR成像技术,评估颌下腺放疗损伤的程度,并探讨IVIM各参数值(D、D*和f)与放射线所致颌下腺病理改变的相关性,为今后MR-IVIM技术应用于放射性损伤的无创性评估奠定基础。
材料与方法
1.实验动物
自广西大学动物科学技术学院购进健康雌性2~3个月龄、体重(10.6±1.5) kg的广西巴马小型猪9只(许可证号:SCXK桂2013-0003),标准饲料喂养。将小型猪随机分成3组,即实验A组(20Gy组)、实验B组(15Gy组)及对照组(0Gy),每组各3只小型猪(双侧颌下腺共计6个样本)。
2.建立唾液腺放疗损伤模型
实验过程中,采用盐酸氯胺酮注射液(福建古田药业,0.1 g/支)和咪达唑仑注射液(江苏恩华药业,5 mg/支)联合用药,二者按照2:1的比例配伍后对实验用小型猪进行肌肉注射麻醉,用药剂量为0.6 mL/kg,以小型猪的左侧耳后距离背部中线约2 cm处为进针点。在建立小型猪放疗模型前一日,完成所有小型猪的IVIM-MRI检查。第二日进行小型猪颌下腺的照射处理,待小型猪麻醉完全后,取俯卧位将猪固定于放疗台正中线上。采用美国瓦里安电子直线加速器(6 ex)对颌下腺进行照射处理,以下颌角为照射中心点,单后野垂直照射一侧的颌面部组织,照射距离约100 cm,照射范围为体中线至距离体表3 cm,照射野为8 cm×8 cm,射线平均能量6 mV。实验A组双侧颌下腺分别接受照射剂量为20Gy,实验B组双侧颌下腺分别接受照射剂量为15Gy,对照组双侧颌下腺的照射剂量为0Gy。
3.MRI检查方法
使用GE Discovery 750W 3.0T磁共振扫描仪和16通道头颈联合线圈。将麻醉完全的小型猪头颈部置于线圈内,身体正中线与检查床平行。扫描序列及参数:FSE T1WI 序列,TR 599 ms,TE 15.6 ms,视野200 mm×200 mm,矩阵320×256,层厚3 mm,层间距1 mm;T2WI 序列,TR 5658 ms,TE 88.312 ms、视野200 mm×200 mm、矩阵256×288、层厚1 mm、层间距1 mm;IVIM序列,TR 5000 ms,TE 92.6 ms,层厚4 mm,层间距2 mm,视野200 mm×200 mm、矩阵128×128,b值取14个(分别为0、20、50、80、100、150、180、200、300、500、800、1000、1500和2000 s/mm2)。所有实验猪于放射线照射的前一日及第四周末分别按上述扫描参数进行IVIM-MRI扫描。
将MRI数据传送至GE AW4.6工作站,使用Function Tool软件对IVIM图像进行后处理,生成相应双指数模型下的D、D*及灌注系数f值的伪彩图。结合常规T1WI及T2WI,选择颌下腺最大层面的图像,在DWI图像上手动勾画感兴趣区(ROI),注意避开腺体边缘区域,每侧颌下腺每个参数重复测量3次,取平均值。
4.组织病理学检查
在放射线照射后第四周末,对所有小型猪再次进行IVIM-MRI检查。检查结束后第二日,于动物实验中心解剖室采用空气栓塞法处死所有小型猪,摘取颌下腺组织,将其置于10%的福尔马林溶液中固定12 h,然后进行组织脱水及石蜡包埋,并行3 μm厚的连续切片。组织切片完成后行HE染色于电子显微镜下观察病理改变,采用Image J软件(https://imagej.nih.gov/ij/)分析实验组和对照组颌下腺HE染色切片下的腺泡面积百分比。首先在低倍镜下(×100)选取一个中心点,然后以该点为中心,顺时针选取9个面积相同的视野,保存其高倍镜(×400)视野下的图像共9帧,每帧图像使用Image J软件勾画腺泡的面积,分别勾画三次进行测量,取3次测量的平均值,再计算出9张图像中腺泡面积在总的图像面积所占百分比。将颌下腺组织中腺泡面积较对照组减少10%及以上即认为颌下腺放射性损伤模型建立成功[5]。

表1 照射前三组小型猪颌下腺IVIM参数值比较

表2 照射后三组小型猪颌下腺IVIM参数值比较

表3 照射前后20Gy组小型猪颌下腺IVIM参数值比较

表4 照射前后15Gy组小型猪颌下腺IVIM参数值比较

表5 照射前后对照组小型猪颌下腺IVIM参数值比较
免疫组织化学检查采用兔多克隆抗体CD31(Abcam公司)相关抗原,通过二步法标记血管内皮细胞,参照Weidner等[6]提出的评判标准,计算着色的微血管和毛细血管,凡呈现棕色的单个内皮细胞或内皮细胞群、内皮细胞簇和内皮细胞条索,且与周围组织有明显界限者,按1个血管计数,不考虑管腔或有无红细胞存在,带有明显肌层的血管不纳入计数。先在低倍镜下(×40)选择5个MVD“热点”,然后在高倍镜下(×400)计数,取5个“热点”的平均值作为最终的MVD值。
5.统计学分析
使用SPSS 19.0统计学软件进行数据分析,计量资料以均数±标准差的形式表示。实验组和对照组小型猪在照射前、后颌下腺的IVIM参数(D值、D*值及f值)的比较采用配对样本t检验。采用单因素方差分析比较三组小型猪颌下腺IVIM参数,采用Spearman相关分析法对D值与腺泡面积百分比、D*值和f值与MVD值的相关性进行分析。以双侧P<0.05为差异具有统计学意义。
结 果
1.三组小型猪IVIM参数值
照射前三组小型猪颌下腺的D、D*及f值及比较结果见表1。三组间这3项参数值的差异均无统计学意义(P>0.05)。
照射后三组小型猪颌下腺的D、D*和f值及比较结果见表2。三组间3项参数值的差异均有统计学意义(P<0.05)。
实验组A中在照射前后小型猪颌下腺(图1~2)的IVIM参数值(D值、D*值和f值)及比较结果见表3,三项参数的测量值在照射前后的差异均有统计学意义(P<0.05)。实验组B中小型猪颌下腺在照射前后的IVIM参数值及比较结果见表4,三项参数的测量值在照射前后的差异均有统计学意义(P<0.01)。对照组小型猪颌下腺照射前后IVIM参数值及比较结果见表5,三项参数的测量值在照射前后的差异均无统计学意义(P>0.05)。
2.实验组和对照组的病理表现
对照组中小型猪颌下腺标本的HE染色显微镜下表现(图3):腺泡细胞显示完整,胞浆丰富,细胞核深染、无皱缩。实验组中小型猪颌下腺标本的HE染色显微镜下表现(图4):浆液性腺泡细胞出现萎缩、变小,相应细胞核轻度固缩,胞浆嗜酸性变,少数淋巴细胞浸润,并见轻度纤维增生。实验组免疫组化血管标记后表现(图5):微血管内皮细胞被标记成棕色。

图1 照射前实验组小型猪颌下腺IVIM-MRI,扫描数据在工作站经后处理软件自动生成相应的各项参数图,通过在DWI上勾画感兴趣区域,可得到各项参数值。a)DWI;b)D值伪彩图;c)D*值伪彩图;d)f值伪彩图。 图2 照射后实验组小型猪颌下腺IVIM-MRI。a)DWI图上勾画感兴趣区,显示双侧颌下腺信号较照射前降低;b)D值伪彩图显示纯扩散系数升高;c)D*值伪彩图显示假性扩散系数降低;d)f值伪彩图显示灌注分数升高。
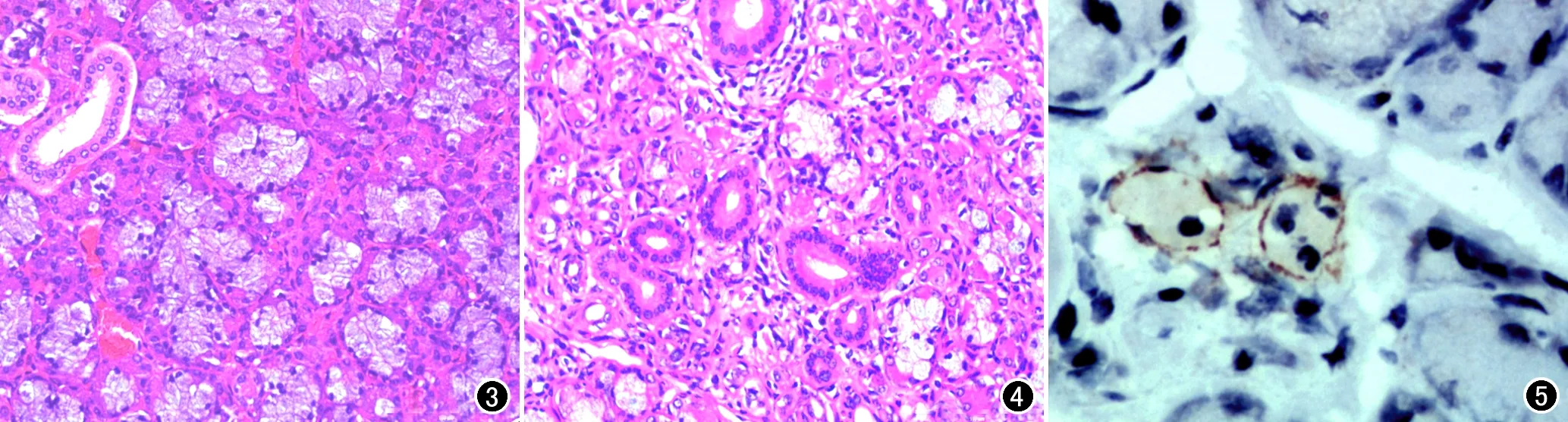
图3 对照组颌下腺组织病理片,镜下示正常腺泡细胞(×400,HE)。 图4 实验组照射后4周颌下腺组织病理片,镜下示腺泡细胞萎缩(×400,HE)。 图5 实验组照射后4周颌下腺组织微血管免疫组化染色,镜下示颌下腺内被标记成棕色的微血管(×400)。
Image J软件分析结果显示,对照组、实验B组和实验A组中腺泡面积百分比分别为41.4133%±3.6951%、26.2667%±3.3657%和20.7283%±2.9867%,三组间的差异具有统计学意义(F=60.878,P=0.000)。免疫组化检查结果显示,三组小型猪颌下腺的MVD分别为25.9667±2.4246、18.9167±2.8358和18.5333±2.3822,三组间的差异具有统计学意义(F=16.091,P=0.000)。
3.IVIM参数值与病理指标的相关性
实验组小型猪的颌下腺腺泡面积较对照组明显减少,照射后颌下腺D值较对照组升高,相关性分析显示D值与腺泡面积百分比呈负相关(r=-0.639,P=0.004;图6)。实验组小型猪颌下腺的MVD较对照组减少,照射后D*值较对照组降低,相关性分析显示D*值与MVD呈正相关(r=0.767,P<0.000;图7);f值与MVD呈负相关(r=-0.631,P=0.005;图8)。
讨 论
IVIM技术是Le等[7]最早提出的采用双指数模型DWI来描述体素内信号衰减与b值间关系的一种新MRI技术,采用多b值DWI进行分析,可以同时得到水分子扩散参数(真性扩散分数D)以及组织灌注相关参数(灌注分数f和假扩散系数D*),用于量化分析组织中水分子的扩散和灌注两种运动成分。在b值小于200 s/mm2时,DWI对微循环灌注效应更加敏感,扫描过程中所监测到的信号衰减同时反映了组织内水分子的扩散和微循环毛细血管网内水分子的假性扩散;在b值大于200 s/mm2情况下,微循环灌注所产生的信号已基本衰减完毕,此时信号衰减基本只与体素内单纯水分子扩散相关[8]。鉴于IVIM扩散加权成像技术的成像特点,已有研究证实其在肿瘤的诊断和鉴别诊断方面具有较大的优势[4],对腮腺放射性损伤的评估也见诸文献报道[4],而对颌下腺放射性损伤的研究较为少见。多次接受放射治疗的头颈部肿瘤患者中,因颌下腺受损所致口干症的情况并不少见,降低了患者的生活质量。因此,对颌下腺放射性损伤情况进行评估,有利于临床制订合理的治疗方案,减少唾液腺放射性损伤的程度。
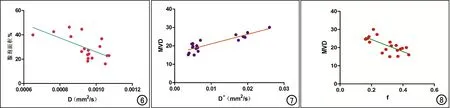
图6 三组小型猪颌下腺D值与腺泡面积百分比的相关性分析点线图,显示两个指标呈负相关。 图7 三组小型猪颌下腺D*值与MVD的相关性分析点线图,显示两个指标呈正相关。 图8 三组小型猪颌下腺f值与MVD的相关性分析点线图,显示两个指标呈负相关。
本研究通过建立小型猪颌下腺的放射损伤模型,发现与对照组比较,实验组中颌下腺的D值和f值升高、D*值减低,差异均有统计学意义,与Marzi等[4]和Zhou等[9]的研究结果基本一致。对IVIM参数与病理参数进行相关性分析,结果显示D值与腺泡面积百分比呈负相关,D*值与MVD呈正相关,f值与MVD呈负相关。D值为纯扩散系数,代表体素内单纯的水分子扩散运动。由于颌下腺组织内浆液性细胞对放射线敏感,经过放射线照射后,浆液性细胞容易发生放射性损伤,腺泡细胞坏死[10],导致颌下腺组织内细胞密度减低,细胞外水分子的扩散运动加剧,使得D值上升。本研究中病理HE染色结果显示实验组小型猪颌下腺组织内腺泡面积较对照组明显下降,差异具有统计学意义,且照射剂量越大,腺泡面积减少越明显,相关性分析显示D值与颌下腺腺泡面积呈负相关,说明了颌下腺组织在放射性损伤后D值的改变与腺泡面积的损伤和减少程度是一致的,因此通过D值的改变能够间接反映出腺体内腺泡的损伤情况。
D*值为假性扩散系数,代表体素内微循环灌注相关扩散运动,它与微血管的几何形态以及血管内血流速度紧密相关,主要受微血管结构及其血液流速的影响。颌下腺接受放射线照射后,血管内皮细胞主要呈现出凋亡反应[13],造成组织内毛细血管结构破坏,内皮下胶原暴露,促进了血小板的黏附聚集,毛细血管内微血栓形成[14],相应血流速度减低。说明放射线导致血管内皮细胞的损伤,不仅使腺体组织正常微血管结构发生改变,同时微血管内的血液流速降低,二者综合作用引起D*值的降低。本研究中免疫组化结果显示实验组小型猪腺体组织的MVD较对照组明显减少,差异有统计学意义(P<0.05),与颜兴等[15]在小型猪颌下腺放疗后的病理研究结果相一致;此外,本研究结果显示D*值与MVD呈正相关,说明了D*值的改变与微血管的改变存在关联,能够通过腺体组织D*值的改变间接反映组织内MVD的改变情况。
f值为组织内的灌注分数,代表扫描体素内微循环灌注效应占总体扩散效应的比例,其数值大小主要取决于组织内的血容量[11]。颌下腺组织接受放射线照射后,早期阶段组织内发生炎性反应,血管内皮细胞肿胀,残留的血管扩张充血[12],导致局部血容量增加,f值相应升高。相关性分析结果显示f值与MVD值呈负相关。分析其原因可能是由于照射剂量越大,相应腺体组织发生炎性反应的程度就越显著,虽然微血管密度减低,但最终组织炎性反应导致灌注成分的增加掩盖了因MVD减少所致的灌注减少的损失,或其它有待发现的机制,尚需进一步研究。
综上,IVIM扩散加权成像技术能够实时、无创地监测颌下腺组织的放射性损伤过程,并可通过IVIM参数对其损伤程度进行数据量化分析,可间接反映损伤颌下腺腺泡面积和MVD的病理改变,有望为临床的治疗决策提供更多的参考依据。但本研究尚有不足,实验样本量较少,可能存在选择偏倚等,下一步将扩大样本量进行更深入地分析和论证。

