感兴趣区选取方法对不同病理分级肝细胞癌ADC测量值的影响
袁灼彬, 郑晓林, 杨水清, 邹玉坚, 张世豪, 杨沛钦
磁共振扩散加权成像是一种能很好地反映生物组织中水分子微观热运动的功能成像方法[1]。与常规T1WI和T2WI序列相比,DWI可通过测量表观扩散系数(apparent diffusion coefficient,ADC)对病变进行定量分析,近年来已广泛应用于全身多个部位和器官病变的检出及定性诊断、良恶性肿瘤的诊断和鉴别诊断以及肿瘤疗效的评估等[2-5]。然而,ADC值的测量方法缺乏统一的操作标准,感兴趣区(region of interest,ROI)放置的位置和大小均可能影响ADC值的测量结果,导致不同观察者测量的ADC值存在较大差异,正常组织与病变的ADC值存在较大重叠区间,一定程度上限制了ADC值在临床上的应用[6-7]。本研究中分别采用小圆形ROI法、单层最大面积法和整体容积法对肝细胞癌(hepatocellular carcinoma,HCC)病灶进行ADC值测量,分析不同ADC值测量方法对不同病理分级肝细胞癌ADC值测量结果的影响以及观察者间的一致性。
材料与方法
1.一般资料
将2012年1月-2016年12月在我院行上腹部MRI扫描的44例肝细胞癌患者纳入研究。其中,男 40例,女 4例;年龄34~77岁,平均(55.9±10.5)岁,中位年龄58岁。所有患者在MRI扫描和手术前未接受过任何抗肿瘤药物治疗,有完整的手术记录和病理报告。共测量了47个病灶,其中高分化肝细胞癌9个,中分化肝细胞癌24个,低分化肝细胞癌14个;肿块直径1.63~20.98 cm,平均(4.13±1.25) cm。本研究经本院伦理委员会批准,检查前均获得患者及其家属同意,并签署知情同意书。
2.MRI扫描方法和参数
使用Siemens Magnetom Verio 3.0T超导磁共振扫描仪和16通道体部相控阵线圈。先行常规序列MR平扫,扫描序列及参数:半傅立叶采集单次激发快速自旋回波(half-fourier acquisition single-shot turbo-SE,HASTE)序列横轴面和冠状面T2WI(TR 1500 ms,TE 96 ms)和二维快速小角度激发快速梯度回波序列(two-dimensional fast low-angle shot gradient-echo sequence,2D FLASH GRE)横轴面T1WI(TR 110 ms,TE 2.46 ms),扫描15~20层,层厚6 mm,视野35 cm×35 cm~38 cm×38 cm,矩阵240×320,各个序列均在1次屏气时间内完成采集。
DWI采用单次激发SE EPI序列,患者在自由呼吸状态下进行扫描,扫描参数:TR 2500 ms,TE 73 ms,矩阵128×128,视野38 cm×38 cm,层厚6.0 mm,层间距0 mm,激励次数4,采集20层,b值分别取0和600 s/mm2,扫描时间94 s。本系统采用单指数衰减模型自动生成ADC图。
3.图像分析和数据测量
所有图像传送至Siemens Leonardo图像工作站进行后处理。由两位分别有5年和7年腹部MR诊断经验的主治医师采用双盲法进行数据的测量,参考T1WI、T2WI和动态增强图像观察肿瘤的位置、大小及形态,在ADC图像(b=600 s/mm2)上于病灶内勾画ROI进行ADC值的测量。分别采用以下3种方法绘制ROI(图1):①整体容积法(whole tissue volume,WTV),逐层沿病灶边缘稍内侧(1~2 mm)勾画ROI,将所有层面测量的ADC值取平均值(A组);②单层最大面积法(maximum areas on single slice,SSmax),选取肿瘤最大层面,沿病灶边缘稍内侧(1~2 mm)勾画ROI,重复测量3次,取其平均值(B组);③小圆形ROI法(several small round areas,SRAs),在DWI上于病灶内的高信号区勾画面积约20 mm2的小圆形ROI,测量其ADC值,尽量避开病灶内坏死、囊变和出血区域,然后将所选取的ROI复制后放置在病灶内其它的高信号区,重复测量3次,取平均值(C组)。

表1 两名观察者采用三种ROI设置方法测得的ADC值 (×10-3mm2/s)

表2 3种ROI设置方法获得的不同病理分级HCC的ADC值 (×10-3mm2/s)
4.肝细胞癌的病理学诊断标准
手术切除标本经10%中性福尔马林液固定,常规制备蜡块(脱水,透明,浸蜡,包埋),4 μm厚度连续切片,常规HE染色和免疫组织化学染色。根据HCC病灶内肿瘤细胞的排列、结构和形态特征将其划分为4个组织学分级。①高分化HCC:肿瘤细胞的形态类似于正常肝细胞,核质比例增加,排列呈细梁型,常形成假腺体样或腺泡状构型,常伴有脂肪变性。②中分化HCC:肿瘤细胞排列成粗梁状,细胞索在3层以上,核浆比增大,核染色加深,出现不明显的核仁,胞质嗜酸性增加,并出现腺样结构。③低分化HCC:肿瘤细胞形成实体状构型,缺乏窦隙状结构,核质比例明显增大,核异形性明显,出现较多核分裂象和瘤巨细胞。④未分化HCC:肿瘤病灶内以高度异形的肿瘤细胞为主,几乎无胞质,胞核深染、形态极不规则,梁状结构不明显。本研究中未发现未分化型HCC病例。
5.统计学分析

结 果
两位观察者采用3种ROI设置方法测量HCC的ADC值及对比分析结果见表1和图2。两位观察者采用单层最大面积法测得的ADC值的差异有统计学意义(P<0.05),而采用小圆形ROI法和整体容积法测得的ADC值的差异均无统计学意义(P>0.05)。三种ROI选取方法的观察者间一致性均较好,其中以整体容积法的观察者间一致性最佳(ICC=0.940)。
三种ROI选取方法测得的HCC的ADC值见表2。单层最大面积法和整体容积法测得的总体ADC平均值高于小圆形ROI法,单层最大面积法和整体容积法测量的ADC值与小圆形ROI法之间的差异有统计学意义(t=-4.522,P=0.000;t=-4.616,P=0.000),而单层最大面积法与整体容积法测量总体ADC值差异无统计学意义(t=-1.029,P=0.309)。Bland-Altman分析结果显示(图3),采用SRAs法获得的ADC值的标准差最高(260.7), WTV法测量的ADC值的标准差最低(107.1),提示WTV法测量的ADC值的一致性更好。
三种ROI选取方法测量的不同病理分级HCC的ADC值及对比分析结果见表2。单层最大面积法和小圆形ROI法测量的ADC值在不同级别HCC间的差异无统计学意义(P>0.05);整体容积法测得的ADC值在不同级别HCC间的差异有统计学意义(P<0.05),进一步两两比较,仅高分化组与低分化组间的差异有统计学意义(t=2.774,P=0.011)。小圆形ROI法测得的ADC值与肝癌的病理分级无显著相关性(r=0.250,P=0.09);单层最大面积法和整体容积法测得的ADC值与肝癌的病理分级呈正相关(r=0.374,P=0.01;r=0.366,P=0.01)。
讨 论
近年来,DWI在肝脏、乳腺、前列腺及骨髓等神经系统以外器官的研究中应用广泛,在病变检出、良恶性肿瘤的鉴别及肿瘤治疗效果的评价等方面的临床应用价值逐渐得到肯定[8-10]。然而,ADC值容易受到设备主磁场、扫描参数(包括TR、TE和b值等)、后处理系统和数据分析等诸多因素的影响,导致ADC值测量结果的差异较大,其中ROI设置方法对ADC值测量结果的影响尤为显著,ROI的范围、位置不同将会影响ADC值的测量结果和可重复性[11]。Koc等[12]研究认为当b=600 s/mm2时,DWI和ADC值对腹部良恶性病变的鉴别诊断敏感度、特异度和符合率分别为100%、93.8%和92.5%,更高b值并不能显著提高诊断的敏感度、特异度和符合率,因此本研究中选取b=600 s/mm2进行DWI扫描及ADC值测量。
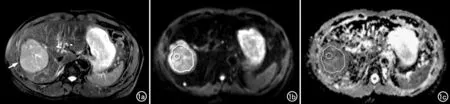
图1 男,51岁,肝右叶中分化肝细胞癌。a) 压脂T2WI,选取病灶最大层面,观察病灶的形态、大小、有无坏死囊变等(箭); b) DWI图(b=600s/mm2),整体容积法和单层最大面积法均为在DWI图像上沿病灶高信号区的稍内侧手动勾画ROI,小圆形ROI法则为在病灶内高信号区内手动勾画面积约为20mm2的圆形ROI;c) ADC图,复制DWI图上的ROI,将其相应地放置在肿瘤内低信号区,测量ADC值。

图2 两位观察者采用3种不同ROI勾画方法获得的肝细胞癌ADC值的箱形图。箱体两端边位置分别代表P25和P75,箱体中部横线代表中位数。 图3 两位观察者采用不同ROI勾画方法获得的肝细胞癌ADC值的Bland-Altman图。蓝色实线代表ADC值差值平均值,最上和最下的两条虚线代表95%置信区间的上下限,SRAs法测量的ADC值的标准偏差最大(260.7×10-3mm2/s),WTV法测量的ADC值的标准偏差最低(107.1×10-3mm2/s)。a)小圆形RIO法;b)单层最大面积法;c)整体容积法。
本研究结果显示,采用3种ROI设置方法测量的肝细胞癌的总体ADC值存在较大差异,小圆形ROI法测量的ADC值低于单层最大面积法和整体容积法,单层最大面积法和整体容积法测得的ADC值范围具有更大的重叠区间(图3),本研究结果与Priola等[13]的研究结果基本一致。小圆形ROI法选取的是肿瘤的实性部分,其内肿瘤细胞增生活跃,具有较高细胞密度、核浆比例和较厚的细胞板,细胞内间隙和细胞外间隙变窄,这些改变限制例水分子的运动,导致水分子扩散明显受限,ADC值降低[14]。然而,整体容积法和单层最大面积法则更能反映肿瘤内部的异质性,ROI内包含肿瘤的实性部分、供血血管、腺管结构、囊变、坏死及出血等,故测得的ADC值高于小圆形ROI法。由于肿瘤内部的非均质性,采用小圆形ROI法测量ADC值时,不同观察者间ROI放置的位置不同,测量值即存在差异,另外部分病灶在DWI图像上边界模糊不清,导致采用整体容积法和单层最大面积法时难以准确勾画ROI[15]。小圆形ROI法操作简单、方便,整体容积法和单层最大面积法手动勾画ROI通常需要结合常规T1WI、T2WI及增强图像来确定肿瘤范围,操作相对繁琐、时间较长。因此,小圆形ROI法在临床上应用更加广泛。
ROI的数目和范围会严重影响肝细胞癌ADC测量值和观察者间的一致性,整体容积法和单层最大面积法的可重复性明显高于小圆形ROI法。本研究结果显示,三种ROI设置方法获得的ADC值在不同观察者间均具有较好的一致性,其中以整体容积法的观察者间一致性最好(ICC=0.940),小圆形ROI法一致性最差(ICC=0.759)。本研究结果与文献报道基本一致[16-17]。两位观察者采用单层最大面积法测得的ADC值比较,差异有统计学意义,笔者认为系不同观察者间选取不同最大层面所致。整体容积法和单层最大面积法反映整个肿瘤组织或单个层面肿瘤组织的ADC值,观察者间的变异度较小。采用小圆形ROI法是,由于不同观察者在ADC图上选取病灶所在层面及ROI位置和面积时存在差异,观察者间变异度大,因此ADC测量值的可重复性较差。然而,一种测量方法具有良好重复性并不代表更好的诊断效能,Liu等[17]报道在胰腺癌与正常胰腺组织的鉴别方面,小圆形ROI法较单层最大面积法和整体容积法的诊断价值更高。Roth等[18]研究发现,在评估肿瘤疗效时整体容积法要优于小圆形ROI法。本研究结果显示,小圆形ROI法测得的ADC值与肝癌的病理分级之间无显著相关性;单层最大面积法和整体容积法测得的ADC值与肝癌的病理分级呈正相关,肝细胞癌分化程度越低,ADC值越低。此研究结果与文献报道基本一致[19]。采用整体容积法测量的高分化与低分化HCC的ADC值差异具有统计学意义,原因是低分化肝细胞癌病灶内囊变、坏死和出血较高分化HCC更常见。因此,笔者认为采用整体容积法测量的ADC值有利于高分化与低分化肝细胞癌的鉴别。
本研究的局限性:①样本量较小,需要扩大样本量进一步深入研究;②腹部DWI容易受到患者呼吸伪影的影响,部分病灶边界模糊,影响ROI的勾画;③观察者手动勾画ROI缺少统一的操作标准,整体容积法需对病灶所在的每一层面进行ROI的手动勾画,耗费时间较长,缺少图片自动处理软件,限制了其临床应用。
总之,ROI测量方法影响肝细胞癌ADC值测量结果,整体容积法和单层最大面积法测量的ADC值高于小圆形ROI法,整体容积法测量的ADC值对高分化肝细胞癌与低分化肝细胞癌的鉴别诊断有一定价值。

