Dy3+离子掺杂TiO2微纳米晶的制备及其光催化性能研究
王书媚 田修营* 谢刘平
(湖南人文科技学院,材料与环境工程学院,精细陶瓷与粉体材料湖南省重点实验室 417000)
前言
二氧化钛(TiO2)是一种白色的宽禁带新型半导体材料,其主要晶型有板钛矿、金红石相和锐钛矿相[1]。TiO2微纳米晶,因其较大的比表面积,较强的吸附性能、较突出的活性,在太阳能转化、光催化材料、环境保护、发光材料等诸多领域有着广阔的应用前景[2]。TiO2的三种晶型中,只有锐钛矿型才具有较好的光催化活性[3]。但是由于TiO2是宽禁带半导体材料,对太阳光利用率比较低和光生电子-空穴对极易复合,使其光量子效率降低。这严重制约TiO2光催化剂的应用,因此降低光生电子-空穴对的复合率,提高光催化活性成为TiO2光催化剂的研究重点。
目前,TiO2的光催化活性一般通过以下几种方法来提高[4]。比如:离子掺杂[4~7]、氧化物复合[8]和贵金属沉积[9]等。众多方法中,离子掺杂方法被认为是一种比较有效的途径。对于离子掺杂方法来说,尤其是采用稀土金属离子掺杂来提高其光催化性已经相当普遍。稀土金属离子由于4f轨道没有填满,具有丰富的电子组态,4f电子可以在其间跃迁,从而产生从红外至紫外光区的吸收和发射[4]等。此外,将稀土离子掺杂TiO2,可以引入杂质能级,可以抑制光生电子-空穴对的复合,提高TiO2的光催化性能。本文采用微波辅助溶胶-凝胶法来制备Dy3+掺杂TiO2微纳米晶,并通过XRD、FTIR和UV-vis对样品的物相成分、分子键价结构和光催化性能来进行表征和分析。
1 实验部分
1.1 Dy3+掺杂TiO2微纳米晶的制备
在烧杯中加入20ml钛酸丁酯,60ml无水乙醇,4ml冰醋酸,配成A溶液,放入集热式恒温加热磁力搅拌器中;将40ml无水乙醇,40ml去离子水,配成B 溶液;然后将一定量氧化镝(Dy2O3与TiO2的质量比为 0wt.%、0.5wt.%、0.8wt.%、1.0wt.%、1.2 wt.%和1.5wt.%),加入一定量的硝酸溶解,再将其滴加到B溶液;然后再将B溶液装入分液漏斗中缓慢加入到A溶液中,用硝酸调pH到3,将其放到MCR-3微波化学反应器内,功率240W,匀速搅拌,获得sol溶液。室温陈化12h,形成gel。将凝胶放在真空干燥箱,80℃烘干得到黄色样品,研磨成粉末。将其置于箱式电阻炉中在620℃下焙烧,得到白色TiO2微纳米晶。
1.2 样品表征与光催化性能测试
采用丹东通达TD3500型X射线衍射仪对样品进行物相分析,20~80°;采用尼高力is50型傅里叶变换红外光谱仪对样品进行原子键价表征,波数范围为 4000~525cm-1;以亚甲级蓝(MB)作为目标降解物,取0.1g所制备典型样品加入到35mL 10mg/L的MB溶液中,在磁力搅拌下将混合液置于比朗光化学反应器进行暗反应30min,当达到吸附-脱附平衡后,取2ml溶液,在离心机中以8000r/min离心5min,取上层清液用日本岛津UV-2501型紫外-可见分光光度计测定其吸收光谱,然后打开300WXe光源,使混合液在光照条件下进行反应,每隔10min取一次样,离心后测定其吸收光谱。
2 结果与讨论
2.1 XRD分析

图1 不同Dy3+浓度掺杂TiO2微纳米晶的XRD图谱
图1 为不同Dy3+浓度掺杂TiO2微纳米晶的XRD图谱。Dy2O3与TiO2质量掺杂比(Dy3+掺杂量)从下向上依次分别为 0wt.%、0.5wt.%、1.0wt.%、1.2wt.%和1.5wt.%。由图1可知,该图谱与锐钛矿标准卡片(21-1272)和标准卡片金红石(21-1276)一致。样品的主晶相为锐钛矿相,如(101)、(004)和(200)晶面等,而次晶相为金红石相,如(110)和(101),如图1的衍射峰(*)等;其中锐钛矿相的(101)和金红石相的(110)晶面的衍射峰强度较强,作为两相的代表性晶面来分析。此外,从图1中还可以看出,由于Dy3+掺杂量不同,样品中锐钛矿和金红石相的比例也不相同。当掺杂量为1.2wt.%时,样品完全为锐钛矿。当掺杂量为1.5wt%时,又存在微量的金红石相。可见,Dy3+掺杂量对TiO2微纳米晶的相变有一定的影响,且在锐钛矿到金红石的晶型转变过程有抑制的作用,当Dy3+掺杂量为1.2wt.%时,样品几乎保持单一锐钛矿物相。当Dy3+掺杂量为1.2wt.%时,样品的晶粒大小可以根据 Scherrer公式(1)[10]估算:

K是 Scherrer常数,一般为0.89;β为衍射峰的半高宽,θ为衍射角,λ为X射线波长,这里取0.154056nm,通过jade软件可以估算晶体的平均尺寸。当Dy3+掺杂量为1.2wt.%时,样品的晶粒大小为11.5nm。
2.2 FTIR红外分析
图2是Dy3+掺杂量1.2wt.%和未掺杂的TiO2在500~400cm-1波数范围内的FTIR图谱。由图2可知,两个样品在1000cm-1以下区域的吸收峰形状和位置基本上没有变化,一般归因于Ti-O振动[11]。另外,当Dy3+掺杂量1.2wt.%时,样品在3000~3500cm-1和在1600cm-1左右时,明显存在两个吸收峰,分别为O—H伸缩振动引起的非对称吸收峰和弯曲振动峰。对于未掺杂的样品而言,这个区域几乎没发现吸收峰,这说明与未掺杂样品相比,掺杂后样品表面存在羟基,它可以捕捉空穴,形成羟基自由基(gOH),有利于光催化降解有机物[12],如方程(2)所示。

图2 Dy3+掺杂量为1.2wt.% 和未掺杂的TiO2微纳米晶的红外吸收光谱图

图3 a 光照不同时间的典型样品催化MB的紫外可见吸收光谱;图3b不同光照时间下C/C0的变化曲线;图3c-ln(C/C0)对不同光照时间的变化图;图3d不同光照时间下的降解率

2.3 光催化降解MB
为了研究Dy3+掺杂TiO2样品的光催化活性,我们采用MB为目标降解物,光源为300WXe灯。典型样品为Dy3+掺杂量为1.2wt.%的TiO2微纳米晶。MB浓度为10mg/l。开灯前,暗反应30min;开灯后,光照每隔10min取样,进行紫外可见吸收光谱测试,检测波长为664nm。图3a为光照不同时间的典型样品催化MB的紫外可见吸收光谱。可以看出,随着光照时间的增加,MB溶液的吸光度不断下降,经过50min后,MB基本降解完全。图3b为不同光照时间下MB的浓度C对MB初始浓度C0比值(C/C0)的变化曲线。从图3b可以看出,经过50min后,MB基本降解完全。
图3c是-ln(C/C0)对不同光照时间的变化图。根据图3c的实验数据,通过线性拟合可以获得方程(3)[13]:

这里,k是光催化反应速率,t是不同光照时间。通过线性拟合可以得到k=0.07461min-1。此数值较高,这说明该样品对MB具有较高的光催化性能。此外,如图3d所示,还可以通过降解率(D%)来说明典型样品的光催化能力,如公式(4)[10]所示:
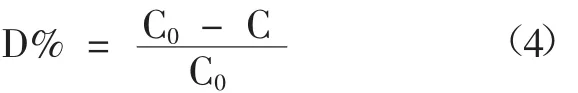
通过公式(4)计算,当光照时间为10min、20min、30min、40min和50min时,典型样品对MB光催化降解率分别为 44.12%、79.12%、92.53%、95.11%和97.14%。综上可知,经过光照50min后,典型样品对MB光催化降解率高达97.14%。这可能与一定量Dy3+的引入有关。Dy3+可以捕捉电子,如方程(5)和(6)。而空穴则能和样品表面的羟基反应,如公式(2),生成,能有效抑制光生电子和空穴对的复合,延长了空穴的寿命从而使典型样品具有较高的光催化活性。

3 结论
本文通过微波辅助溶胶-凝胶法制备Dy3+掺杂TiO2微纳米晶。由XRD图谱可知,Dy3+掺杂量对TiO2微纳米晶的相变有一定的影响,且在锐钛矿到金红石的晶型转变过程中有抑制的作用,当Dy3+掺杂量为1.2wt.%时,样品几乎保持单一锐钛矿物相。当Dy3+掺杂量为1.2wt.%时,晶粒大小为11.5nm。通过FTIR可知,样品表面存在羟基,它可以捕捉空穴,形成羟基自由基,有利于光催化降解有机物。在Xe灯下光照50min后,典型样品对MB的光催化反应速率为k=0.07461min-1和降解率为97.14%,这可能与一定量Dy3+的引入有关。Dy3+可以捕捉电子,生成g O2-。而空穴则能和样品表面的羟基反应生成g O H,能有效抑制光生电子和空穴对的复合,延长了空穴的寿命,从而使典型样品具有较高的光催化活性。
——以金红石为例

