四氢蒽醌类化合物结构及其生物活性研究进展
冯世秀,许 静,陈 涛
深圳市中科院仙湖植物园 深圳市南亚热带植物多样性重点实验室,深圳 518004
蒽醌类化合物是一类广泛存在于自然界中的重要次生代谢产物,是各种天然醌类化合物中数量最多的一类化合物,主要分布在茜草科、廖科、玄参科和百合科等植物中,具有止血、抗菌、抗病毒、抗肿瘤、抗衰老、抗诱变、保肝利胆、明目、促睡眠、降血脂、增加免疫功能等多种药理作用。蒽醌类化合物均有芳香平面大共轭结构,具有很好的脂溶性和较差的水溶性[1]。四氢蒽醌是蒽醌类化合物的衍生物,是指蒽醌中A环上的双键发生四氢加成之后形成的萘醌骈环己烯结构(见图1),其结果大大增加了蒽醌类化合物的手性结构,使其生物活性也相应增加,水溶性也得到改善提高。
据文献报道,大多数的四氢蒽醌都是从植物内生菌中分离得到。植物内生菌是指生活史中一定阶段生活在活体植物细胞或组织间隙内而不引起植物病害的微生物。植物体内存在内生菌是一种普遍现象,内生菌定植于植物组织内部,能够适应这特殊的生态位,对植物产生有益的效应。一方面植物体为内生菌提供其生长必需的能量和营养;另一方面,内生菌又可通过自身的代谢产物或借助于信号传导作用对植物体产生影响[2]。

图1 四氢蒽醌化合物结构Fig.1 The structure of Tetrahydroanthraquinone
四氢蒽醌类化合物是一类重要的微生物次生代谢产物,在自然界中的含量比较低,但其结构特殊,具有强烈的细胞毒活性、抗菌活性、抗疟原虫活性等。本文将主要从四氢蒽醌类化合物及其衍生物的天然来源、化学结构和生物活性几方面来进行综述,为该类物质的后续研究提供依据。
1 从微生物中分离得到的四氢蒽醌类化合物
四氢蒽醌类化合物大多都是从植物内生菌及真菌中分离得到的,蒽醌和氢化蒽醌衍生物是真菌链格孢属、镰刀菌属中常见的次生代谢产物。目前从植物内生菌及真菌中发现的四氢蒽醌类化合物主要有四氢蒽醌类化合物、四氢氧化蒽酚类化合物、四氢1,2-蒽醌类化合物、二聚四氢蒽醌类化合物等。
1.1 四氢蒽醌类化合物
四氢蒽醌类化合物是蒽醌类化合物A环上的不饱和双键被四个氢氢化的一类化合物。目前从各种植物内生菌及其他菌种中分离得到17个四氢蒽醌类化合物,化合物名称和结构见表1和图2。其中altersolanol A(1)是一个重要的altersolanol型四氢蒽醌类化合物,具有强烈的抗肿瘤活性,它被Liu 等[3]、Huang等[4]、Debbab等[5]、Yagi等[6]、Wheeler等[7]和Chen等[8]多人从不同的内生菌中都分离得到该化合物。Altersolanol A(1)和altersolanol B(2)最早由Stoessl等[9]在1969年从Alternariasolani中分离的到,也由此发现了四氢蒽醌这种类型的天然结构。后来在1978年,Becker等[10]人再次从真菌Dactylarialutea中分离出化合物1和2,同时还分离出altersolanol C(3)(当时命名为dactylariol,后更名为altersolanol C)。自此之后,这些化合物被从不同的植物内生菌或其他菌种中分离得到,同时越来越多的四氢蒽醌化合物被分离得到。Yagi等[6]在1993年从患病的番茄(Lycopersiconesculentum)中分离的菌种Alternariasolani中分离得到同类化合物altersolanol D(4)、altersolanol E(5)和altersolanol F(6);Chen等[8]从菌株Alternariasp.XZSBG-1中分离得到化合物altersolanol O(8);Ondeyka等[11]人从一种Hypocreales菌中分离得到化合物altersolanol P(7);Zhou等[12]从菌株Stemphyliumsp.33231中分离得到auxarthrol C(9)和2-O-aectylaltersolanol B(13);Uzor等[13]从菌株Nigrosporaoryzae中分离得到化合物4-dehydroxyaltersolanol A(12);Liu 等[3]从内生菌Stemphyliumglobuliferum中分离得到二羟基四氢蒽醌类化合物dihydroaltersolanol B(10)和dihydroaltersolanol C(11);Khamthong等[14]从菌株TrichodermaaureoviridePSU-F95中分离得到化合物trichodermaquinone(14)和coniothranthraquinone 1(15);Klaiklay等[15]从菌株Phomopsissp.PSU-MA214中分离得到化合物phomopsanthraquinone(16);Xie等[25]从海洋植物内生菌fungus No.1403中分离得到化合物SZ-685C(17)。
1.2 四氢氧化蒽酚类化合物
四氢氧化蒽酚类化合物是四氢蒽醌类化合物9位或10位上的羰基被氢化成羟基的一类化合物。目前从各种植物内生菌及其他真菌中分离得到8个氧化蒽酚类化合物,化合物名称和结构分别见表2和图3。Höller等[16]在2002年首次从一株未被鉴定的真菌NRRL 29097中分离得到altersolanol J(18),并通过测定核磁数据的方法鉴定出其结构。Aly等[17]在2008年对化合物18及从Urospermumpicroides内生菌Ampelomycessp.中分离得到的化合物ampelanol(23)的细胞毒活性测试中发现化合物18和23都只表现为对小鼠淋巴瘤细胞L5178Y中等的细胞毒活性,比四氢蒽醌类化合物的活性弱,这与Debbab等[5]在对从唇萼薄荷(Menthapulegium)内生菌Stemphyliumglobuliferum中分离得到的化合物18、altersolanol K(19)、altersolanol L(20)的活性测定结果一致,都只表现为中等的细胞毒活性,说明对苯醌的骨架结构对于四氢蒽醌类化合物的细胞毒活性具有重要的作用。从内生菌及真菌中分离得到的四氢氧化蒽酚类化合物还有Klaiklay等[15]从Phomopsissp.PSU-MA214中分离得到的tetrahydroaltersolanol B(21)和tetrahydroaltersolanol C(22)、Zhou等[12]从Stemphyliumsp.33231中分离得到的2-O-aectylaltersolanol L(25)、Huang等[4]从Xylariasp. 2508中分离得到的Xylanthraquinone(24)。
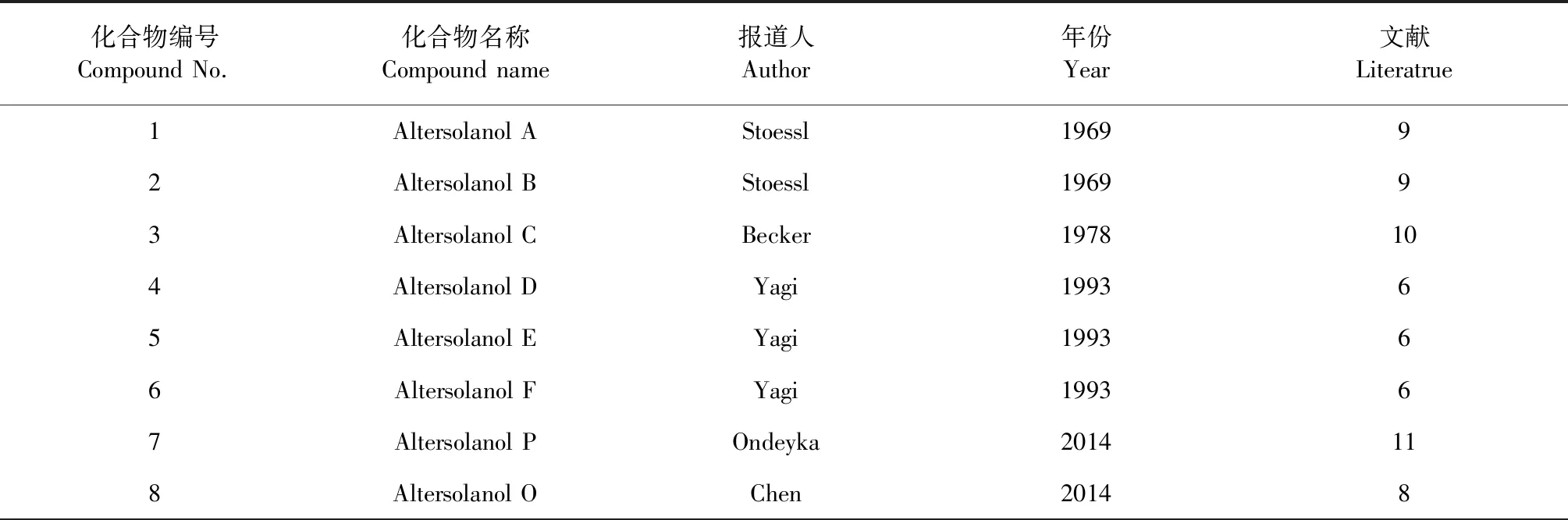
表1 四氢蒽醌类化合物的名称
续表1 (Continued Tab.1)

化合物编号Compound No.化合物名称Compound name报道人Author年份Year文献Literatrue9Auxarthrol CZhou20141210Dihydroaltersolanol BLiu2015311Dihydroaltersolanol CLiu20153124-Dehydroxyaltersolanol AUzor201513132-O-Aectylaltersolanol BZhou20141214TrichodermaquinoneKhamthong20121415Coniothranthraquinone 1Khamthong20121416PhomopsanthraquinoneKlaiklay20121517SZ-685CXie201025

图2 四氢蒽醌类化合物的结构Fig.2 The structure of tetrahydroanthraquinone compounds
1.3 四氢1,4-蒽醌类化合物
天然蒽醌类化合物有1,2-蒽醌、1,4-蒽醌和9,10-蒽醌类化合物,由于9,10位氧化产物较为稳定,所以9,10-蒽醌类化合物较为常见,相应的也以四氢9,10-蒽醌类化合物较为常见。尽管如此,在之前的分离工作中还是分到了5个四氢1,4-蒽醌类化合物,分别为(1S,3R)-austrocortirubin(26)、(1S,3S)-austrocortirubin(27)、1-deoxyaustrocortirubin(28)、deoxybostrycin(29)和bostrycin(30),结构和名称见表3和图4。化合物26是最早由Elsworth等[18]在1999年从真菌Dermocybesplendida中分离得到的红色四氢1,4-蒽醌类化合物,Choomuenwai等[19]测定了它对疟原虫Plasmodiumfalciparumline (3D7)的活性,结果显示化合物26和从Cortinariussp.中同时分离出来的化合物27、28都表现出显著的抗虫作用。Huang等[4]于2014年从Xylariasp.2508分离出了化合物29和30,在对结核分枝杆菌蛋白磷酸酶B的抑制活性测试中发现化合物29和30的IC50值都大于100 μmoL/L,没有表现出对结核分枝杆菌蛋白磷酸酶B有效的抑制活性。

表2 四氢氧化蒽酚类化合物的名称

图3 四氢氧化蒽酚类化合物的结构Fig.3 The structure of hydroxyphenanthrene compounds
1.4 二聚四氢蒽醌类化合物
二聚四氢蒽醌类化合物是指两个四氢蒽醌类化合物的二聚体或一个四氢蒽醌类化合物和一个蒽醌类化合物形成的二聚体。目前从各种植物内生菌及其他真菌中共分离得到15个二聚四氢蒽醌类化合物,它们分别是alterporriol A、B、D、E、G、H、F、N、S、T、U、V、W(31-43)和aectylalterporriol D、E(44-45),结构和名称分别见表4和图5。其中化合物31和32、33和34、35和36是构象异构体。它们每对的核磁数据都非常的相似,其中,化合物33和34在CD3OD和THF-d8中最大化学位移的差值只有0.04 ppm[20]。关于化合物33和34的立体结构,Kanamaru等[20]通过分析它们的光谱数据1H NMR、13C NMR、NOESY、CD谱等确定化合物33为aS,34为aR。化合物33和34的1H NMR谱几乎可以重叠,C-1的羟基信号还是表现出不同,且CD谱表现出相反的关系,说明化合物33和34是一对立体异构体。通过对化合物33和34的苯甲酰衍生物进行分析,发现苯甲酰化影响了化合物33和34中环己烯C1-C4的构象变化,然后通过对其构象的分析,以及对化合物33CD谱的计算等确定化合物33为aS,而化合物34为aR[20]。而化合物31和32的立体结构是Zhou等[12]根据核磁数据和CD谱对照已经确定的化合物34的立体结构确定为aS和aR,而化合物35和36的立体结构Debbab等[5]从唇萼薄荷(Menthapulegium)内生菌Stemphyliumglobuliferum中分离出来时并未进行探讨。其他化合物分别是由Zhou等[12]从Stemphyliumsp.33231中分离得到的化合物40、41、43,其中化合物41对B.cereus的最小抑制浓度为8.3 μM;由Chen等[8]从菌株Alternariasp.XZSBG-1中分离得到化合物38、39、42;由Kanamaru等[20]从真菌Pleosporaherbarum中分离得到的化合物37;Liu 等[3]从内生菌Stemphyliumglobuliferum中分离得到的化合物44和45,其中化合物45对小鼠淋巴瘤细胞 L5178Y的IC50值为10.4 μM,而化合物44对小鼠淋巴瘤细胞 L5178Y没有细胞毒活性。

图4 四氢1,4-蒽醌类化合物的结构Fig.4 The structure of tetrahydro-1,4-anthraquinone compounds
2 从植物中分离得到的四氢蒽醌类化合物
目前从植物中分离得到的四氢蒽醌类化合物有9个,分别是Feng等[21]在2011年从南山花Prismatomerisconnata中分离的2个化合物prisconnatanones A(46)和prisconnatanones B(47)以及Wang等[22]在2015年继续从该植物中分离得到7个化合物prisconnatanones C-I(48-54),它们的结构和名称分别见表5和图6。从微生物分离出的四氢蒽醌类化合物C环上多具有5-OH和7-OCH3的结构,变化较多的是A环的取代基;而从植物南山花中分离中出的四氢蒽醌类化合物以A环2-OH和3-CH3为基本结构,手性为2R,3R,B环则多有酚羟基和甲氧基取代,形成了多种衍生物。
3 四氢蒽醌类的生物活性
随着人们对四氢蒽醌类化合物的研究,越来越多的四氢蒽醌类化合物被分离出来,对它的活性的研究也取得了一些进展,四氢蒽醌类化合物主要有细胞毒活性、抗菌活性、抗疟原虫活性等。其中以altersolanol A(1)活性的研究最为深入。

表3 四氢1,4-蒽醌类化合物的名称

表4 二聚四氢蒽醌类化合物的名称

表5 Prisconnatanones类化合物的名称

图5 二聚四氢蒽醌类化合物的结构Fig.5 The structure of polytetrahydroanthraquinone compounds

图6 Prisconnatanones类化合物的结构Fig.6 The structure of prisconnatanones compounds
3.1 细胞毒活性
3.1.1 Altersolanol A的细胞毒活性
Altersolanol A(1)是一种激酶抑制剂,它可以通过裂解Caspase-3和Caspase-9来诱导肿瘤细胞凋亡,并且可以减少抗细胞凋亡蛋白的表达[23,24]。Mishra等[23]研究了1对包括膀胱癌、中枢神经系统癌、结肠癌、胃癌、肺癌、黑色素瘤、乳腺癌、卵巢癌、胰腺癌、 前列腺癌、胶质母细胞瘤、肾癌和子宫癌细胞在内的34种人类肿瘤细胞的生物活性,结果它对这些肿瘤细胞都表现出细胞毒活性,其IC50值在0.001 μg/mL (0.003 μM)到0.412 μg/mL (1.23 μM)之间,其平均的IC50为0.005 μg/mL(0.015 μM),其中有17种癌细胞的IC50值小于等于0.001 μg/mL。特别敏感的细胞系是膀胱癌、结肠癌、肺癌、乳腺癌、卵巢癌、前列腺癌、黑色素瘤和胶质母细胞瘤。因此化合物1是一个有很大吸引力的抗癌先导化合物[23]。
Teiten等[24]研究报道化合物1对人类慢性白血病细胞K562和非小细胞肺癌细胞A549的IC50值分别为4.2和29.5 μM,细胞周期分析显示用化合物1处理的K562细胞阻滞在G1阶段,在4 μM处理48小时后K562细胞在G1阶段累积达到65%,进一步分析发现化合物1能够诱导caspase-3 和caspase-9蛋白的裂解,并可明显减少抗凋亡蛋白Mcl-1,XIAP和Bcl-xL的表达。Altersolanol A还能够抑制肿瘤坏死因子NF-κB的激活。同时发现化合物1可以影响A562细胞的增殖和转移,化合物1影响细胞的增殖和入侵可能与激活的肿瘤坏死因子NF-κB信号通路被抑制有关,NF-κB信号通路可通过引起上皮细胞间质转型程序来增强肿瘤细胞的转移与繁殖。NF-κB在肿瘤细胞的迁移、扩散、入侵、转移的基质金属蛋白酶(MMPs)的调控中扮演着重要的角色。因此,化合物1是一个潜在的抗肿瘤化合物,它可通过抑制NF-κB的转移活性来影响凋亡蛋白和抗凋亡蛋白的表达[24]。
3.1.2 细胞毒活性与化合物结构的关系
Debbab等[5]测试了多个四氢蒽醌类化合物在10 μg/mL的浓度下对小鼠淋巴癌细胞L5178Y生长的影响,结果显示化合物1、18、19、20处理的生长率分别为1.5%、20.1%、41.4%和51.4%,其中化合物18、19、20为四氢氧化蒽酚类化合物,说明四氢蒽醌类化合物的细胞毒活性明显强于四氢氧化蒽酚类化合物,即说明9,10-对苯醌结构对于四氢蒽醌类化合物的细胞毒活性具有重要的作用。Liu 等[3]用MTT法测试了多个四氢蒽醌类化合物对小鼠淋巴癌细胞L5178Y的活性,结果显示化合物1~3对L5178Y细胞都表现出有效的细胞毒活性,并且相互之间差别不大,其IC50值分别为2.53、3.78、4.68 μM,说明A环上的羟基对altersolanol型化合物的细胞毒活性没有贡献[3]。化合物11的IC50值为3.4 μM,而与其结构在1位少一个OH的化合物10却没有活性,说明1-OH对13,14-dihydroaltersolanol型结构活性具有重要的作用[3]。
Feng等[21]测试了四氢蒽醌类化合物46和47对人非小细胞肺癌细胞A549和LAC的细胞毒活性,结果显示化合物46的IC50值分别为4.5和7.8 μM,而化合物47则没有细胞毒活性。Wang等[22]测试了化合物48~54对人非小细胞肺癌细胞H1229、HTB179、 A549和H520的活性,结果显示化合物48~50不表现细胞毒活性;化合物51~53显示出较弱的细胞毒活性,其IC50值都 ≥ 8 μM;化合物54显示出明显的细胞毒活性,其对H1229、HTB179、 A549、H520的IC50值分别为3.0、2.7、3.0和3.9 μM。结果表明,四氢蒽醌C环的5-OH和8-OH对于细胞毒活性起关键作用,而C环酚羟基数目越多,细胞毒活性越强,随着酚羟基数目的减少,细胞毒活性逐渐减弱。
具有aR手性结构的化合物45和34对小鼠淋巴瘤细胞 L5178Y的细胞毒活性的IC50值分别为10.4和6.9 μM,然而与它们为立体异构的aS型的化合物44和33却没有活性,说明四氢蒽醌二聚衍生物双芳基的手性对这些化合物的活性起着重要的作用。而化合物45的活性较化合物34的略好,说明6-乙酰基对四氢蒽醌二聚衍生物的活性没有显著贡献[3]。
3.1.3 其他化合物的细胞毒活性
此外,Uzor等[13]研究发现化合物12对小鼠淋巴癌细胞L5178Y的IC50为9.4 μM。Xie等[25]测试了化合物17对人乳腺癌细胞MCF-7和MDA-MB-435、前列腺腺癌细胞PC-3、神经胶质瘤细胞LN-444、肝癌细胞Hep-3B和Huh-7的活性,其IC50值分别为7.5、3.0、4.1、7.8、3.2和9.6 μM。Chen等[8]发现化合物3对人结肠癌细胞HCT-116和人宫颈癌细胞Hela的IC50值分别为3.03和8.09 μM。
3.2 抗菌活性
Yagi等[6]发现化合物1~3和5对铜绿假单胞菌PseudomonasaeruginosaIF0 3080、金黄色葡萄球菌StaphylococcusaureusIF0 I2732、藤黄微球菌IF0 3333的MIC值在12.5~25 μg/mL之间,而化合物4和6在100 μg/mL时都没有表现出抑菌活性,说明C苯环上5-OH的结构对于altersolanol型化合物的抗菌活性是必须的。Khamthong等[14]发现化合物15对金黄色葡萄球菌StaphylococcusaureusATCC 25923 (SA)和耐甲氧西林金黄色葡萄球菌StaphylococcusaureusSK1 (MRSA)都具有明显的抗菌活性,其MIC值分别为16和8 μg/mL,而化合物14对SA没有抗菌活性,对MRSA的MIC值为200 μg/mL,说明7-CH3和5-OH对四氢蒽醌类化合物的抗菌活性具有重要的作用。Liu 等[3]在对化合物10和11的抗菌活性测试中发现化合物11对金黄色葡萄球菌StaphylococcusaureusATCC 29213表现了一定的抗菌活性,其MIC值为49.7 μM,而化合物10却没有活性,说明1-OH在dihydroaltersolanol型化合物的抗菌活性方面起着一定的作用。
此外,Zhou等[12]发现化合物13对大肠杆菌、金黄色葡萄菌和枯草芽孢杆菌的MIC值都为3.9 μM。Ondeyka等[11]测试了化合物7对金黄色葡萄球菌、肺炎链球菌、枯草芽孢杆菌、粪肠球菌、流感嗜血杆菌、白色念珠菌和大肠杆菌的抑菌活性,结果显示化合物7除了对大肠杆菌的活性较弱外(MIC值为32 μM),对其他菌株的MIC值都在1~8 μg/mL之间。
3.3 抗虫活性
Choomuenwai等[19]测定了化合物26、27和28对疟原虫Plasmodiumfalciparumline (3D7)的活性,结果显示三个化合物都表现出很好的活性,对3D7的IC50值分别为4.7、1.9和4.5 μM;对抗氯喹的疟原虫Plasmodiumfalciparumline(Dd2)的IC50值分别为11.1、2.2和5.2 μM。
4 结语
四氢蒽醌类化合物是蒽醌类化合物中一类重要的微生物代谢产物,在少数植物中也有分布,具有抗肿瘤、抗菌和抗虫等重要的生物活性。本文共综述了54个四氢蒽醌类化合物,其中45个来源于微生物,9个来源于植物南山花根中。其中从南山花根中分离到的9个四氢蒽醌类成分均属于微量成分,因此也有可能是南山花根中内生菌的代谢产物,具体是南山花根的成分还是南山花根中内生菌的代谢产物有待进一步的研究。
四氢蒽醌类化合物是蒽醌类化合物中A环上的双键发生四氢加成之后形成的萘醌骈环己烯结构,从而改变了原有蒽醌类化合物的平面结构,增加了化合物的手性结构,使得化合物与蛋白的靶向结合能力增强,进而提高了四氢蒽醌类化合物的生物活性,尤其是细胞毒活性。在四氢蒽醌类化合物的细胞毒活性研究中发现,四氢蒽醌类化合物的活性明显强于四氢氧化蒽酚类化合物,即说明9,10-对苯醌结构对于四氢蒽醌类化合物的细胞毒活性具有重要的作用。而A环上的羟基对altersolanol型化合物的细胞毒活性没有贡献,因此A环上的羟基可以进行衍生化,为四氢蒽醌类化合物的结构修饰提供了方便;但是当13,14位的双键被氢化后,1-OH羟基就对其细胞毒活性起着关键的作用。研究还发现四氢蒽醌C环的5-OH和8-OH对于细胞毒活性起关键作用,随着C环酚羟基数目的减少,细胞毒活性逐渐减弱。因此可在C环上进行一些结构修饰,以提高四氢蒽醌类化合物的细胞毒活性。四氢蒽醌二聚衍生物有aR和aS型,而只有aR型表现出细胞毒活性,因此在研究这类药物时要将2种手性异构体分开。
四氢蒽醌类化合物是一类非常有潜力的抗肿瘤药物,其中化合物1对34种人类肿瘤细胞的IC50值在0.001 μg/mL到0.412 μg/mL之间,其平均的IC50为0.005 μg/mL[23],具有非常好的细胞毒活性。化合物1早在1969年就由Stoessl等[9]发现,但是到目前为止还未成为临床药物,而且对其活性的研究也不够深入,尤其是作用机制研究方面,文献报道较少。推测可能是因化合物1对正常细胞也有毒杀作用,更有可能是因为四氢蒽醌类化合物的获得量少,合成难度较大,从而没有引起人们的重视。
四氢蒽醌类化合物是一类有很大吸引力的抗癌先导化合物,Choomuenwai等[19]在2012年的时候就以化合物27为先导化合物在C环进行结构修饰,得到有11个化合物,但其细胞毒活性并未得到显著提高。目前对四氢蒽醌类化合物结构修饰的研究还远远不够,根据之前测得的数据可以优先考虑在1,4,5和8-OH处进行结构修饰,对四氢蒽醌类化合物结构修饰是未来四氢蒽醌类化合物的一个重要的研究方向。通过结构修饰与改造,提高四氢蒽醌类化合物的抗肿瘤活性,改善水溶性,增强成药性,有望筛选出高效的抗肿瘤药物,将具有良好的市场前景和开发价值。
四氢蒽醌类化合物是一类比较少见的天然结构,以微生物次生代谢产物居多,少量来源于植物,具有细胞毒活性、抗菌活性和抗疟原虫等生物活性。本文主要从四氢蒽醌类化合物及其衍生物的结构和生物活性两方面来对天然四氢蒽醌化合物进行综述,其中altersolanol A是一个有很大吸引力的抗癌先导化合物。通过对四氢蒽醌类化合物的综述,为四氢蒽醌类化合物的进一步研究和开发提供依据。

