木香烃内酯抑制乙醇诱导的肝细胞损伤与脂肪变性
班笃敬,魏 炜,申 超,缪雪华,刘文生*
1南京中医药大学,南京210023;2南京中医药大学附属南京市中西医结合医院普外科,南京 210014
酒精性脂肪肝病(alcohol fatty liver disease,AFLD)是因长期大量摄入酒精导致的以肝细胞脂肪变性为主要表现的肝损害性疾病,若疾病持续进展,则会导致酒精性肝炎、酒精性肝纤维化和酒精性肝硬化,引起肝细胞坏死甚至肝功能衰竭[1]。近年来酒精性脂肪肝在我国的发病率有所升高,酒精已成为导致肝脏损伤的第二大因素。长期大量摄入酒精,可干扰脂肪氧化,同时促进脂肪生成,引发脂质代谢异常,脂肪在肝细胞内蓄积后引起肝细胞受损[2]。目前,酒精性脂肪肝的临床药物治疗研究鲜有突破。
木香烃内酯(costunolide)是一倍半萜内酯类化合物,是中药木香的主要化学成分和质控成分之一。近年来研究表明木香烃内酯具有广泛的药理活性,包括抗肿瘤、降血糖、抗菌、抗炎等作用[3]。新近研究还发现,木香烃内酯在动物模型中能够减轻脂多糖诱导的急性肝损伤,可以有潜力成为一个具有保肝作用的药物[4]。本研究建立乙醇体外诱导人LO2肝细胞损伤模型,考察木香烃内酯对肝细胞损伤及脂肪变性的保护作用与初步机制与可能靶标,为木香烃内酯用于酒精性脂肪肝的防治提供实验依据。
1 实验材料
1.1 主要药品与抗体
木香烃内酯(纯度99.08%)、AMPK抑制剂BML-275(纯度99.73%)购自美国MedChemExpress公司,溶解于DMSO备用。Western blot实验用一抗SREBP-1c、PPARα、p-AMPK、AMPK、GAPDH及二抗Goat Anti-Rabbit-IgG-HRP购自美国Cell Signaling Technology。
1.2 实验仪器
主要实验仪器如下:光学显微镜 (日本Olympus公司)、超低温冰箱(日本Sanyo公司)、CO2细胞培养箱(日本Sanyo公司)、超纯水仪(美国Millpore公司)、核酸蛋白分析仪(美国Beckman公司)、Real-time PCR仪(美国Bio-Rad公司)、多功能酶标仪(美国Bio-Tek公司)、电泳槽(美国Bio-Rad公司)、凝胶成像分析系统(美国Bio-Rad公司)。
2 实验方法
2.1 细胞培养
人LO2肝细胞购自中科院上海细胞库。在含10%胎牛血清(FBS)、100 U/mL青霉素和100 mg/mL链霉素的高糖DMEM培养基中,置于5%CO2、37 ℃培养箱中培养。
2.2 MTT实验检测细胞活力
LO2细胞接种于96孔板,每孔180 μL,1×104个细胞/孔,加入乙醇和/或木香烃内酯处理48 h。后加入5 mg/mL MTT溶液20 μL继续培养4 h。移除上清,每孔加入200 μL DMSO充分溶解结晶物。在多功能酶标仪490 nm处测量各孔OD值,同时设置调零孔(培养基、MTT)与对照孔(细胞、培养基、MTT),每组6个复孔。药物处理组的细胞活力标示为对照组的百分比。
2.3 细胞上清肝酶水平的测定
LO2细胞接种于6孔板,加入乙醇或木香烃内酯处理48 h。取每组细胞上清液,按照试剂盒(购自南京建成生物工程研究所)方法测定谷丙转氨酶(ALT)和谷草转氨酶(AST)的活性。每组6个复孔,药物处理组的ALT或AST水平表示为对照组的倍数。
2.4 油红O染色
LO2细胞接种于放有无菌盖玻片的 24 孔培养板,加入乙醇和/或木香烃内酯处理48 h。后以 PBS洗涤3遍,4%多聚甲醛固定30 min,0.5%油红O染液(购自碧云天生物技术公司)室温染色30 min,60%异丙醇漂洗30 s,蒸馏水洗30 s至背景透明,明胶甘油封片,显微镜下观察细胞内脂滴形成情况。
2.5 细胞内脂质含量测定
LO2细胞接种于6孔板,加入乙醇和/或木香烃内酯处理48 h。后弃上清,PBS 洗涤细胞3遍,加入胰酶消化,收集细胞悬液,超声细胞粉碎机裂解细胞2 min,离心取上清,按试剂盒(购自南京建成生物工程研究所)说明书方法检测上清中甘油三酯(TG)、总胆固醇(TC)的含量。每组6个复孔,药物处理组的TG或TC水平表示为对照组的倍数。
2.6 Real-time PCR检测
LO2细胞接种于6孔板,加入乙醇、木香烃内酯和/或BML-275处理48 h。细胞内RNA提取按照Trizol Reagent说明书进行,紫外分光光度计检测纯度和定量。cDNA的合成采用40 μL逆转录反应体系,其中M-MLV 200 U,oligo(dT)(15 primer)10 ng/mL,4×dNTP(10 mM)4 μL,5×RT buffer 8 μL,无RNase水补至40 μL。42 ℃反应15 min,95 ℃灭活M-MLV酶5 min。根据Genebank资料自行设计引物(表1),由上海生工生物工程有限公司合成。以GAPDH作为内参物,PCR扩增体系为20 μL,包含cDNA 2 μL,上下游引物(10 μM)各1 μL,SYBR Premix Ex Taq酶10 μL,用DEPC水补至20 μL。PCR反应参数:95 ℃预变性30 s;95 ℃、5 s;60 ℃、30 s,共扩增40个循环。测得目的基因扩增的动力学曲线与Ct值。目的基因mRNA的倍数改变通过与GAPDH相比较计算得出。
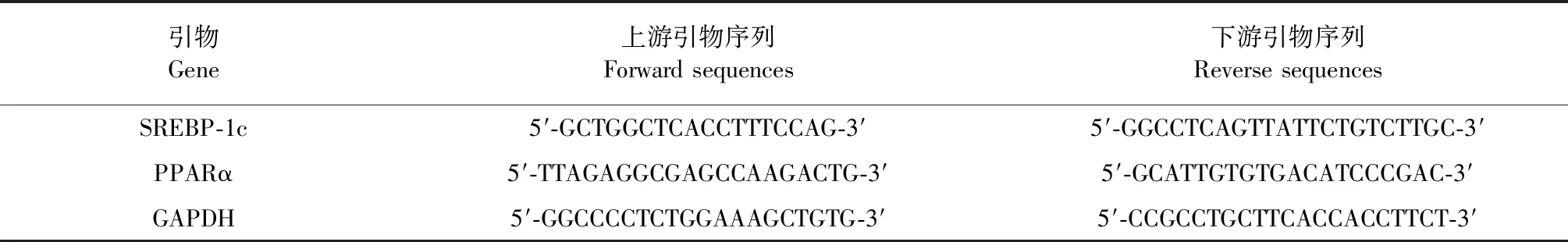
表1 引物序列
2.7 Western blot检测
LO2细胞接种于6孔板,加入乙醇、木香烃内酯和/或BML-275处理48 h。用冰冷的RIPA裂解液进行细胞裂解,收集裂解物,-80 ℃储藏过夜。蛋白混合液融化,于4 ℃、12 000 rpm下离心15 min,吸取上清以BCA法测定蛋白浓度。蛋白上样量为50 μg,进行SDS-PAGE电泳,PVDF转膜,非特异性封闭;加入相应一抗,4 ℃过夜,加入辣根过氧化物酶标记的二抗进行杂交。加入ECL发光液,以凝胶成像仪(Bio-Rad)进行成像与半定量分析。
2.8 统计学分析

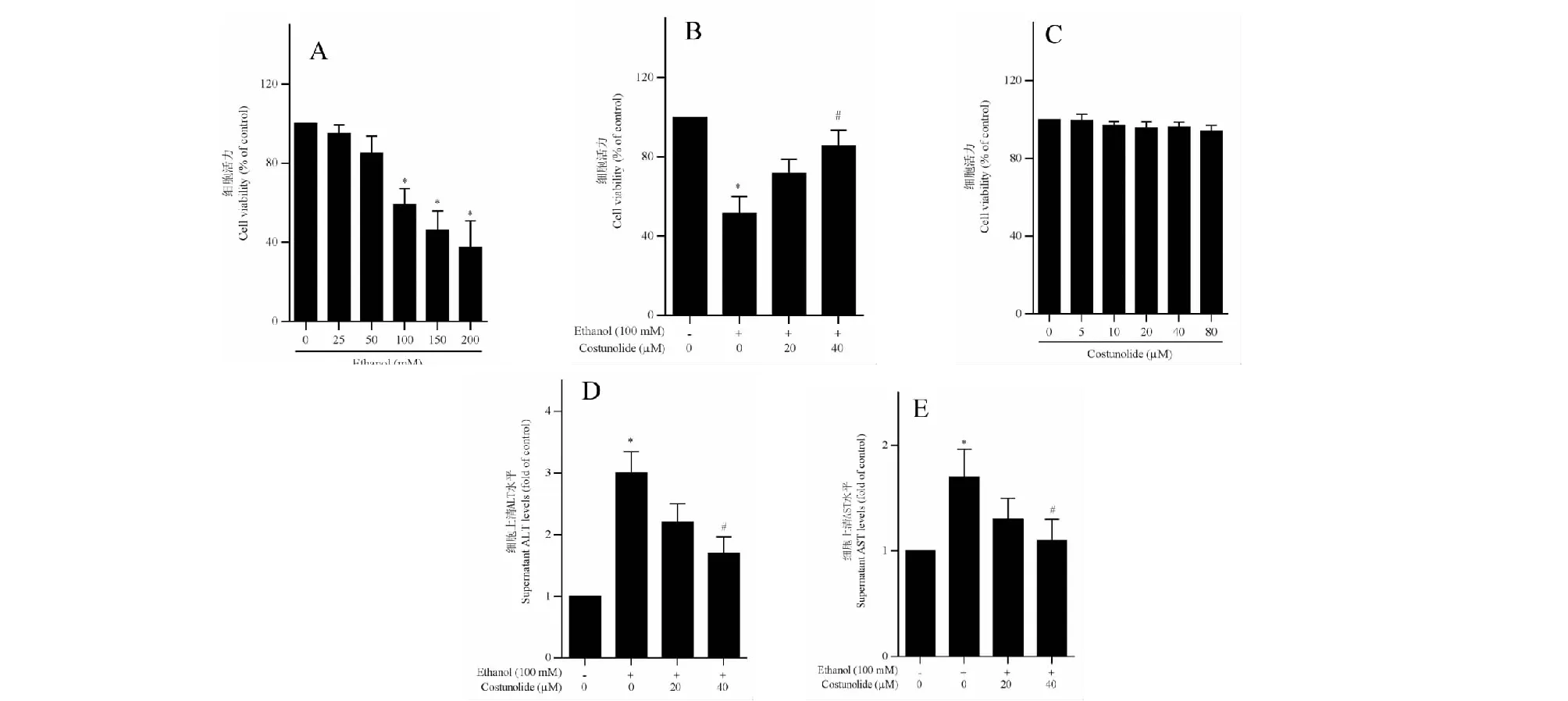
图1 木香烃内酯抑制乙醇诱导的肝细胞损伤Fig.1 Costunolide inhibits ethanol-induced hepatocyte injury注:(A)MTT实验检测乙醇对LO2细胞活力的影响,与对照组相比,*P<0.05;(B)MTT实验检测木香烃内酯对乙醇刺激的LO2细胞活力的影响,与对照组相比,*P<0.05,与乙醇组相比,#P<0.05;(C)MTT实验检测木香烃内酯在0-80 μM范围内对LO2细胞活力的影响;(D,E)试剂盒检测木香烃内酯对乙醇刺激的LO2细胞上清ALT和AST水平的影响,与对照组相比,*P<0.05,与乙醇组相比,#P<0.05。Note:(A) MTT assay for detecting the effects of ethanol on LO2 cell viability,*P<0.05;(B) MTT assay for detecting the effects of Costunolide on ethanol-induced LO2 cell injury,*P<0.05 vs control,#P<0.05 vs ethanol;(C) MTT assay for detecting the effects of Costunolide at 0-80 μM on LO2 cell viability,(D,E) Measurements of supernatant ALT and AST levels in ethanol-stimulated LO2 cells treated with costunolide,*P<0.05 vs control,#P<0.05 vs ethanol.
3 结果
3.1 木香烃内酯抑制乙醇导致的肝细胞损伤
首先建立乙醇诱导的肝细胞损伤模型。MTT检测结果显示,当乙醇浓度为100 mM或高于此浓度时显著抑制LO2细胞活力,呈剂量依赖性(图1A)。据此选择浓度为100 mM的乙醇作为后续实验中诱导肝细胞损伤的条件。以MTT实验考察木香烃内酯对乙醇诱导肝细胞损伤的影响,发现木香烃内酯在40 μM浓度时可显著改善乙醇对LO2细胞活力的抑制作用(图1B),但单独作用时,对LO2细胞活力没有显著影响(图1C)。进一步考察木香烃内酯对乙醇刺激的肝细胞上清液中ALT和AST水平的影响,结果发现与对照组相比,乙醇导致LO2细胞上清液中ALT和AST水平显著升高,而木香烃内酯在40 μM浓度时显著降低乙醇刺激的LO2细胞上清液中ALT与AST含量(图1D、1E)。上述结果表明,木香烃内酯可以抑制乙醇诱导的肝细胞损伤。
3.2 木香烃内酯抑制乙醇导致的肝细胞脂质生成
以油红O染色检测肝细胞中的脂滴堆积情况。结果显示,与对照组相比,100 mM浓度的乙醇作用48 h后可明显促进LO2细胞中的脂质生成;而木香烃内酯在20、40 μM浓度时可抑制乙醇诱导的脂质生成(图2A)。利用试剂盒检测LO2细胞中TG和TC的水平,结果显示与对照组对比,乙醇可显著升高LO2细胞中TG的水平,而木香烃内酯在40 μM浓度时显著降低乙醇刺激的LO2细胞中的TG含量(图2B)。类似地,乙醇也可显著升高LO2细胞中TC的水平,而木香烃内酯在20、40 μM浓度时显著降低乙醇刺激的LO2细胞中的TC的含量(图2C)。上述结果显示,木香烃内酯可以抑制乙醇诱导的肝细胞脂质生成。

图2 木香烃内酯抑制乙醇诱导的肝细胞脂质生成Fig.2 Costunolide inhibits ethanol-induced lipogenesis in hepatocytes注:(A)油红O染色检测木香烃内酯对乙醇刺激的LO2细胞中脂质堆积的影响(放大倍数:400X);(B)试剂盒检测木香烃内酯对乙醇刺激的LO2细胞中TG含量的影响,与对照组相比,*P<0.05;与乙醇组相比,#P<0.05;(C)试剂盒检测木香烃内酯对乙醇刺激的LO2细胞中TC含量的影响,与对照组相比,*P<0.05,与乙醇组相比,#P<0.05。Note:(A) Oil-red O staining for evaluating the effects of costunolide on ethanol-induced lipid accumulation in LO2 cells (400X magnification);(B) Measurement of intracellular TG levels in ethanol-stimulated LO2 cells treated with costunolide,*P<0.05 vs control,#P<0.05 vs ethanol;(C) Measurement of intracellular TC levels in ethanol-stimulated LO2 cells treated with costunolide,*P<0.05 vs control,#P<0.05 vs ethanol.
3.3 木香烃内酯调控肝细胞中脂质相关转录因子的表达
固醇调节元件结合蛋白-1c(SREBP-1c)和过氧化物酶体增殖物激活受体α(PPARα)是对肝细胞中脂质的合成具有重要调控作用的转录因子,其中SREBP-1c具有正向调控脂质生成的作用[5],而PPARα起到负向调节作用[6]。Real-time PCR检测结果显示,与对照组相比,乙醇可显著促进LO2细胞中SREBP-1c的mRNA表达,而抑制PPARα的mRNA表达;与乙醇模型组相比,木香烃内酯在20和40 μM浓度时显著降低SREBP-1c的mRNA表达并上调PPARα的mRNA表达(图3A)。以Western blot检测SREBP-1c和PPARα的蛋白表达。结果显示,与对照组相比,乙醇可显著促进LO2细胞中SREBP-1c的蛋白表达,而抑制PPARα的蛋白表达;与乙醇模型组相比,木香烃内酯在40 μM浓度时显著降低SREBP-1c的蛋白表达并上调PPARα的mRNA表达(图3B)。综合上述表明,木香烃内酯能够调控肝细胞中脂质相关转录因子的表达,与改善乙醇诱导的肝细胞脂肪变性相关。
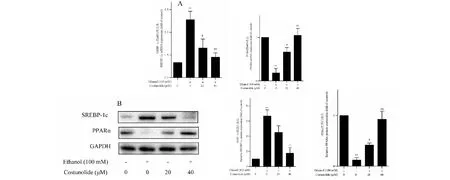
图3 木香烃内酯调控肝细胞中脂质相关转录因子的表达Fig.3 Costunolide regulates the expression of lipogenesis-related transcription factors in hepatocytes注:(A)Real-time PCR检测木香烃内酯对乙醇刺激的LO2细胞中SREBP-1c、PPARα的mRNA表达的影响,与对照组相比,**P<0.01,与乙醇组相比,#P<0.05,##P<0.01;(B)Western blot检测木香烃内酯对乙醇刺激的LO2细胞中SREBP-1c、PPARα的蛋白表达的影响,与对照组相比,**P<0.01,与乙醇组相比,#P<0.05,##P<0.01。Note:(A) Real-time PCR analyses for evaluating the effects of costunolide on mRNA expression of SREBP-1c and PPARα in ethanol-stimulated O2 cells treated with costunolide,**P<0.01 vs control,#P<0.05 vs ethanol,##P<0.01 vs ethanol;(B) Western blot analyses for evaluating the effects of costunolide on protein expression of SREBP-1c and PPARα in ethanol-stimulated LO2 cells treated with costunolide,**P<0.01 vs control,#P<0.05 vs ethanol,##P<0.01 vs ethanol.
3.4 木香烃内酯依赖于激活AMPK调控肝细胞中脂质相关转录因子的表达
进一步探究木香烃内酯的可能作用靶标。腺苷酸激活蛋白激酶(AMPK)是细胞的能量感受器,在肝脏脂质代谢调节中也发挥重要作用,可以成为药物干预酒精性脂肪肝的分子靶标[7]。Western blot检测结果显示,乙醇显著抑制LO2细胞中AMPK的磷酸化,而木香烃内酯在20、40μM时显著上调乙醇刺激的LO2细胞中AMPK的磷酸化(图4A),提示能够增强AMPK的活性。以AMPK的特异性抑制剂BML-275作为工具药,考察木香烃內酯对肝细胞脂质的调控是否依赖于激活AMPK。Real-time PCR检测结果显示,BML-275在10μ时显著削弱木香烃内酯对SREBP-1c基因表达的抑制作用,同时削弱对PPARα基因表达的上调作用(图4B)。Western blot检测结果显示,BML-275在蛋白水平也产生相似的作用(图4C)。上述结果表明,木香烃内酯依赖于激活AMPK调控肝细胞中脂质调控相关转录因子的表达。
4 讨论
长期过量摄入酒精,肝脏无法将其完全代谢,将导致体内诸多生理、生化和代谢平衡失调,造成肝细胞损伤,进而引发酒精性肝脏疾病的发生。酒精性脂肪肝发展为肝纤维化和肝硬化的危险性比单纯性脂肪肝更高。一方面,酒精在肝脏通过CYP2E1代谢产生活性氧自由基,引起脂质过氧化连锁反应,在肝脏内生成脂质过氧化终产物,造成肝细胞损伤,导致肝细胞凋亡或坏死;另一方面,进入肝细胞的酒精在乙醇脱氢酶和微粒体乙醇氧化酶系的作用下转变为乙醛,再转变为乙酸,后一反应使氧化型辅酶I
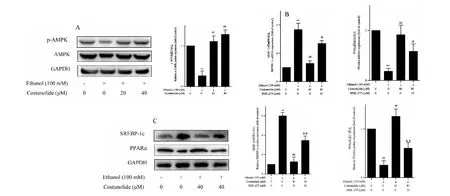
图4 木香烃内酯通过激活AMPK调控肝细胞中脂质相关转录因子的表达Fig.4 Activation of AMPK is required for costunolide to regulate the expression of lipogenesis-related transcription factors in hepatocytes注:(A)Western blot检测木香烃内酯对乙醇刺激的LO2细胞中AMPK磷酸化的影响,与对照组相比,**P<0.01,与乙醇组相比,##P<0.01;(B)Real-time PCR检测木香烃内酯及其与BML-275联用时对乙醇刺激的LO2细胞中SREBP-1c、PPARα的mRNA表达的影响,与对照组相比,**P<0.01,与乙醇组相比,##P<0.01,与木香烃内酯组相比,&P<0.05;(C)Western blot检测木香烃内酯及其与BML-275联用时对乙醇刺激的LO2细胞中SREBP-1c、PPARα的蛋白表达的影响,与对照组相比,**P<0.01,与乙醇组相比,##P<0.01,与木香烃内酯组相比,&&P<0.01。Note:(A) Western blot analyses for evaluating the effects of costunolide on AMPK phosphorylation in ethanol-stimulated LO2 cells treated with costunolide,*P<0.05 vs control,##P<0.01 vs ethanol;(B) Real-time PCR analyses for evaluating the effects of costunolide on mRNA expression of SREBP-1c and PPARα in ethanol-stimulated LO2 cells treated with costunolide and/or BML-275,**P<0.01 vs control,##P<0.01 vs ethanol,&P<0.05 vs costunolide;(C) Western blot analyses for evaluating the effects of costunolide on protein expression of SREBP-1c and PPARα in ethanol-stimulated LO2 cells treated with costunolide and/or BML-275,**P<0.01 vs control,##P<0.01 vs ethanol,&&P<0.01 vs costunolide.
(NAD)转变为还原型辅酶I(NADH),因而NADH与NAD比值升高。NADH/NAD比值的升高可抑制细胞线粒体内的三羧酸循环,使肝内脂肪酸代谢发生障碍,氧化分解减弱,从而导致脂肪堆积于肝细胞中;另外,NADH/NAD比值的升高促进了脂肪酸的合成,也导致脂肪在肝细胞中堆积,最终导致了脂肪肝形成[8]。本研究发现,乙醇在100 mM浓度下对人LO2肝细胞作用48 h可以显著抑制肝细胞的活力,促进转氨酶的释放,并增加细胞内脂质成分的生成与集聚,提示形成了酒精体外诱导肝细胞损伤与脂肪变性的模型,这一模型可用于考察药物体外对酒精性脂肪肝的干预作用。
木香烃内酯是一个受到广泛关注的药用天然产物。早先有研究发现木香烃内酯能够抑制机体胃肠道对酒精的吸收,提示对酒精导致的肝损伤有潜在的保护作用[9]。越来越多的证据表明木香烃内酯对肝脏具有多种药理作用,如通过阻断NF-κB信号通路改善急性肝损伤[4],抑制肝细胞表达乙肝病毒表面抗原[10],抑制肝脏中的氧化应激反应[11],以及阻断肝癌细胞的周期进而抑制其增殖[12]。据此,本论文旨在探讨木香烃内酯对酒精性脂肪肝的潜在干预作用与机制,发现木香烃内酯体外对正常肝细胞活力没有显著影响,但可以显著改善酒精诱导的肝细胞损伤以及脂质成分的合成,尤其是降低细胞内TG和TC水平的升高。肝脏是合成和贮存TG和TC的主要器官。脂肪性肝病以肝细胞内TG和TC蓄积过多和弥漫性肝细胞脂肪变性为主要病理特征。在酒精性脂肪肝进程中,乙醇联合游离脂肪酸能够降低线粒体脂肪酸β氧化能力,使TG和TC大量沉积于肝脏[13]。因此,木香烃内酯抑制肝细胞内TG和TC生成的作用可能是其改善酒精性脂肪肝的重要途径之一。
本研究进一步从肝细胞脂质成分转录调控的角度探讨木香烃内酯的作用机制。SREBP是调控脂质代谢相关基因表达的关键核转录因子,共分为三种SREBP亚型,它们在脂质合成中各自起到不同的作用,其中SREBP-1c是肝脏脂质代谢的关键调控者,几乎参与所有肝脏甘油三酯和脂肪酸合成基因的转录。SREBP-1c的过度表达将引起糖脂代谢的异常,使产脂量大幅提升,进而导致肝脏等非脂肪组织的脂质积聚[14]。PPARα是一个主要在肝脏表达的核转录因子,参与调节脂肪酸β氧化及脂蛋白合成中相关基因的表达,促进肝脏脂代谢,改善胰岛素抵抗。PPARα的缺乏或低表达可以使肝脏脂质的利用和脂肪酸的氧化发生障碍,导致肝脏甘油三酯沉积、糖脂代谢紊乱[15]。有研究发现,PPARα的拮抗剂GW6471可加重糖尿病脂肪肝小鼠肝脏炎症反应,而PPARα的激动剂WY14643可提高糖尿病脂肪肝小鼠脂肪变性程度[16]。因此,SREBP-1c与PPARα二者在细胞内脂质代谢方面产生相反的调控作用,并且存在相互关联,如有研究发现PPARα可抑制SREBP-1c的活性,从而减少脂肪酸和TG的合成[17]。本论文研究发现在乙醇刺激的LO2细胞中,木香烃内酯可显著下调SREBP-1c的表达并恢复PPARα的表达,这一作用可能是木香烃内酯抑制LO2细胞内TG、TC等脂质成分合成的上游事件。这些结果也提示木香烃内酯可以在转录水平抑制肝细胞内的脂质生成。进一步发现木香烃內酯的作用依赖于激活AMPK。AMPK是广泛表达的丝氨酸/苏氨酸蛋白激酶复合体,在应激情况下,AMPK 磷酸化后激活,通过限制合成代谢减少ATP的消耗和促进分解代谢增加ATP的生成来维持机体稳态[18]。本研究结果提示木香烃内酯减少乙醇诱导的肝细胞内的脂质含量可能与激活AMPK,进而影响脂质相关转录因子相关。后续工作将进一步探究木香烃内酯如何激活肝细胞中的AMPK。
综合本研究的结果表明,木香烃内酯可能通过激活AMPK,调控脂质代谢相关转录因子SREBP-1c与PPARα的表达,进而减少肝细胞内的脂质生成与集聚。这一发现为木香烃内酯作为酒精性脂肪肝的潜在防治药物的进一步研究提供实验依据。

