评价肿瘤疫苗免疫原性的新型人免疫系统小鼠模型
江亮亮,江 涛,罗建华,姚文兵,田 浤
(中国药科大学生命科学与技术学院,江苏省生物药物成药性研究重点实验室,南京 210009)
治疗性肿瘤疫苗具有诱导高度特异性抗肿瘤效应和长效免疫记忆的巨大优势[1]。诱导肿瘤抗原特异性细胞和体液免疫应答的能力对于肿瘤疫苗抑制肿瘤至关重要的。然而,由于免疫系统的种属特异性,很难在临床前研究中准确预测肿瘤疫苗的免疫原性[2-3]。例如,实验动物(黑猩猩或MUC1转基因小鼠)的体内研究显示,MUC1疫苗可以引发动物体内抗原特异性免疫反应[4-5]。然而,在Ⅰ/Ⅱ期临床试验中给予晚期肿瘤患者时,MUC1疫苗的免疫原性较低,未能诱导出有效的抗肿瘤效应[6-7]。
人免疫系统(human immune system,HIS)小鼠是通过在免疫缺陷小鼠中重建功能性人免疫系统而产生的人源化小鼠模型,已广泛用于免疫治疗的临床前研究[3]。研究表明,在免疫缺陷小鼠体内重建的人免疫系统能够产生针对特定抗原的免疫应答。Spranger等[8]构建了人外周血单个核细胞(peripheral blood mononuclear cells,PBMC)-NSG小鼠模型,以评估黑色素瘤相关抗原-1疫苗,结果显示该疫苗可诱导特异性CD8+T细胞的产生。在另一项研究中,Camacho等[9]在Hu-PBMC-NOD/scid-DR1小鼠中评估了癌胚抗原疫苗并检测到了CEA特异性细胞免疫应答。这些证据表明,HIS小鼠可以反映人免疫细胞对肿瘤抗原的反应,可以作为研究抗肿瘤免疫反应的模型[10]。
尽管CD8+T细胞通常被认为在抗肿瘤免疫中很重要,但越来越多的研究表明体液免疫应答在肿瘤免疫治疗中也起着重要作用[1,11]。因此,预测肿瘤疫苗诱导体液免疫应答的能力在肿瘤疫苗设计中至关重要。Becker等[12]通过移植PBMCs构建HIS模型小鼠并注射乙型肝炎疫苗和破伤风类毒素疫苗后,在小鼠体内可以检测到乙肝和破伤风特异性抗体。但是,通过直接移植PBMCs构建的HIS模型小鼠存在明显的缺陷。该HIS小鼠中分泌IgG型抗体的B细胞比例极低,B细胞反应不稳定[13]。此外,人类树突状细胞(DCs)在移植PBMC的HIS小鼠中所占比例极低[14-15],而DCs在启动T细胞应答中起到十分关键的作用。基于PBMCs移植的HIS小鼠难以对疫苗进行有效的加工与递呈,因而难以准确反应疫苗的免疫原性。
据报道,DCs是目前发现最强的抗原递呈细胞,未成熟的DCs具有强大的抗原内吞能力,而成熟的DCs高表达协同刺激因子同时进行抗原的提呈作用[16]。和一般抗原提呈细胞不同,DCs不仅可激活记忆性T细胞或已活化T细胞,还能刺激naïve T细胞的增殖,有效地激活CD4+T细胞和CD8+T细胞[17]。因此,本研究将负载疫苗的DCs和PBMCs共移植NCS小鼠,构建DC-HIS小鼠模型以模拟人体的免疫应答情况,用于肿瘤疫苗的免疫原性评价。
1 材 料
1.1 试剂及细胞株
人IgG ELISA试剂盒(美国eBioscience公司);Alum佐剂、CpG佐剂、FITC标记的羊抗小鼠IgG和HRP标记的羊抗小鼠IgG(美国BD公司);3,3′,5,5′-四甲基联苯胺(TMB,北京索莱宝科技有限公司);Amp、Cm(南京鼎国生物技术有限公司);小鼠脾脏淋巴细胞分离液(天津灏洋生物制品科技有限责任公司);乳酸脱氢酶(LDH)细胞毒性检测试剂盒(上海碧云天生物技术有限公司)。靶向HER2的蛋白疫苗NitraTh-HER2参考文献[18-19]中所述方法制备。
人乳腺癌细胞株SK-BR-3和人胚胎肾细胞系HEK293(中国药科大学江苏省生物药物成药性研究重点实验室保存)。
pcDNA3.1(+) Vector为中国药科大学江苏省生物药物成药性研究重点实验室保存。
1.2 动 物
SPF级NCG雌性小鼠(6~8周龄)购自南京大学模式动物研究院,合格证号:SCXK(苏)2015-0001。所有动物实验均符合动物伦理委员会标准。
1.3 仪 器
全波长酶标仪、高速冷冻离心机、细胞培养箱(美国Thermo公司);Countstar全自动细胞计数仪(上海泽权仪器设备有限公司);水平离心机(湖南湘仪离心机仪器有限公司);流式细胞仪(美国BD公司)。
2 方 法
2.1 PBMCs分离和移植
通过密度梯度离心分离来自健康志愿者的PBMC。取健康志愿者外周血50 mL装在抗凝管,上下颠倒混匀。将外周血装在50 mL离心管,1 000 r/min离心5 min。轻柔吸除部分最上层血浆。用无菌PBS按3∶2稀释剩余血液,上下颠倒混匀。新取50 mL离心管加入人淋巴细胞分离液15 mL,倾斜后,沿管壁缓慢加入25 mL稀释血液,1 640 r/min离心20 min。离心结束后,轻柔吸取第二层白色薄膜层到新50 mL离心管,用无菌PBS按4∶1稀释,上下颠倒混匀,1 640 r/min离心10 min。弃上清液,用无菌PBS 30 mL重悬,1 400 r/min离心3 min。重复上一步骤。弃上清液,用1640完全培养基重悬沉淀单核细胞,取部分样品计数。为了构建HIS小鼠,将2×107个PBMC用RPMI 1640培养基200 μL重悬,并通过腹膜内或/和静脉内移植到NCG小鼠中。
2.2 单核细胞来源DCs的体外诱导
将黏附的单核细胞与PBMC分离,并在含有800 U/mL重组人GM-CSF和500 U/mL IL-4的RPMI 1640完全培养基中培养7 d。每2天更新培养基和细胞因子。在第4天,使用终浓度为50 μg/mL匙孔血蓝蛋白(KLH),卵白蛋白(OVA)或NitraTh-HER2孵育未成熟DC。在第6天,用40 ng/mL重组人TNF-α刺激DC。24 h后,收获成熟DC。
2.3 HIS小鼠的免疫
分选PBMC(2×107个)并分别用蛋白100 μg(KLH,OVA或NitraTh-HER2)刺激过夜。收集PBMC用RPMI 1640培养基200 μL重悬,移植到NCG小鼠中。在第7天,在PBMCs+DCs组中,用抗原孵育的DC(5×105个)免疫小鼠;在PBMC组中,用50 μg与铝佐剂或佐剂混合的相应蛋白质免疫小鼠。在第14天,用50 μg蛋白质免疫所有小鼠。在第28天,将小鼠处死并收集组织样品。
2.4 ELISA试验
每周收集免疫小鼠的血清。通过人IgG ELISA试剂盒评估总人IgG浓度。为了测量特异性抗体的水平,用ELISA包被液分别稀释抗原至10 μg/mL,在酶标条中每孔加入100 μL,37 ℃孵育2 h。PBST清洗5次,每孔加入ELISA封闭液200 μL ,4 ℃过夜孵育。PBST清洗5次;加入小鼠血清(PBS 1∶800稀释)作为一抗,37 ℃孵育2 h。PBST清洗5次,加入辣根过氧化物酶标记的羊抗人IgM或辣根过氧化物酶标记的羊抗人IgG(二抗稀释液1∶10 000稀释)作为二抗,37 ℃孵育45 min。PBST清洗5次,每孔加入TMB显色液100 μL,37 ℃避光孵育15 min。每孔加入终止液50 μL终止反应,测定450/630 nm波长下样品的吸收度。
2.5 流式检测HIS脾脏CD4+/CD8+ T细胞的比例和激活检测
取小鼠脾脏淋巴细胞,用流式缓冲液稀释为每毫升1×107个。取100 μL,加入相应的流式染料,冰上避光孵育30 min,每隔10分钟轻柔振荡。30 min后,1 000 r/min离心5 min。。弃上清液,加入流式缓冲液500 μL重悬,1 000 r/min离心5 min。重复上一步骤。弃上清液,流式缓冲液200 μL重悬,流式细胞仪检测。
小鼠脾脏淋巴细胞标记:人淋巴细胞(PerCP-Cy5.5-hCD45),人T细胞(PerCP-Cy5.5-hCD45,FITC-hCD3),人B细胞(PerCP-Cy5.5-hCD45,PE-hCD19)。人辅助T细胞(FITC-hCD3,BB515-hCD4),人CTL细胞(FITC-hCD3,PE-hCD8)。激活的CD4+T细胞(PerCP-Cy5.5-hCD45,BB515-hCD4,APC-hCD69),激活的CD8+T细胞(PerCP-Cy5.5-hCD45,PE-hCD8,APC-hCD69)。
2.6 免疫组化和免疫荧光
小鼠处死时,将脾脏固定在4%多聚甲醛中。用小鼠抗人CD45,CD3,CD19抗体进行免疫组织化学染色。在该过程结束时,将切片与3-二氨基联苯胺反应并用苏木精复染,通过光学显微镜观察。对于免疫荧光测定,将切片用小鼠抗人CD11c抗体和兔抗人CD3抗体染色,然后与Alexa 488(绿色)缀合的山羊抗小鼠IgG和Cy3(红色)缀合的兔IgG抗体一起孵育。通过数字载玻片扫描仪扫描后观察。
2.7 乳酸脱氢酶(LDH)释放试验检测细胞毒性T淋巴细胞(CTL)效应和抗体依赖细胞介导的细胞毒作用(ADCC)效应
为了检测CTL效应,使用SK-BR-3或HEK293细胞(每孔1×104个)作为靶细胞。将疫苗免疫后小鼠的脾脏细胞并与靶细胞一起以50∶1的效应/靶比例培养4 h,通过LDH释放测定试剂盒测量LDH释放量,计算CTL效应。为了检测ADCC效应,使用SK-BR-3(每孔1×104个)作为靶细胞,将免疫小鼠的血清1∶50稀释用作抗体,将疫苗免疫后小鼠的脾脏细胞并与靶细胞一起以50∶1的效应/靶比例培养4 h,通过LDH释放测定试剂盒测量LDH释放量,计算ADCC效应。
2.8 统计学分析
采用GraphPad Prism 5软件进行统计学分析。采用Student′st-test进行数据显著性比较,P<0.05为显著性差异,具有统计学意义。
3 结 果
3.1 联合腹膜内和静脉内移植在HIS小鼠中具有最高的人淋巴细胞重建水平
为了优化HIS小鼠的重建水平,分别通过腹膜内(ip)、静脉内(iv)或联合两种途径将2×107个人PBMC移植到NCG小鼠中。移植后5周,ip+iv组脾脏明显增大(图1-A)。流式分析显示,ip+iv组在脾脏(69.4%±9.9%)和外周血(78.7%±12.2%)中有最高的人单核细胞(hCD45+)比例(图1-B~1-C)。位于HIS小鼠脾脏中的人CD45+细胞主要由成簇的CD3+T细胞和分散的CD19+ B细胞组成(图1-D)。值得注意的是,与iv组或ip组相比,ip+iv组更快地产生人IgG抗体并具有更高的抗体滴度(图1-E)。这些结果显示联合iv+ip注射途径具有最佳的植入效率,并用于随后的实验中。
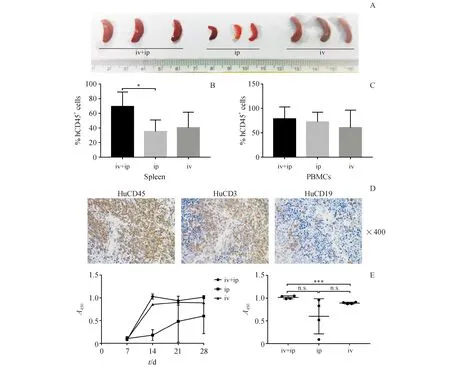
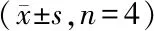
NCG mice were engrafted with PBMCs via iv,ip or ip + iv on day 0.Sera were collected weekly and tissue samples were harvested on day 35.(A) The spleen size of mice.(B,C) The percentage of hCD45+cells in the spleen and peripheral blood.(D) Immunohistochemistry examination of hCD45+cells,hCD3+T cells and hCD19+B cells in the spleen of mice engrafted with PBMCs via iv + ip.Original magnification × 400.(E) The concentration of human IgG in sera of mice on day 21
n.s.:Not significant.*P<0.05vsip group,***P<0.001vsiv group
3.2 同源DC可以与T细胞共定位于HIS小鼠脾脏
为了评估同源DCs对抗原特异性抗体产生的影响,用负载KLH的同源DCs免疫HIS小鼠(PBMC+DCs组),给予混合铝佐剂的KLH作为对照(PBMC组)。在第28天,PBMC+DC组中小鼠脾脏中的人抗原呈递细胞(hCD11c+HLA-DR+)显着增加(P<0.01)(图2-A),表明DC的成功移植和迁移。此外,免疫荧光测定显示供体匹配的人DCs和T细胞聚集在脾脏的某些区域(图2-B),预示可能发生DC-T细胞相互作用和T细胞特异性激活。
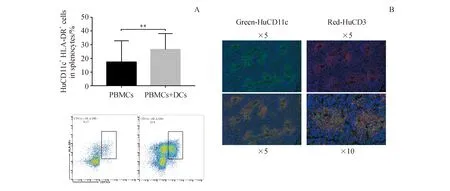
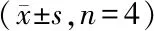
DC-HIS mice or HIS mice were immunized with KLH.Tissue samples were harvested on day 28.(A) Percentages of hCD11c+HLA-DR+cells in the spleen.(B) Immunofluorescent examination of hCD11c+DCs (Green) and hCD3+T cells (Red) in the spleen of DC-HIS mice.Original magnification × 5 or × 10
**P<0.01vsPBMCs group
3.3 同源DC可以针对不同抗原诱导特异性抗体反应
与PBMC组相比,在PBMCs+DCs组的血清中检测到更高水平的KLH特异性人IgM(P<0.05)(图3-A)。值得注意的是,在所有组中,只有负载KLH的DC可以在HIS小鼠中诱导出高滴度的KLH特异性人IgG抗体(图3-B)。为了进一步确定DC的共移植是否可以诱导针对多种抗原的特异性抗体应答,用负载鸡卵清蛋白(OVA)的DC免疫小鼠。如图3-C和3-D所示,负载OVA的同源DC也可以诱导OVA特异性人IgM和IgG抗体的产生。这表明在DC-HIS小鼠模型中,DC-T细胞可以相互作用,并诱导抗原特异性IgM和IgG抗体产生。
3.4 同源DC可以促进外周人CD4+ T细胞激活
为了进一步证实同源DC的共移植的作用,用肿瘤疫苗免疫DC-HIS小鼠或HIS小鼠并且研究了DC对人T细胞亚群的影响。通常,基于自身抗原的肿瘤疫苗由于免疫耐受而难以诱导特异性免疫应答。在前期研究中,设计了硝基化Th细胞表位(命名为NitraTh),它可以显着增强HER2疫苗在小鼠体内的免疫原性[19]。将人HER2的胞外区域(369~647)与NitraTh融合以构建靶向HER2的疫苗(NitraTh-HER2)。
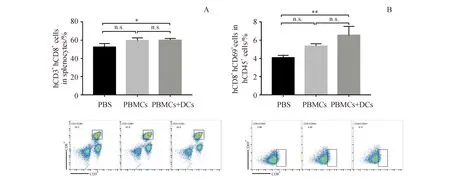
用NitraTh-HER2免疫DC-HIS小鼠(PBMCs+DCs组);用NitraTh-HER2免疫没有DC共移植的HIS小鼠(PBMC组)作为对照。虽然DCs对脾脏中hCD45+细胞的频率没有显着影响(图4-A),但PBMC+DCs组中CD4+T细胞比例显著高于PBS组(P<0.05)(图4-B)。此外,PBMCs+DCs组中CD4+CD69+T细胞的比例显着高于PBMCs组(P<0.05)(图4-C),表明DC的共同移植改善了CD4+T细胞的活化。与这些结果一致,在PBMC+DCs组小鼠脾脏中检测到更高比例的B细胞(图4-D)。
3.5 同源DC可以促进外周人CD8+ T细胞激活
进一步检测同源DC对CD8+T细胞的影响,流式检测显示,相对于对照组,PBMC+DCs组中CD8+T细胞和CD8+CD69+T细胞显著增加(图5),表明DC可以增强NitraTh-HER2产生的细胞免疫。总结这些结果,DC-HIS小鼠模型可以更有效地模拟人免疫系统对肿瘤疫苗的反应。
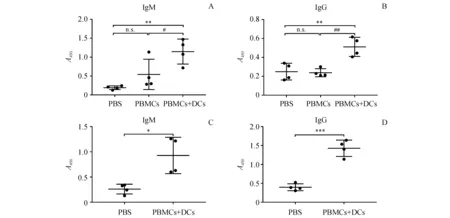
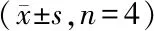
Model mice were immunized with KLH or OVA.Sera were collected weekly.(A) Concentration of KLH-specific human IgM and IgG in sera of mice on day 21.(B) Concentration of OVA-specific human IgM and IgG in sera of mice on day 21
*P<0.05,**P<0.01,***P<0.001vsPBS group;#P<0.05,##P<0.01vsPBMCs group
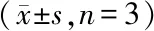
DC-HIS mice or HIS mice were immunized with NitraTh-HER2.Splenocytes were harvested on day 28.(A,B,C,D) Percentage of human total mononuclear cells (hCD45+),helper T cells (hCD3+hCD4+),activated helper T cells (hCD4+hCD69+) and B cells (hCD19+) in the spleen
*P<0.05,***P<0.001vsPBS group;#P<0.05vsPBMCs group
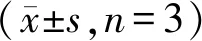
DC-HIS mice or HIS mice were immunized with NitraTh-HER2.Splenocytes were harvested on day 28.(A,B) Percentage of cytotoxic T cell (hCD3+hCD8+) and activated cytotoxic T cells (hCD8+hCD69+) in the spleen
*P<0.05,**P<0.01vsPBS group
3.6 DC-HIS小鼠评价HER2肿瘤疫苗免疫原性
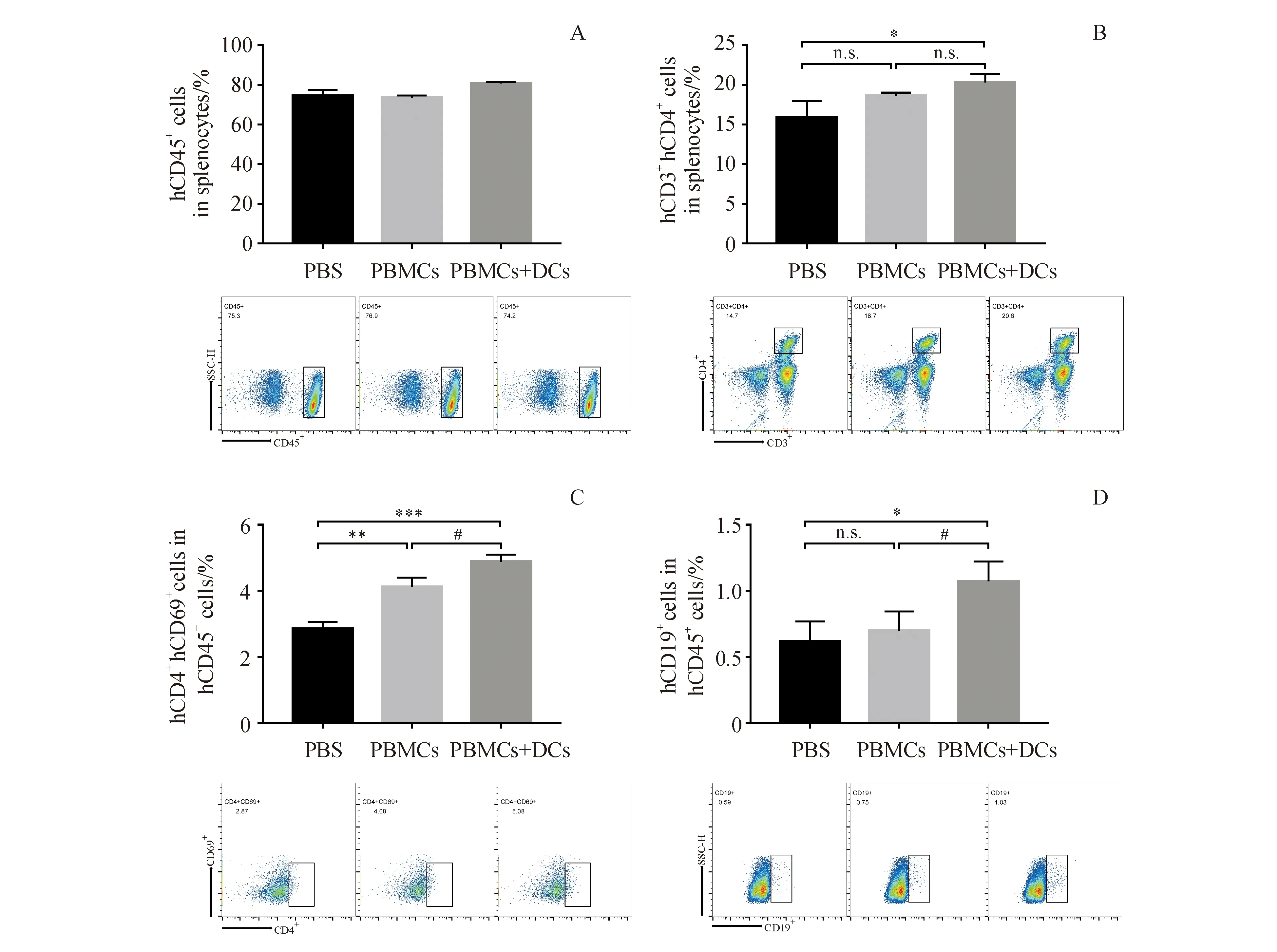
为了确认DC-HIS小鼠是否可用于肿瘤疫苗评估,用靶向HER2的肿瘤疫苗(NitraTh-HER2)免疫DC-HIS小鼠。在第28天,可以在DC-HIS小鼠血清中检测到高水平的HER2特异性抗体(图6-A)。此外,DC-HIS小鼠中的抗体以浓度依赖性方式介导ADCC。当1∶50稀释时,DC-HIS小鼠血清对SK-BR-3细胞产生显着的ADCC作用,裂解率达到47.1%(图6-B)。此外,DC-HIS小鼠也可用于评估NitraTh-HER2的CTL效应,SK-BR-3细胞(HER2+)的裂解率达到(14.6±1.1)%,而HEK293细胞(HER2-)的溶解率仅为(5.7±0.5)%,表明NitraTh-HER2诱导的CTL效应是HER2特异性的(图6-C)。
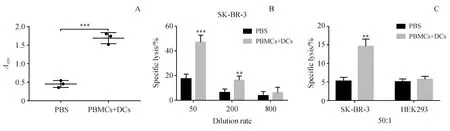
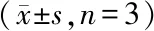
DC-HIS mice were immunized with NitraTh-HER2.Sera were collected weekly.(A) Concentration of HER2-specific human IgG in sera of mice on day 21.(B,C) Splenocytes were collected on day 28.A conventional 4-h LDH release assay was performed to measure lysis of tumor cells for ADCC and CTL
**P<0.01,***P<0.001vsPBS group
4 讨 论
在本研究中,通过构建DC-HIS小鼠模型来评估肿瘤疫苗的免疫原性,该DC-HIS小鼠模型有显著的CD4+/CD8+T细胞激活反应,可以全面评估肿瘤疫苗NitraTh-HER2的免疫原性,包括特异性抗体滴度,ADCC效应和CTL效应。
通常,通过PBMC或造血干细胞(HSC)的植入来重建HIS小鼠。人免疫细胞的所有谱系都可以在植入人HSC的嵌合体小鼠中产生,然而,免疫缺陷小鼠胸腺上皮细胞上表达的是小鼠MHC分子而不是人HLA分子,在HIS小鼠中发育的人T细胞缺乏识别抗原的能力[20]。缺乏人T细胞和B细胞发育所需的人生长因子和细胞因子的是HSCs重建小鼠的另一个限制[21]。与HSC相比,PBMC中的淋巴细胞已经成熟,可以更准确地反映人体免疫系统对抗原的反应。此外,完全分化的人PBMC所需的重建时间短于HSC[22]。因此,在本研究中,选择PBMC构建DC-HIS小鼠模型。
由于免疫系统的种属特异性,在临床前研究中准确预测肿瘤疫苗的免疫原性具有挑战性。例如MUC1肽疫苗,它成功地在转基因小鼠中引发抗肿瘤免疫应答,但在临床试验中对患者显示出较弱的免疫原性[5-6]。MHC限制可能是此问题的主要原因。此外,尽管人HLA II类分子在免疫缺陷小鼠中的表达改善了小鼠的人T细胞和B细胞功能[13],但人HLA II类分子的多样性仍可导致对DC的不适当选择。因此,在基于PBMC移植的HIS小鼠可能无法准确反映肿瘤疫苗在人体内的免疫应答。
DCs是最有效的APC,通过分泌细胞因子诱导抗体的产生并促进B细胞的免疫球蛋白类转换[23]。据报道,在PBMC植入的HIS小鼠中缺乏人类抗原呈递细胞(APC)[24]。缺乏人DC可能是HIS小鼠未能产生强烈体液免疫反应的主要原因。本实验结果与文献报道的相一致,相对于用KLH直接刺激,负载KLH的DC能诱导更高的KLH特异性抗体水平(图3-A,3-B)。此外,在DC-HIS小鼠中检测到显著水平的人OVA特异性IgG抗体(图3-D),显示DCs在HIS小鼠中诱导高体液免疫应答中的重要性。
同源DC不仅以HLA限制性方式有效地呈递抗原,而且在成熟DC上表达的共刺激分子在抗原特异性T细胞的有效活化中也具有重要作用。与此观点一致,证实共同移植的DC改善了外周人T细胞的增殖和活化,包括辅助T细胞(图4-B和4-C)和细胞毒性T细胞(图5)。这些T淋巴细胞与肿瘤疫苗的体液和细胞免疫密切相关。用肿瘤疫苗免疫DC-HIS小鼠并检测特异性免疫应答,结果显示,NitraTh-HER2在DC-HIS小鼠中成功诱导抗原特异性抗体,并能诱导产生ADCC效应和CTL效应。因此用DC-HIS小鼠模型可通过直接检测疫苗的ADCC活性和CTL活性来评估疫苗的抗肿瘤活性。
总之,基于同源DCs共移植策略的HIS小鼠模型为评估肿瘤疫苗的抗肿瘤活性提供了灵活且灵敏的评价方法,是用于弥合啮齿动物模型与人类免疫系统之间差距的有效模型。

