LC-MS/MS同时测定人血浆中阿莫西林和克拉维酸及其生物等效性研究
纪顺利,宋帆帆,郑 阳,丁 黎,*
(1中国药科大学药物分析教研室,南京 210009;2南京科利泰医药科技有限公司,南京 211100)
阿莫西林克拉维酸钾(结构式见图1)是由阿莫西林和克拉维酸钾组成的口服复方抗菌药物。阿莫西林为广谱的半合成青霉素,口服吸收好,抗菌作用强,但易被β-内酰胺酶水解。克拉维酸是一种不可逆的竞争性β-内酰胺酶抑制剂,它具有与青霉素结构类似的β-内酰胺结构,通过阻断β-内酰胺酶的活性位点来抑制其活性。克拉维酸抗菌活性弱,与阿莫西林联用时,抗菌作用增强,抗菌谱增大[1-4],是临床常用抗生素类药物。
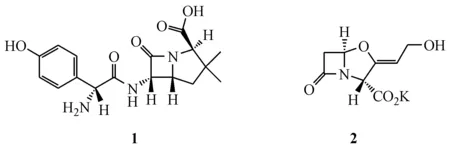
Figure 1 Structures of amoxicillin (1) and clavulanic acid (2)
目前文献报道的同时检测阿莫西林(amoxicillin,Amo)和克拉维酸(clavulanic acid,Cla)的方法主要有HPLC-UV、HPLC-FLD、HPLC-MS/MS。因克拉维酸只有末端紫外吸收,需经衍生化后方可采用HPLC-UV测定,且该方法受血浆中内源性杂质干扰较多,故应用较少[5]。在使用HPLC-FLD测定克拉维酸时,需加入苯甲醛乙醇等溶剂才可形成荧光产物,此类溶剂毒性较大,易对实验人员健康造成危害[6]。HPLC-MS/MS[7]是目前应用最为广泛的方法,Gaikwad等[8]采用LC-MS/MS法同时测定人血浆中阿莫西林和克拉维酸含量,前处理中加入稳定剂(2%磷酸)后进行固相萃取,阿莫西林和克拉维酸的定量下限分别为50.43和25.28 ng/mL,但该方法前处理较为复杂且成本较高;沈铮等[9]采用LC-MS/MS测得的阿莫西林和克拉维酸的定量下限分别为40.0和20.0 ng/mL。然而,随着新比例的阿莫西林克拉维酸钾复方制剂的出现,此类制剂中克拉维酸的剂量较小,现有方法已不能满足此类剂型中克拉维酸的检测需要。针对此问题,本实验开发了一种前处理简便且灵敏度更高的检测方法,使阿莫西林和克拉维酸的检测限大大降低,可更好的满足新剂型的检测需求。
1 材 料
1.1 药品与试剂
阿莫西林对照品(批号:130409-201512,纯度86.9%,中国食品药品检定研究院);克拉维酸钾对照品(批号:4-AAW-110-1,纯度97.0%)、阿莫西林-d4对照品(批号:7-MOZ-67-2,纯度96.0%)(美国TRC;乙腈和甲醇均为色谱纯(德国Merck KGaA公司);乙酸(ACS-Reagent,批号:STBG6315 ,美国Sigma-Aldrich公司);去离子纯净水(实验室自制);受试制剂阿莫西林克拉维酸钾颗粒1袋(规格:125 mg/31.25 mg);参比制剂阿莫西林克拉维酸钾干混悬剂“Augmentin®” 5 mL(规格:125 mg/31.25 mg)。
1.2 仪 器
AB SCIEX ExionLC AD液相色谱-AB SCIEX Triple Quad TM 6500+质谱(美国AB公司),涡旋混合仪(美国Scientific Industries公司);超纯水系统(美国Millipore Milli-Q Gradient公司);MSA6.6S-OCE-DM电子天平(瑞士梅特勒-托利多仪器有限公司); Heraeus Muitifuge X1R低温离心机(美国Thermo Fisher公司)。
2 方 法
2.1 色谱与质谱条件
色谱条件:色谱柱为Hedera ODS-2(2.1 mm×150 mm,5 μm);流动相:水相为含0.2%乙酸的水溶液,有机相为甲醇;流速为0.5 mL/min;柱温:40 ℃。
质谱条件:采用电喷雾离子化方式(ESI),在多反应监测(MRM)模式下同时对阿莫西林(364.1→223.1,去簇电压DP为-15 V,碰撞电压CE为-16 V)、克拉维酸(198.1→135.9,去簇电压DP为-11 V,碰撞电压CE为-11 V)和内标阿莫西林-d4(368.1→227.1,去簇电压DP为-15 V,碰撞电压CE为-16 V)进行负离子检测。
2.2 溶液的制备
2.2.1 阿莫西林、克拉维酸储备液及工作溶液的配制 精密称取适量阿莫西林对照品,经质量校正系数校正后,将其溶于50%甲醇水溶液中,得到最终质量浓度为1.00 mg/mL的储备液。精密称取适量的克拉维酸对照品,经质量校正系数校正后,将其溶于50%乙腈水溶液中,得到最终浓度为1.00 mg/mL的储备液。用25%甲醇水溶液稀释阿莫西林储备液和克拉维酸储备液制备质量浓度为100/50.0、80.0/40.0、40.0/20.0、12.0/6.00、2.40/1.20、0.800/0.400、0.400/0.200 μg/mL的阿莫西林/克拉维酸标准曲线样品工作溶液;用25%甲醇水溶液稀释阿莫西林储备液和克拉维酸储备液制备质量浓度为200/100、76.0/38.0、16.0/8.00、1.00/0.500、0.400/0.200 μg/mL的阿莫西林/克拉维酸质控样品工作溶液。工作溶液配制于透明聚丙烯离心管中,于-20 ℃冰箱中保存待用。
2.2.2 内标阿莫西林-d4储备液及工作溶液的配制 取一支阿莫西林-d4对照品(规格:1 mg/支),经质量校正系数校正后,将其溶于50%甲醇水溶液中,得到最终质量浓度为1.00 mg/mL的储备液。以50%甲醇水溶液稀释,配制质量浓度为1 000 ng/mL的内标工作溶液。工作溶液配制于透明聚丙烯离心管中,于-20 ℃冰箱中保存待用。
2.2.3 标准曲线及质控样品的配制 人血浆(以EDTA-2K作为抗凝剂)作为空白基质,定量加入50%乙酸水溶液(血浆与50%乙酸水溶液体积比为100∶1)后,用于配制标准曲线样品以及质控样品,配制过程在冰浴下进行。最终配制成含阿莫西林/克拉维酸质量浓度分别为20.0/10.0(LLOQ)、40.0/20.0、120/60.0、600/300、2 000/1 000、4 000/2 000、5 000/2 500 ng/mL(ULOQ)的标准曲线样品和浓度分别为20.0/10.0 ng/mL(LLOQ QC)、50.0/25.0 ng/mL(LQC)、800/400 ng/mL(MQC)、3 800/1 900 ng/mL(HQC)的质控样品。
2.3 血浆样品处理
在冰浴条件下,取含酸血浆样品50 μL,加入沉淀剂乙腈200 μL,涡旋10 min,在4 ℃条件下以4 000 r/min的转速离心10 min,取上清液氮气吹干后用超纯水200 μL复溶,复溶液进行LC-MS/MS定量分析。
2.4 生物等效性研究
2.4.1 试验设计 文献数据显示,阿莫西林的个体内变异系数为20%~30%,而克拉维酸的个体内变异系数为25%~50%,克拉维酸的个体内变异系数大,若采用传统的两周期、双交叉自身对照试验设计,预估的满足生物等效条件所需的试验样本量大,增加了试验的难度与成本。因此,根据FDA《Draft Guidance on Amoxicillin;Clavulanate Potassium》和CFDA《以药代动力学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则》的建议,以及本药物特点,选用总体设计为单中心、开放、随机、单剂量、四周期、两序列、重复试验设计,并确定空腹和餐后生物等效性研究试验的样本量均为40例。
2.4.2 给药方案及血浆样品的采集和处理 空腹和餐后试验各入组受试者40例,按照随机表,每名受试者将被随机分配到两组(TRTR和RTRT)中的某一组。每位受试者进行4个试验周期,服用2次受试制剂和参比制剂,周期间设2天清洗期。
受试者在给药前60分钟内(0 h)和给药后0.25、0.5、0.75、1、1.25、1.5、1.75、2、2.5、3、4、5、6、7和8 h,分别采集静脉血约3 mL至含EDTA-2K抗凝剂的真空采血管中,全血样品低温离心5 min后,在冰浴条件下分离血浆,置于预先加入定量50%乙酸水溶液的样品管中,混合均匀,于-70 ℃冰箱中保存待测。
3 结 果
3.1 专属性
在本试验所采用的色谱条件下,阿莫西林保留时间在1.73 min左右,克拉维酸保留时间在1.79 min左右,内标阿莫西林-d4保留时间在1.72 min左右,无杂峰干扰测定,见图2。
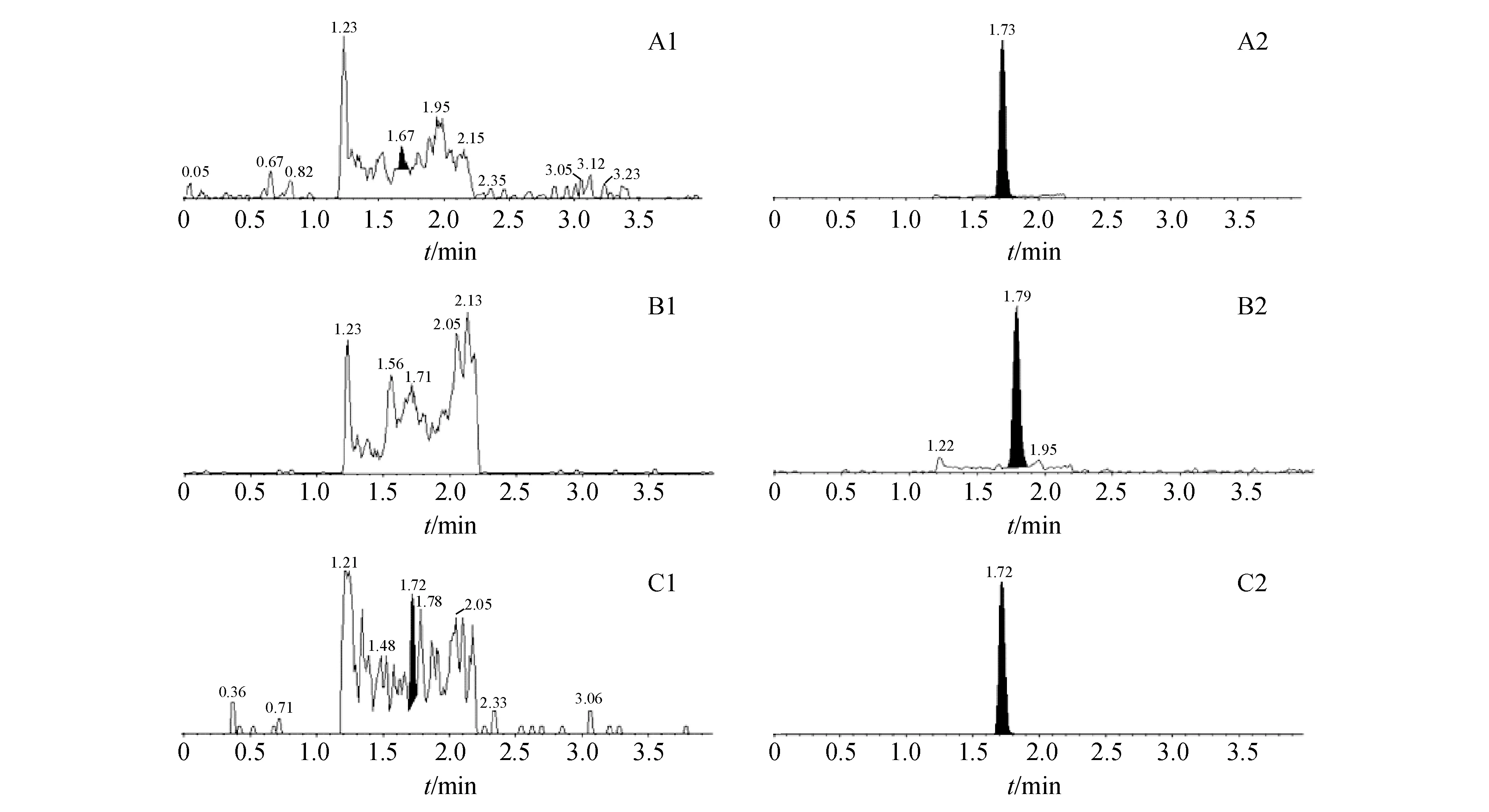
Figure 2 Chromatogram of blank plasma (A1:Amoxicillin;B1:Clavulanic acid;C1:Amoxicillin-d4) and chromatogram of blank plasma spiked with amoxicillin (A2),clavulanic acid (B2) and amoxicillin-d4 (C2)
3.2 线性范围和定量下限
将阿莫西林克拉维酸血浆标准曲线样品按照“2.3”项下血浆的前处理方法,进行LC-MS/MS分析。分别以阿莫西林、克拉维酸的质量浓度为横坐标(X,ng/mL),阿莫西林、克拉维酸与内标阿莫西林-d4的比值为纵坐标(Y)进行加权线性回归,得到阿莫西林的血浆标准曲线方程为Y=9.19E-04+6.04E-04(r=0.999 6),克拉维酸的的血浆标准曲线方程为Y=3.57E-04+1.61-06(r=0.999 5)。结果表明,阿莫西林在20.0~5 000 ng/mL 的范围内线性关系良好,克拉维酸在10.0 ~2500 ng/mL 的范围内线性关系良好。
3.3 精密度与准确度
按照“2.2.3”项下配制4种不同浓度的阿莫西林/克拉维酸血浆质控样品,按照“2.3”血浆处理方法,进行LC-MS/MS分析。每个浓度平行配制6份,并在两天内连续测定3次,分别计算批内和批间精密度,见表1。结果表明,阿莫西林的批内、批间准确度偏差在-1.5%~6.4%范围内,批内、批间精密度不超过3.7%,克拉维酸的批内、批间准确度偏差在-2.4%~3.3%范围内,批内、批间精密度不超过3.9%,该分析方法的准确度及精密度良好,均满足生物样品分析的要求。
3.4 基质效应与提取回收率
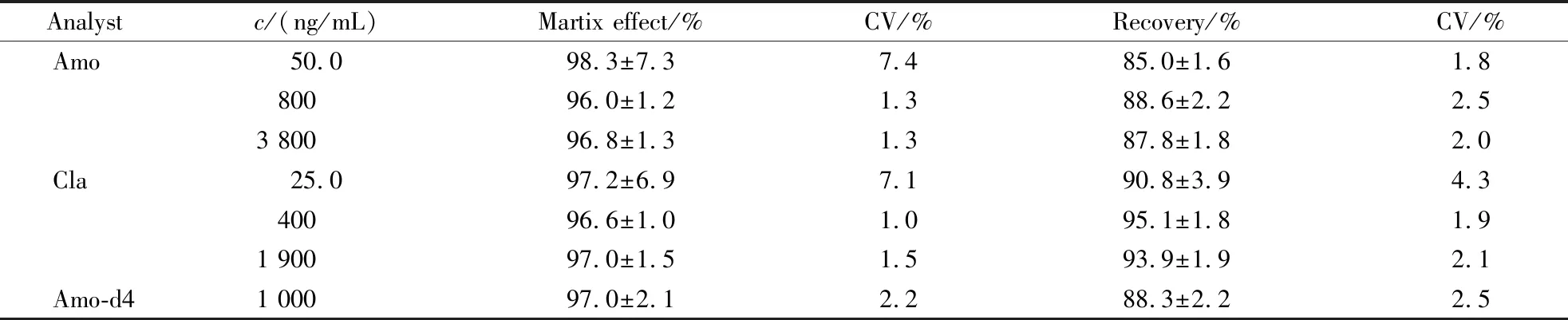
按照“2.2.3”项下配制低、中、高3种不同浓度的阿莫西林/克拉维酸血浆质控样品,按照“2.3”血浆处理方法,进行LC-MS/MS分析。分别记录阿莫西林、克拉维酸和阿莫西林-d4的峰面积Aamo、Acla和AIS;将空白血浆与相应工作溶液进样记为Bamo、Bcla和BIS;将相应工作溶液直接进样记为Camo、Ccla和CIS。阿莫西林、克拉维酸及阿莫西林-d4的提取回收率分别为Aamo/Bamo×100%、Acla/Bcla×100%、AIS/BIS×100%,基质效应为Bamo/Camo×100%、Bcla/Ccla×100%、BIS/CIS×100%,结果见表2。结果表明,阿莫西林、克拉维酸及内标阿莫西林-d4的提取回收率均在85%以上,基质效应不影响对待测物的测定。
3.5 稳定性考察
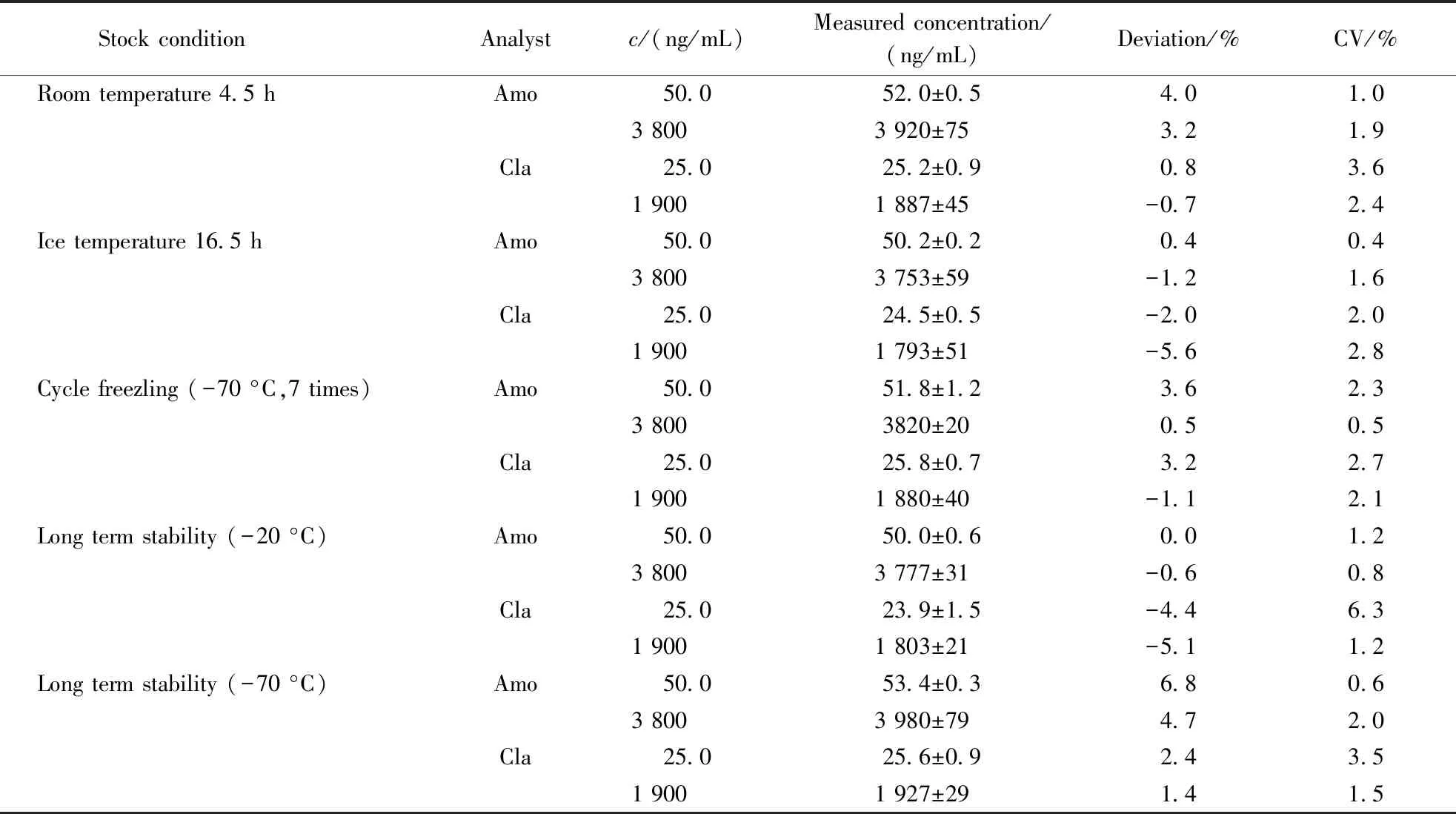
按照“2.2.3”项下配制低、中、高3种不同浓度的阿莫西林/克拉维酸血浆质控样品,经考察,含酸血浆样品在室温条件下放置4.5 h、在冰浴条件下放置16.5 h、在-70 ℃下经过7次冻融循环、-20 ℃ 冷冻8 d、-70 ℃冷冻92 d后稳定性良好,具体结果见表3。
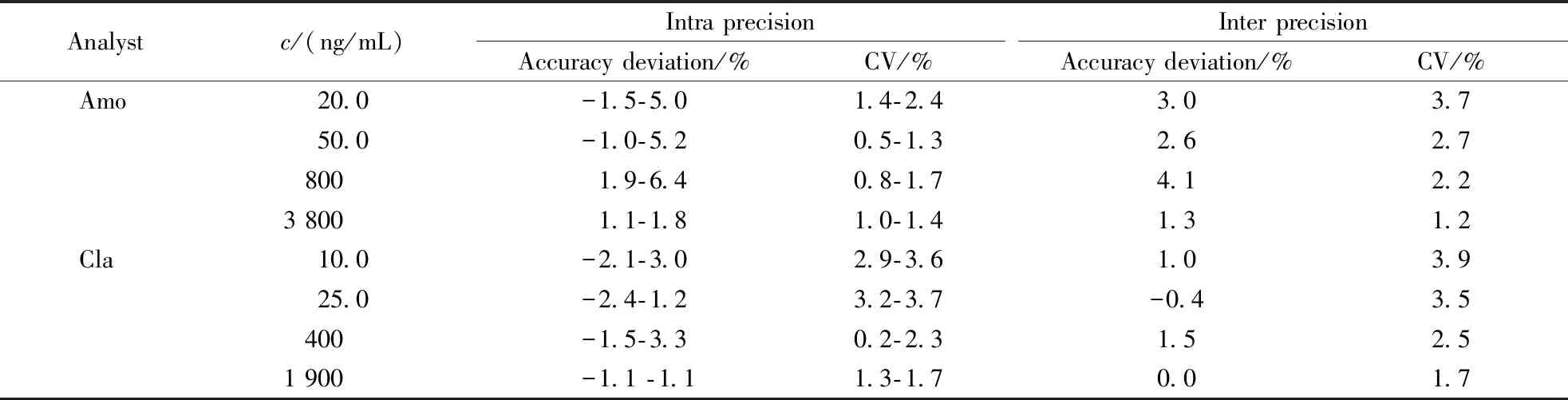
Analystc/(ng/mL)Intra precisionAccuracy deviation/%CV/%Inter precisionAccuracy deviation/%CV/%Amo20.0-1.5-5.01.4-2.43.03.750.0-1.0-5.20.5-1.32.62.78001.9-6.40.8-1.74.12.23 8001.1-1.81.0-1.41.31.2Cla10.0-2.1-3.02.9-3.61.03.925.0-2.4-1.23.2-3.7-0.43.5400-1.5-3.30.2-2.31.52.51 900-1.1 -1.11.3-1.70.01.7
Amo:Amoxicillin;Cla:Clavulanic acid;CV:Coefficient of variation
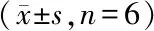
Analystc/(ng/mL)Martix effect/%CV/%Recovery/%CV/%Amo50.098.3±7.37.485.0±1.61.880096.0±1.21.388.6±2.22.53 80096.8±1.31.387.8±1.82.0Cla25.097.2±6.97.190.8±3.94.340096.6±1.01.095.1±1.81.91 90097.0±1.51.593.9±1.92.1Amo-d41 00097.0±2.12.288.3±2.22.5
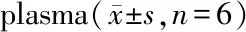
Stock conditionAnalystc/(ng/mL)Measured concentration/(ng/mL)Deviation/%CV/%Room temperature 4.5 hAmo50.052.0±0.54.01.03 8003 920±753.21.9Cla25.025.2±0.90.83.61 9001 887±45-0.72.4Ice temperature 16.5 hAmo50.050.2±0.20.40.43 8003 753±59-1.21.6Cla25.024.5±0.5-2.02.01 9001 793±51-5.62.8Cycle freezling (-70 °C,7 times)Amo50.051.8±1.23.62.33 8003820±200.50.5Cla25.025.8±0.73.22.71 9001 880±40-1.12.1Long term stability (-20 °C)Amo50.050.0±0.60.01.23 8003 777±31-0.60.8Cla25.023.9±1.5-4.46.31 9001 803±21-5.11.2Long term stability (-70 °C)Amo50.053.4±0.36.80.63 8003 980±794.72.0Cla25.025.6±0.92.43.51 9001 927±291.41.5
3.6 阿莫西林克拉维酸在健康人体内的药代动力学
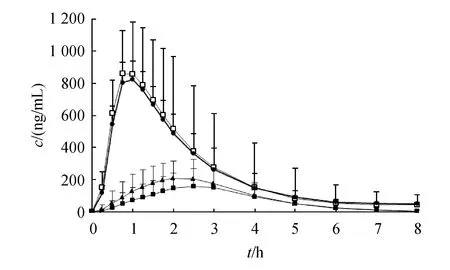
40名健康受试者空腹和餐后口服受试制剂和参比制剂后,阿莫西林和克拉维酸的血药浓度-时间曲线见图3和图4。
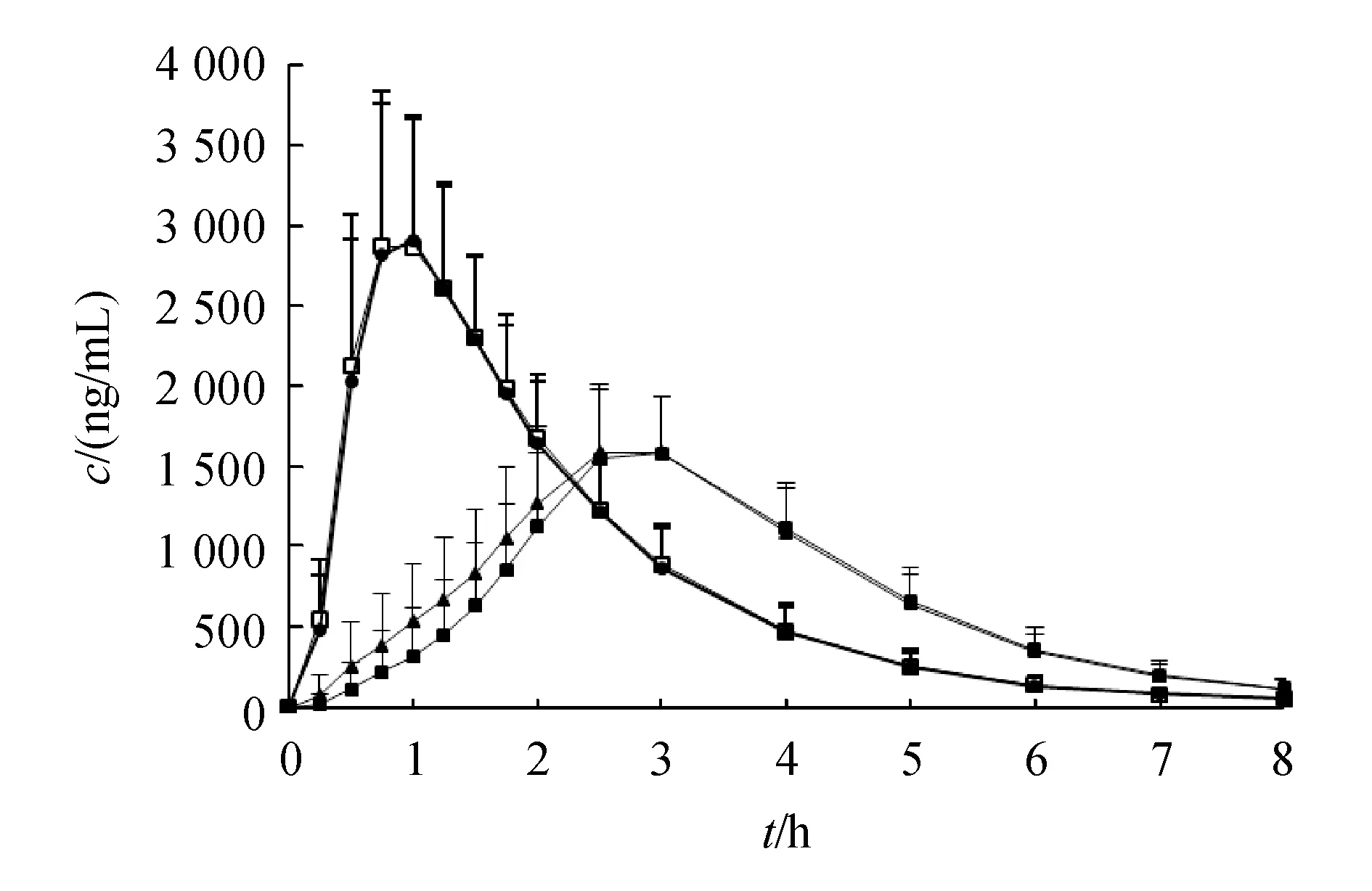
R:Reference;T:Test product
采用WinNonlin 6.4 软件计算参比制剂的主要药代动力学参数 AUC0-t、AUC0-∞、cmax的个体内标准差SWR。SWR与CVW%存在以下换算关系:
若SWR≥0.294,即CVW%≥30%,采用RSABE方法进行等效性评价(应用于AUC、cmax两者之中任意一个或全部采用)。若SWR<0.294,即CVW%<30%,则采用ABE方法评价生物等效性。结果显示,空腹阿莫西林和克拉维酸的个体内变异系数均小于30%,而餐后阿莫西林个体内变异系数小于30%,克拉维酸的个体内变异系数均大于30%。因此空腹阿莫西林和克拉维酸、餐后阿莫西林采用ABE方法进行等效性评价,而餐后状态下克拉维酸采用RSABE方法进行等效性评价。主要药代动力学参数AUC0-t、AUC0-∞、cmax结果分别见表4和表5。
4 讨 论
4.1 流动相的选择
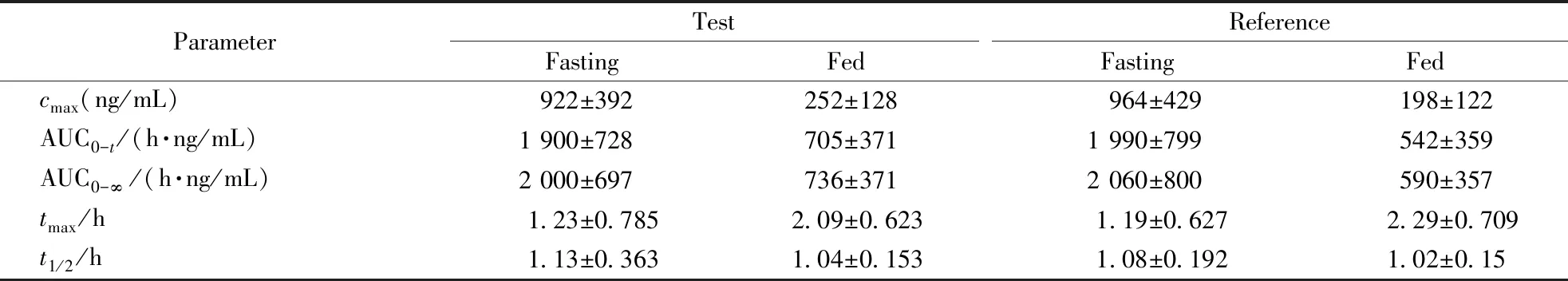
采用LC-MS/MS负离子模式检测含羧基等基团的的酸性物质时,可调低水相的pH,使流动相保持微弱的酸性,这样可提高化合物的离子化效率。实验中分别比较了水相中加入0.2%乙酸、0.2%乙酸和1 mmol/L醋酸铵、0.2%甲酸条件下阿莫西林和克拉维酸的峰形、保留及响应,见图5及图6。发现加乙酸后阿莫西林和克拉维酸钾响应增大,保留时间延长,加入醋酸铵后阿莫西林和克拉维酸响应降低,保留减弱;换用甲酸后,阿莫西林和克拉维酸保留时间提前,克拉维酸的峰形差,最终选择在水相中加入0.2%乙酸。
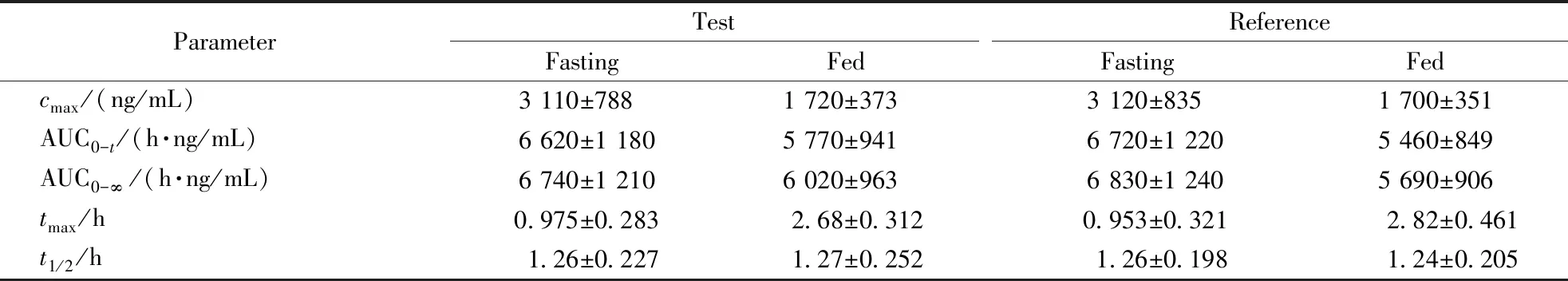
ParameterTestFastingFedReferenceFastingFedcmax/(ng/mL)3 110±7881 720±3733 120±8351 700±351AUC0-t/(h·ng/mL)6 620±1 1805 770±9416 720±1 2205 460±849AUC0-∞/(h·ng/mL)6 740±1 2106 020±9636 830±1 2405 690±906tmax/h0.975±0.2832.68±0.3120.953±0.3212.82±0.461t1/2/h1.26±0.2271.27±0.2521.26±0.1981.24±0.205
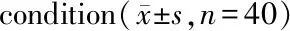
ParameterTestFastingFedReferenceFastingFedcmax(ng/mL)922±392252±128964±429198±122AUC0-t/(h·ng/mL)1 900±728705±3711 990±799542±359AUC0-∞/(h·ng/mL)2 000±697736±3712 060±800590±357tmax/h1.23±0.7852.09±0.6231.19±0.6272.29±0.709t1/2/h1.13±0.3631.04±0.1531.08± 0.1921.02±0.15
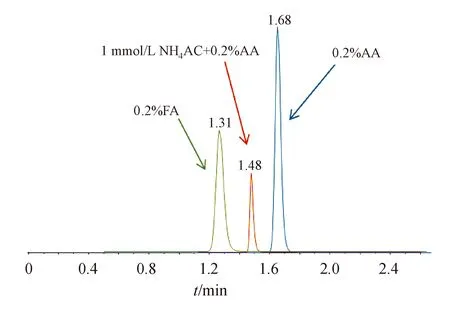
Figure 5 Chromatogram of amoxicillin on different conditions of Hedera ODS-2 column
AA:Acetic acid;FA:Formic acid
Figure 6 Chromatogram of clavulanic acid on different conditions of Hedera ODS-2 column
4.2 阿莫西林和克拉维酸在血浆中的不稳定性及其解决方法
阿莫西林和克拉维酸结构中含有β-内酰胺环,β-内酰胺环不稳定,在酸、碱、水分子、分子内亲核基团的进攻下极易发生开环[10]。阿莫西林结构中含有酸性的羧基和碱性的氨基,调节合适的pH会使测定成分保持更稳定的状态。常温下克拉维酸在血浆中不稳定,其降解原因与水分、温度、溶质及pH有关[1]。
针对阿莫西和克拉维酸不稳定的问题,本试验中分别考察了室温和冰浴条件下阿莫西林和克拉维酸的低、高两个浓度下在不含酸血浆、含0.5%乙酸的血浆、含1.0%乙酸的血浆和含2.0%乙酸的血浆中的稳定性。结果表明,血浆中不加酸,加酸过多,阿莫西林和克拉维酸的含量均会下降。克拉维酸的血浆样品在室温下稳定较差,在冰浴含0.5%乙酸的血浆中稳定性最好,所以最终确定样品的前处理条件为:在冰浴条件下,采用50%乙酸水溶液作为稳定剂(血浆与50%乙酸水溶液体积比为100∶1),测定血浆中阿莫西林和克拉维酸含量。
4.3 药代动力学参数比较
据文献报道,饮食可通过延迟胃排空、刺激胆汁分泌、改变胃肠道pH、增加内脏的血流量、改变药物的代谢和与制剂或药物发生物理和化学反应等改变药物的生物利用度,影响其吸收,造成达峰时间延迟或提前,增加或减少药物的暴露量,也有可能对药物的吸收速度和程度有明显影响[2]。
试验结果表明,两复方制剂在空腹试验下等效。与空腹相比,高脂餐后阿莫西林和克拉维酸生物利用度均有所降低,降低幅度约为15%;阿莫西林和克拉维酸的cmax分别降低约50%和75%;阿莫西林和克拉维酸tmax均延迟约1 h;同样的饮食对受试制剂与参比制剂的药代动力学参数cmax、AUC0-t和AUC0-∞影响存在差异。
Augmentin®说明书显示,食物不影响本试验药物的吸收。Staniforth等[13]采用18例受试者进行双交叉自身对照试验,发现食物确实不影响本试验药物的吸收,但当受试者例数增加至45人进行重复交叉试验时,食物降低了试验药物的吸收;周莹等[4]对阿莫西林/克拉维酸钾缓释片(16∶1)进行空腹、餐前和餐后3种给药方式的研究也发现餐后克拉维酸的生物利用度明显降低,空腹阿莫西林的生物利用度略低。本研究也得到与以上文献相似的试验结论,推测餐后试验下不等效的可能原因有:餐后饮食食物的差异、样本量差异、人种的差异、给药剂量差异(本试验受试者服用的阿莫西林/克拉维酸剂量为125 mg/31.25 mg,文献中无该剂量的饮食影响相关的报道)等。
5 结 论
本试验建立了一种同时测定人血浆中阿莫西林和克拉维酸浓度的LC-MS/MS方法,该方法前处理便捷,灵敏度高,定量下限可分别低至20.0和10.0 ng/mL,检测时间短,可在4 min完成对阿莫西林和克拉维酸的同时检测。该方法首次应用于阿莫西林克拉维酸颗粒(125 mg/31.25 mg)在中国受试者体内的血药浓度测定,并通过计算比较受试者空腹和餐后服用受试制剂阿莫西林克拉维酸钾颗粒1袋(125 mg/31.25 mg)和参比制剂阿莫西林克拉维酸钾干混悬剂Augmentin®5 mL(125 mg/31.25 mg/5 mL)的药代动力学参数,对两复方制剂进行生物等效性评价,评估饮食对阿莫西林克拉维酸药代动力学的影响,为临床用药提供参考。试验结果说明两复方制剂在空腹试验下等效,在餐后试验下不等效。餐后服用受试制剂与参比制剂后,阿莫西林和克拉维酸的AUC0-t和AUC0-∞在给药制剂间差异均有统计学意义(P<0.05),说明餐后两复方制剂不等效可能与制剂因素有关;与此同时,与空腹相比,餐后受试制剂和参比制剂cmax、AUC0-t和AUC0-∞降低幅度不一致,说明了食物也会对药物的药代动力学参数产生影响。

