不同亚型乳腺导管原位癌与X线摄影和临床病理特征的相关性研究
荣小翠,康一鹤,吴勇超,武中林,赵俊京
(河北医科大学第四医院放射科,石家庄 050011)
乳腺导管原位癌(ductal carcinoma in situ,DCIS)是肿瘤性上皮细胞局限于乳腺导管内,未突破基底膜的一组异质性病变。近年来,随着筛查乳腺X线摄影的广泛应用,DCIS的检出率明显提高,占所有乳腺癌的20%~30%[1]。DCIS具有发展为浸润性乳腺癌的趋势,因此DCIS的早期诊断及治疗对于预防浸润性乳腺癌的发生至关重要。许多研究表明,乳腺癌分子亚型与浸润性乳腺癌的生物学特征相关,而且不同分子亚型对于局部或系统性治疗的反应存在明显的不同[2]。有关DCIS X线摄影表现与分子亚型关系的文献罕见。本研究旨在探讨不同亚型DCIS与X线摄影表现及临床病理特征的相关性,为临床选择合理的治疗方式及预后预测提供依据。
1 资料与方法
1.1一般资料 选取2015年2月至2016年9月经本院手术病理证实的DCIS患者79例(不包括DCIS伴微浸润)为研究对象,均为女性,年龄26~75岁,平均(49.5±10.9)岁,术前均进行乳腺X线摄影。临床表现:体检发现10例,乳头溢液18例,乳头糜烂或破溃4例,乳腺肿物47例。
1.2方法
1.2.1X线摄影检查 采用德国 Siemens Mammomat Novation DR全野数字化乳腺X线摄影机。常规头尾位(CC)、内外斜位(MLO)摄片,必要时加照侧位(ML)。由两名高年资医师应用美国放射学会(ACR)制定的乳腺影像报告数据系统(BI-RADS)对乳腺癌X线摄影表现进行规范化的描述分析[3]。
1.2.2病理学检查 采用免疫组织化学法(IHC)检测ER、PR、HER-2、Ki-67的表达。根据2015版中国ER、PR检测指南[4]:当大于或等于1%的肿瘤细胞核呈现不同程度的着色时,即为阳性。HER-2的判定标准参照2014版中国HER-2检测指南[5]:IHC 3+为HER-2+,IHC 0和1+为HER-2-;IHC 2+为HER-2不确定病例,进一步行FISH检测,比值大于2.0视为阳性。Ki-67以细胞核棕黄色为阳性,Ki-67阳性指数=(总Ki-67阳性肿瘤细胞数/肿瘤细胞总数)×100%,≥15%为高表达,<15%为低表达[6]。组织学分级以肿瘤细胞的核级别为基础,参考肿瘤细胞的坏死和极化现象,将DCIS分为低、中、高3个等级。根据免疫组织化学结果将DCIS分为以下3型[2,7-8]:(1)ER阳性型(HER-2-,PR任何水平);(2)HER-2阳性型(ER、PR任何水平);(3)三阴性型(ER-、PR-、HER-2-)。

2 结 果
2.1基本情况 79例单纯DCIS患者中ER阳性型44例(55.7%),HER-2阳性型32例(40.5%),三阴性型3例(3.8%)。32例HER-2阳性型中ER阳性14例,ER阴性18例。X线病变类型:单纯微钙化38例(48.1%),肿块、致密影或结构扭曲17例(21.5%),肿块、致密影或结构扭曲伴钙化24例(30.4%)。
2.2DCIS分子亚型与临床病理特征的关系 ER阳性型、HER-2阳性型、三阴性型患者的年龄差异无统计学意义(P>0.05)。HER-2阳性型、三阴性型患者高核级、Ki-67高表达比ER阳性型更常见(P<0.05),见表1。

表1 DCIS不同分子亚型与临床病理特征的关系

表2 DCIS不同分子亚型与X线摄影特征的关系[n(%)]
*:Fisher精确概率法

图1 典型病例
2.3DCIS分子亚型与X线摄影特征的关系 不同分子亚型间X线病变类型无明显差异(P=0.064)。 HER-2阳性型、ER阳性型及三阴性型X线摄影伴有钙化者分别为90.6%、72.7%、33.3%(P=0.026)。钙化形态在不同分子亚型间存在差异(P=0.026),HER-2阳性型以线样或线样分支状钙化为主。钙化分布在不同亚型间无明显差异(P=0.272)。不同亚型间,腺体密度均以不均匀致密型或极度致密型多见(P=1.000),见表2。典型病例:女性,61岁,右乳血性溢液5 d,X线摄影示右乳外上象限可见区域分布线样或线样分支状微钙化影,见图1。手术病理证实为高核级DCIS,免疫组织化学为ER+、PR-、HER-2 3+,分子亚型为HER-2阳性型。
2.4钙化与非钙化型DCIS与临床病理特征的关系 伴钙化DCIS其HER-2+及Ki-67高表达更为常见(P=0.030、0.016),而在组织学分级、ER、PR表达上无明显差别(P>0.05),见表3。

表3 钙化与非钙化DCIS与临床病理特征的关系[n(%)]
2.5影响DCIS组织学分级的单因素及多因素分析 X线病变类型、是否伴有钙化、钙化形态及分布、肿瘤直径在不同核分级中无明显差别,见表4。多变量Logistic回归显示:HER-2阳性型、三阴性型及Ki-67高表达更多表现为高核级(P<0.05),见表5。
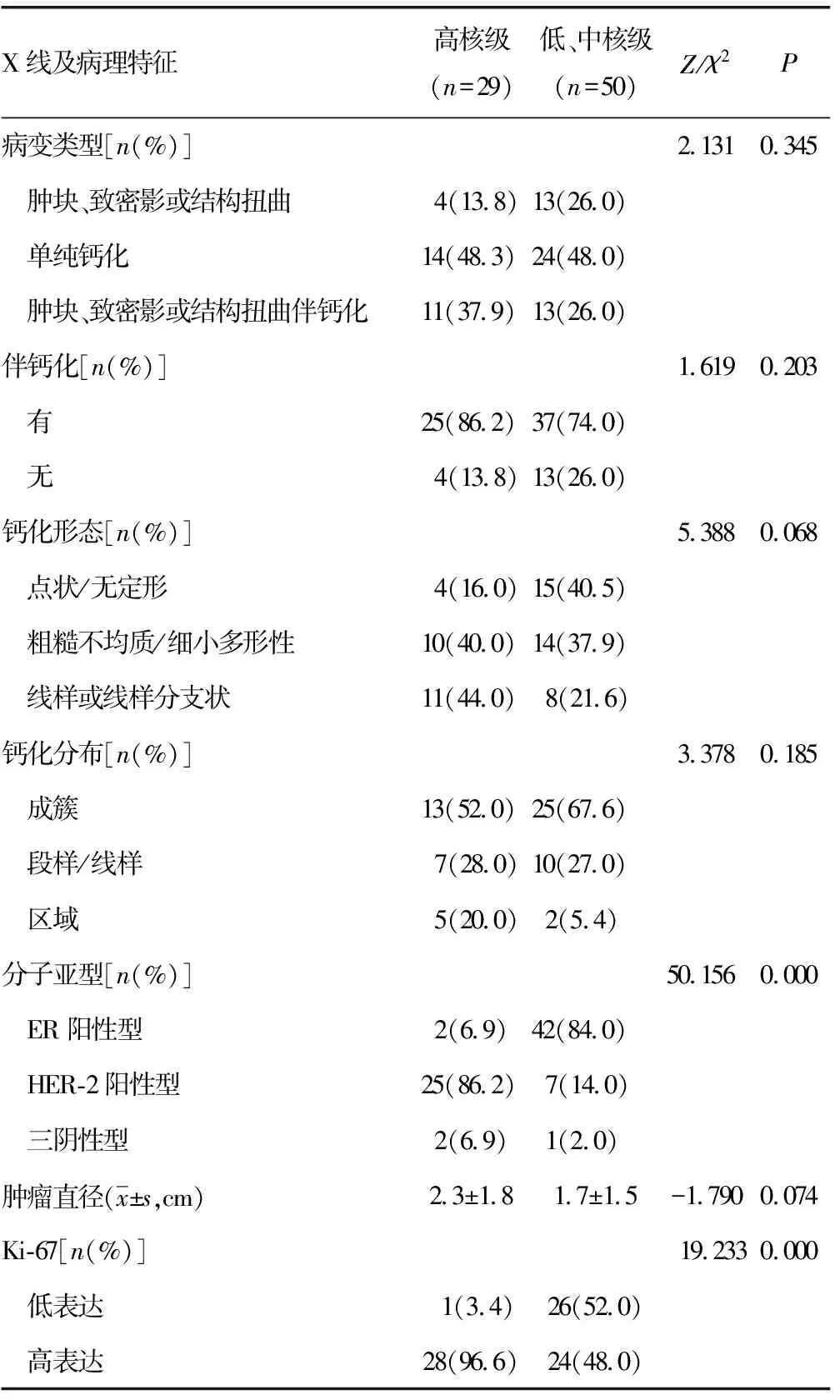
表4 影响DCIS组织学分级的单因素分析

表5 影响DCIS组织学分级的多因素分析
3 讨 论
DCIS作为一种非浸润性癌,早期发现、早治疗是防治其进展、提高预后的关键。乳腺X线摄影因其操作简单、对微钙化敏感性高等优点,成为目前检出DCIS的重要检查方法。本研究结果显示,HER-2阳性型X线摄影比ER阳性型及三阴性型更易表现为伴有钙化,尤其是线样或线样分支状钙化,与文献报道一致[2,7,9]。钙化的分布在不同亚型间无明显差别,而BAE等[7]的研究结果显示HER-2+乳腺癌更易表现为段样分布微钙化,与本研究结果不一致,考虑可能与选择患者不同有关,这有待于提高样本量进一步证实。
本研究中DCIS最常见的X线病变类型为单纯钙化(48.1%),与文献报道一致[10]。伴有钙化的DCIS更多表现为HER-2+及Ki-67高表达,而不伴钙化的DCIS多为HER-2-及Ki-67低表达,这提示伴有钙化的DCIS侵袭性更强,与MUN等[11]的研究结果一致。
DCIS患者术前准确预测病变复发风险,对于治疗方案的合理选择至关重要,从而使乳腺癌患者受益。WANG等[12]研究显示,HER-2+、ER-、PR-、粉刺样坏死、高核级、大的肿瘤、多中心、阳性手术切缘及阳性症状体征都是DCIS治疗后局部复发的重要预测因素,其研究发现HER-2阳性状态预测复发风险的优势比是3.07,是所有预测因素中最高的。HER-2阳性表达与高增殖指数相关。RAUCH等[1]研究显示,致密型乳腺、大的肿瘤及分支状微钙化与高的局部复发率相关。乳腺癌恶性程度与Ki-67密切相关,Ki-67越高,恶性程度越高[13]。本研究中HER-2阳性型、三阴性型更多表现为高核级、Ki-67高表达(即高增殖指数),说明HER-2阳性型、三阴性型的侵袭性及局部复发率更高。
文献报道高核级DCIS具有较高的浸润趋势,病变广泛切除后仍有较高的复发率,且术后复发时间明显短于非高核级者[14]。本研究关于影响DCIS组织学分级的多因素分析结果显示,高核级多为HER-2阳性型、三阴性型及Ki-67高表达,这与本研究结果中HER-2阳性型、三阴性型更多表现为高核级、Ki-67高表达相一致。
本研究的局限性:(1)研究为回顾性研究,可能存在选择偏倚;(2)每个乳腺癌亚型的患者数相对较少,尤其是三阴性型,因为此类患者不常见;(3)对于DCIS的组织病理学分析,没有考虑粉刺样坏死的影响,今后可进行相关研究。
综上所述,在分子分型上,DCIS患者大部分为ER阳性型及HER-2阳性型,三阴性型较少见。ER阳性型一般为低、中核级,而HER-2阳性型、三阴性型大多数为高核级, Ki-67呈高表达,预示其预后较差,发展为浸润性癌的风险及局部复发率较高。HER-2阳性型乳腺癌与乳腺X线摄影钙化明显相关,形态上多表现为线样或线样分支状钙化。

