青钱柳活性成分对IR-HepG2细胞葡萄糖消耗量及α-葡萄糖苷酶活性的影响
王胤康,吕 萌,许 琦,陈伟鸿,谭开祥,向极钎,刘 卫*
(1.华中科技大学 生命科学与技术学院,湖北 武汉 430074;2.武汉百思凯瑞纳米科技有限公司,湖北 武汉430075;3.无限极(中国)有限公司,广东 广州 510665;4.湖北思慧生物科技有限公司,湖北 恩施 445099;5.恩施州农业科学院,湖北 恩施445099)
青钱柳,俗称摇钱树,系胡桃科青钱柳属植物,是我国特有的单种属植物,分布于湖北、湖南、江西、贵州等地山区,长期以来民间取其叶制茶,饮之味甜兼有清热解暑、降血压、降血糖等保健功效[1]。青钱柳作为我国特有的保健食品资源,具有很高的应用开发价值[2]。近年来研究表明,青钱柳叶含有多种生物活性物质,如黄酮、多糖、皂苷、三萜类、蛋白质、微量元素和酚类物质等[3],其水提物和醇提物具有显著的降血糖效果[4-8],但少有文献探讨青钱柳活性成分降血糖机制。
肝细胞是糖代谢作用的靶细胞之一,是摄取、储存和合成葡萄糖的主要场所,在维持血糖稳定的过程中发挥着最直接和最重要的作用[9]。HepG2细胞是一种表型与肝细胞极为相似的人源肝癌细胞,具有肝细胞的形态和功能,且易于体外培养,同时HepG2细胞还具有表达胰岛素样生长因子和胰岛素受体的代谢反应。在高浓度的胰岛素作用下,HepG2细胞表面胰岛素受体数量下降,其下降程度与胰岛素浓度及刺激持续的时间呈正相关[10]。因此HepG2细胞是体外研究胰岛素抵抗发病机制和降糖药物作用机制的理想细胞模型[11]。α-葡萄糖苷酶是水解食物中多糖及二糖的常见酶,主要分布在小肠上。α-葡萄糖苷酶抑制剂可以抑制位于小肠内的α-葡萄糖苷酶,使淀粉类多糖分解为葡萄糖的速率下降,延缓对葡萄糖的吸收,进而降低餐后血糖升高速度,长期使用后亦可降低空腹血糖[12]。
为了从体外葡萄糖摄入量控制,以及体内葡萄糖糖消耗两方面来探讨青钱柳活性成分降血糖机制,本研究采用高糖高胰岛素培养基诱导培养胰岛素抵抗HepG2细胞(IR-HepG2),观察水提活性成分青钱柳多糖 (CPP)和醇提活性成分青钱柳黄酮(CPF)对IR-HepG2细胞葡萄糖消耗量的影响,同时在体外进行α-葡萄糖苷酶活力抑制实验,以探讨青钱柳活性成分降血糖机制,为青钱柳降血糖保健食品的研发提供科学依据。
1 材料与方法
1.1 实验材料与试剂
青钱柳叶,采自湖北恩施思慧生物科技有限公司青钱柳苗圃基地;CPP与CPF由本实验室参照文献提取制备。
HepG2细胞,由武汉大学中国典型培养物保藏中心提供。
盐酸二甲双胍肠溶片 (生产批号:20150475),购自贵州天安药业股份有限公司;葡萄糖试剂盒,购自上海名典生物技术有限公司;DMEM高糖培养基,购自 HyClone公司;四甲基偶氮唑盐(MTT),购自Sigma公司;牛胰岛素,购自Sigma公司;无酚红DMEM高糖培养基,购自吉诺生物有限公司;阿卡波糖,购自拜耳医药保健有限公司;α-葡萄糖苷酶(S10049),购自上海源叶生物有限公司。
1.2 主要仪器设备
MQX200型酶标仪,美国伯腾公司;CKX41倒置显微镜,日本Olympus公司;3100型CO2细胞培养箱,美国Thermo Forma公司;WCD2S-03型微波萃取设备,南京三乐微波技术发展有限公司。
1.3 实验方法
1.3.1 CPP的提取和纯化参照文献 [13]加以改进。青钱柳叶经过石油醚脱脂脱色后,进行提取,过滤,将所得滤液浓缩、醇沉、脱蛋白、干燥,得到棕红色粗多糖。粗多糖复溶后,进行透析、氧化镁脱色、过滤并真空干燥,即得淡黄色精制CPP,经硫酸蒽酮法[14]检测多糖含量为66.3%。
1.3.2 CPF的提取和纯化参照文献[15]。青钱柳叶粉末(过40目筛)干燥后,经微波萃取、过滤浓缩、喷雾干燥,得粉状粗制品。将粗制品复溶,过聚酰胺吸附柱,控制流速2.5 mL/min,过柱完成后,用60%乙醇洗脱,合并洗脱液,减压浓缩并真空干燥。将真空干燥所得物再过2次聚酰胺柱,即得精制CPF,经亚硝酸钠-硝酸铝-氢氧化钠比色法[16]检测,黄酮含量为80.5%。
1.3.3 CPF、CPP对IR-HepG2细胞葡萄糖摄取量的影响参照文献[17-18]。取活化后的HepG2细胞,用DMEM全培养基(含10%胎牛血清和1%双抗)培养至80%细胞贴壁后,改用含10 μg/mL胰岛素的DMEM全培养基培养,24 h后用无血清无酚红DMEM高糖培养基继续培养12 h,使细胞同步化,即得IR-HepG2细胞。
用胰蛋白酶消化IR-HepG2细胞,1 500 r/min离心5 min去上清,加入无血清无酚红DMEM高糖培养基使其均匀悬浮,通过细胞计数仪计数并控制细胞浓度为105个/mL。实验分为空白组、阴性对照组、模型组、二甲双胍组(终质量分数1.0 mg/mL)、CPF与CPP低、中、高剂量组(终质量浓度依次为0.01、0.1、1.0 mg/mL)。 取 96 孔细胞培养板点板,空白组每孔加入200 μL无血清无酚红的DMEM高糖培养基,阴性对照组每孔加入200 μL正常HepG2细胞培养液,模型组每孔加入200 μL IR-HepG2细胞培养液,实验组除每孔加入200 μL IR-HepG2细胞培养液外,还加入相应受试样品。每组设置6个复孔,加药孵育24 h后,以葡萄糖氧化酶法检测上清液中的葡萄糖含量。以未接种细胞的空白组葡萄糖含量均值减去测得的培养液中葡萄糖含量,即得各孔细胞的葡萄糖消耗量。孵育结束后,每孔加入20 μL MTT 原液(5 mg/mL),继续培养 4 h,终止培养后,吸弃上清液,每孔加入150 μL二甲基亚砜终止反应,微型震荡器震荡10 min至紫色结晶溶解,用酶标仪于490 nm波长下检测各孔的光密度(OD)值,以光密度值反映细胞活性和数量的多少。
1.3.4 CPF与CPP对α-葡萄糖苷酶活力的影响参照文献[19-20],加以改进。实验分为空白组、阴性对照组 (不加抑制剂)、阳性对照组 (终质量浓度1.00 mg/mL阿卡波糖)、不同质量分数梯度的CPF与 CPP组 (终质量浓度依次为 0.13、0.25、0.50、1.00、2.00、4.00 mg/mL)。 以 100 mg/mL 蔗糖溶液为底物,0.2 mol/L HAc-NaAc(pH 5.2)为缓冲液,所有试剂事先均于55℃预热10 min,然后于1.5 mL EP管中,按照表1依次加入各试剂,55℃温育60 min。温育结束后,95℃水浴5 min终止反应,取3 μL反应液,分别加入450 μL葡萄糖工作液中,37℃水浴10 min后,492 nm波长处测定OD值,并计算抑制率。
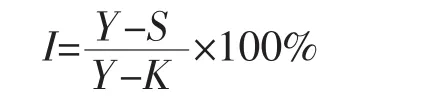
式中:I表示抑制率;Y表示阴性对照组OD值;S表示待测样品组OD值;K表示空白组OD值。
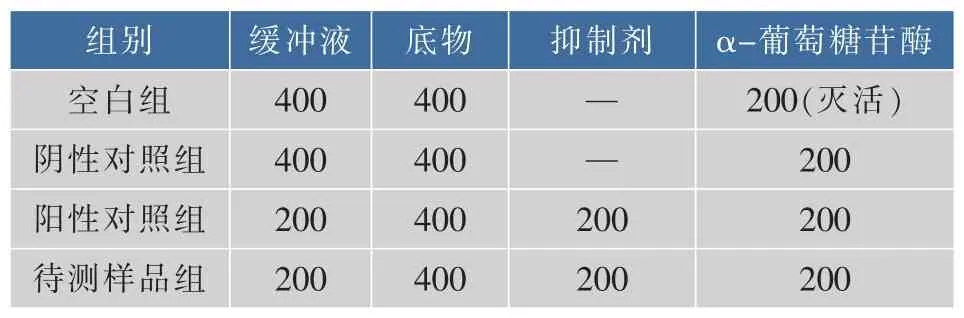
表1 实验分组所加试剂Table 1 Reagents in each experimental group μL
1.4 数据分析
实验结果均以平均值±标准偏差 (x±s)形式表示,采用SPSS 19.0统计学软件进行分析,p<0.05为差异显著,具有统计学意义。
2 结果与分析
由表2可知,与阴性对照组比较,模型组ΔGC与ΔGC/OD显著性降低,差异有统计学意义(p<0.05或p<0.01),说明IR-HepG2细胞模型造模成功;与阴性对照组比较,二甲双胍组、CPF低、中、高剂量组、CPP中、高剂量组 ΔGC显著性增加(p<0.01或p<0.05), 增率分别为 269.75%、40.12%、71.60%、125.31%、74.07%、94.44%;与阴性对照组比较,二甲双胍组、CPF高剂量组、CPP中、高剂量组ΔGC/OD显著性增加 (p<0.01),增率分别为 415.47%、102.68%、89.29%、110.12%;与模型组比较,二甲双胍组、CPF低、中、高剂量组和CPP低、中、高剂量组GC明显上升 (p<0.01),增率分别为 621.69%、173.49% 、234.94% 、339.76% 、96.39% 、239.76% 、279.52%;与模型组比较,二甲双胍组、CPF低、中、高剂量、CPP中、高剂量组ΔGC/OD显著性增加(p<0.01), 增率分别为 906.98%、137.21%、163.37%、295.93%、269.77%、310.47%。实验结果表明,青钱柳活性成分 (CPF、CPP)能够改善胰岛素抵抗,增加IR-HepG2细胞葡萄糖消耗量,且优于正常HepG2细胞,其降血糖活性机制也可能与此有关。
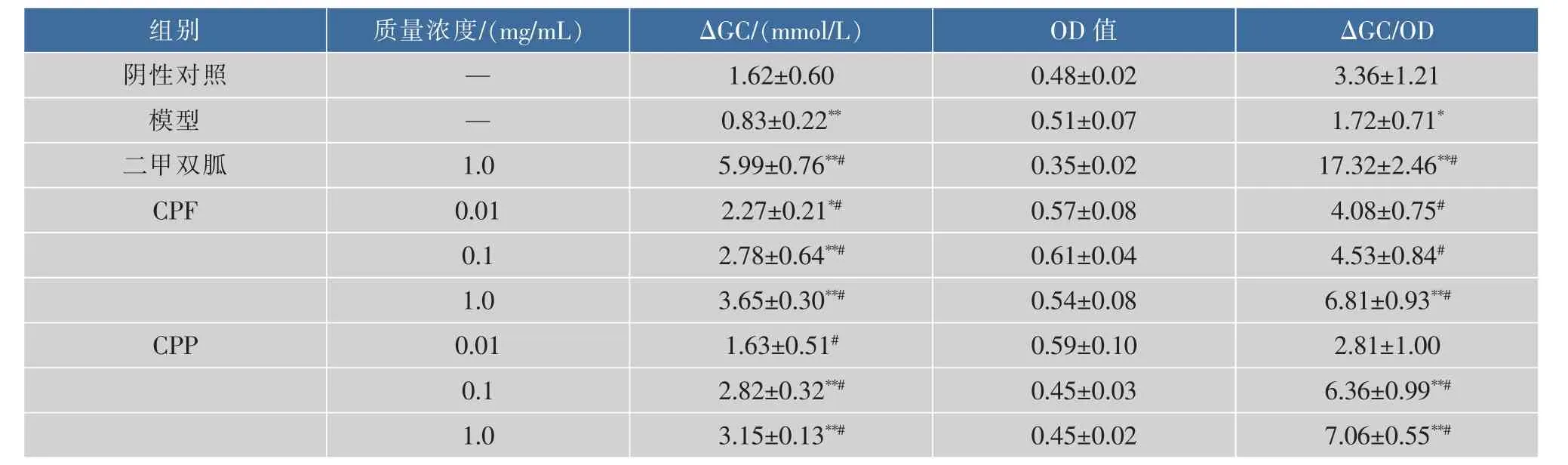
表2 CPF与CPP对IR-HepG2细胞葡萄糖消耗量的影响(x±s,n=6)Table 2 Effect of CPFs and CPPs on Glucose Consumption of IR-HepG2 Cell(x±s,n=6)
以各组OD值与阴性对照组OD值的比值来反应细胞存活率,计阴性对照组细胞平均存活率为100.00%,那么模型组细胞平均存活率为106.25%,二甲双胍组细胞平均存活率为72.92%,CPF低、中、高剂量组细胞平均存活率分别为118.75%、127.08%、112.50%,CPP低、中、高剂量组细胞平均存活率分别为122.92%、93.75%、93.75%。由此可知,与阴性对照组比较,模型组,CPF低、中、高剂量组,CPP低、中、高剂量组细胞生长状态良好存活率高,而二甲双胍组细胞存活率较低,细胞生长状态较差(见图 1)。

图1 实验条件下细胞生长状态Fig.1 Cell growth state under experimental conditions
由表3可知,阿卡波糖、CPF与CPP均能抑制α-葡萄糖苷酶活性,其中CPF对α-葡萄糖苷酶的抑制作用随着质量浓度升高呈正效应,这与文献[21]一致,当CPF质量浓度为4.00 mg/mL时抑制率最高达86.00%,而CPP对α-葡萄糖苷酶的抑制作用随浓度变化不大。与阿卡波糖(1.00 mg/mL)比较,CPF(0.13、0.25、0.50、1.00 mg/mL)、CPP (0.13、0.50、1.00、2.00、4.00 mg/mL) 对 α-葡萄糖苷酶的抑制率均显著性低于阿卡波糖(p<0.05或p<0.01),而 CPF(4.00 mg/mL)对α-葡萄糖苷酶的抑制率显著性高于阿卡波糖(p<0.01),表明以蔗糖为底物时,同等质量分数的CPF与CPP对α-葡萄糖苷酶的抑制效果不如阿卡波糖,这与刘杰等人以4-硝基酚-α-D-吡喃葡萄糖苷(PNPG)为底物所进行的研究有所不同[12],这可能与反应条件以及α-葡萄糖苷酶对蔗糖与PNPG的亲和力不同有关。
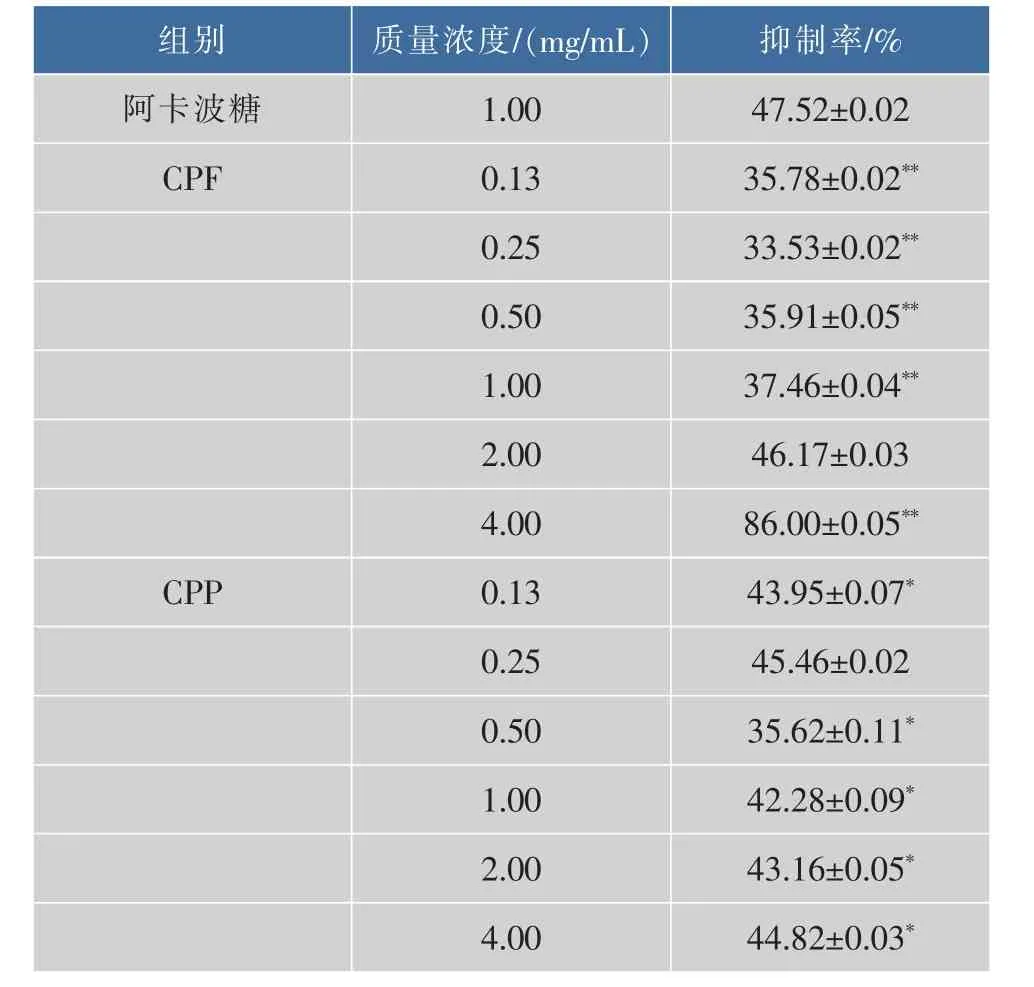
表3 CPF与CPP对α-葡萄糖苷酶的抑制作用(x±s,n=6)Table 3 Inhibition of CPF and CPP on alpha-glucosidase(x±s,n=6)
3 讨论
葡萄糖是血糖主要来源,而葡萄糖的转运活动是由葡萄糖转运蛋白(GLUTs)介导完成的。GLUT4为一种跨膜转运蛋白,是葡萄糖转运蛋白家族中最主要的葡萄糖运载体,存在于胰岛素敏感的脂肪组织、心肌组织和骨骼肌组织中[22]。青钱柳提取物能够显著提高受试大鼠肝脏细胞GLUT4 mRNA表达量,进而增加细胞对葡萄糖的消耗[23]。提示CPF可能发挥着信使分子的作用,促进IR-HepG2细胞GLUT4 mRNA表达,进而提高葡萄糖消耗量。参照文献 [24],CPF还有可能通过激活AMPK磷酸化过程,来调节IR-HepG2细胞的糖代谢。根据文献[25],CPP提高IR-HepG2细胞葡萄糖消耗量的机理可能是通过活化Akt蛋白激酶介导的磷酸化过程,抑制GSK-3活性,阻止糖原合成酶被GSK-3磷酸化,进而刺激糖原的合成,同时被激活的Akt蛋白激酶又可以促进糖酵解过程,进一步促进细胞对葡萄糖的消耗。
食物中的淀粉类多糖,经糖苷酶水解成小分子单糖后,才能被机体吸收转化为血糖。青钱柳主要活性成分为黄酮、多糖等,通过α-葡萄糖苷酶活性抑制实验发现,CPF与CPP能够明显的抑制α-葡萄糖苷酶活性,说明CPF与CPP口服进入机体内后,可能通过抑制位于小肠上的α-葡萄糖苷酶酶活性,使淀粉类多糖分解为葡萄糖的速度减慢,从而减缓肠道内葡萄糖的吸收,降低餐后血糖,改善机体对葡萄糖的耐受量。
4 结语
CPF与CPP能够改善胰岛素抵抗,提高IRHepG2细胞葡萄糖摄取量,抑制α-葡萄糖苷酶活性。本研究结果提示青钱柳提取物降血糖机制可能与CPF、CPP能够增加外周细胞葡萄糖消耗量,抑制α-葡萄糖苷酶活性,延缓餐后血糖升高有关。

