基于表面增强拉曼光谱的鸭肉中己烯雌酚残留检测
陶进江 潘桂根,2 刘木华 袁海超 赵进辉
(1. 江西农业大学工学院生物光电及应用重点实验室,江西 南昌 330045;2. 江西工业贸易职业技术学院,江西 南昌 330038)
己烯雌酚(DES)是一种雌性激素,如儿童食用含有DES的食品可导致性早熟,骨骺线提前闭合,身高提前停止生长[1]。然而近些年来关于鸭肉中激素超标的新闻屡屡出现。为了促进鸭的快速生长,养殖户常在饲料中添加DES而造成鸭肉中的DES残留超标。采用气相色谱质谱联用(GC-MS)和液相色谱质谱联用(LC-MS)等方法检测DES不仅速度慢而且检测设备贵。因此,建立DES在鸭肉中残留的快速检测方法十分重要。
表面增强拉曼光谱(SERS)技术是在普通拉曼光谱法的基础上,结合表面增强技术而研发出来的一种新技术, 由于具有稳定性强、受水与荧光干扰小、方便快捷等特点,已成为了一种高效实用的快速检测分析工具,并在许多领域获得了广泛的应用[2-3]。马海宽等[4]利用SERS和静电富集相结合的技术,实现了快速痕量探测水环境中环丙沙星、恩诺沙星、丁胺卡那霉素和磺胺甲基嘧啶。马君等[5]以银溶胶膜为基底对3种抗生素(氯霉素、环丙沙星、恩诺沙星)进行了SERS检测研究。修梓侨等[6]利用拉曼光谱分析法可以快速准确地检测出乙烯雌酚、甲状腺素和地塞米松3种激素。本课题组在前期研究[7-9]中对鸭肉中的环丙沙星、萘夫西林、土霉素等抗生素残留进行了拉曼光谱检测的定性和定量分析,由于检测的抗生素对象不同,且构成的检测体系也不一样,导致检测不同抗生素的拉曼光谱检测的最优条件也不一样,因此,有必要对检测鸭肉中DES残留的拉曼光谱检测最优条件(柠檬酸三钠、纳米金胶、含DES的鸭肉提取液、硫酸镁溶液的加入量以及拉曼光谱的采集时间)进行优化。目前还未见有关基于SERS技术的鸭肉中DES残留快速检测的研究报道。基于此,本研究拟探索鸭肉中DES残留的SERS快速检测的可行性,为鸭肉中的激素残留检测提供技术支持。
1 材料与方法
1.1 材料与试剂
麻鸭:江西农业大学农贸市场;
DES标准品:纯度约99%,南昌精科科学仪器有限公司;
三水合氯金酸:金含量≥49.0%,西格玛奥德里奇(上海)贸易有限公司;
二水合柠檬酸三钠、乙腈、无水甲醇、硫酸镁、正己烷等:分析纯,南昌精科科学仪器有限公司。
1.2 仪器设备
便携式拉曼光谱检测系统:包括QE 65000型拉曼光谱仪、785 nm 激光器、光纤和采样附件等,美国海洋光学公司;
纯水机:全自动RO型,美国Teledyne公司;
高速组织匀浆机:DS-1型,上海标本模型厂;
电子天平:FA1004B型,上海上平仪器有限公司;
超声波清洗器:JK-50B型,金尼克机械有限公司;
漩涡震荡器:VORTEX-5型,其林贝尔仪器有限公司;
万用电炉:单联型,北京科伟永兴仪器有限公司;
低速离心机:JW-1024型,嘉文仪器装备有限公司;
石英进样瓶:直径11.5 mm,高30 mm,北京瑞盛博源科技发展有限公司;
氮吹仪:HSC-24B型,恒奥科技发展有限公司。
1.3 试验方法
1.3.1 纳米金胶的制备 取0.01% 氯金酸100 mL加入到150 mL烧杯中,放至万用电磁炉上加热至沸腾后,迅速加入一定量(0.6,0.8,0.9,1.0,1.2 mL)1%柠檬酸三钠溶液,并不停搅拌9 min,冷却至室温后备用,共制得5种不同粒径的纳米金胶[10]。
1.3.2 DES标准溶液的配制 称取约10 mg DES标准品,先用少量无水甲醇溶解,待超声后,冷却至室温,再用无水甲醇定容至100 mL棕色容量瓶刻度线,即可得到100 mg/L的标准溶液。再将其用无水甲醇稀释成一系列浓度DES标准品样本溶液备用。
1.3.3 硫酸镁溶液的制备 取1.204 g无水硫酸镁至烧杯中,加入 100 mL的超纯水,待充分溶解后转移至棕色容量瓶,即可得到0.1 mol/L的硫酸镁溶液。
1.3.4 鸭肉提取液的制备 称取约5 g已匀浆好的鸭胸脯肉放入50 mL离心管中,加入10 mL无水甲醇,经涡旋、超声震荡,4 200 r/min离心10 min,残渣用无水甲醇再萃取1次。合并萃取液,在30 ℃下氮气吹干,用4 mL乙腈溶解,加入8 mL正己烷,经涡旋、超声震荡,于4 200 r/min 离心10 min,取乙腈相,于30 ℃水浴下氮气吹干,继续使用乙腈和正己烷重复去脂提取1次,氮气吹干后加入10 mL的无水甲醇,经0.25 μm有机系微孔膜过滤后得到空白鸭肉提取液备用[11]。称取约10 mg DES标准品,用鸭肉提取液定容至100 mL即为含100 mg/L DES的鸭肉提取液。将含100 mg/L DES的鸭肉提取液用空白鸭肉提取液稀释即可得含不同浓度DES的鸭肉提取液。
1.3.5 检测条件的优化 调节1%柠檬酸三钠的加入量分别为0.6,0.8,0.9,1.0,1.2 mL,制得5种不同粒径的纳米金胶,来确定适合本研究的纳米金胶的最优粒径。再加入500 μL 纳米金胶、5 μL含DES的鸭肉提取液(8 mg/L)和70 μL 硫酸镁溶液(0.1 mol/L),确定柠檬酸三钠的最佳加入量。用不同体积(300,500,700,900,1 100 μL)的纳米金胶分别与5 μL的含DES的鸭肉提取液(8 mg/L)和70 μL 的硫酸镁溶液(0.1 mol/L)混合,来确定纳米金胶最优加入量。试验中固定加入500 μL纳米金胶与70 μL硫酸镁(0.1 mol/L),改变含DES的鸭肉提取液(8 mg/L)的加入量(3,5,10,15,20 μL),来确定含DES的鸭肉提取液最优加入量。固定加入500 μL纳米金胶和5 μL含DES的鸭肉提取液(8 mg/L),再分别加入不同量(30,50,70,100,120,150 μL)的硫酸镁溶液(0.1 mol/L),来确定硫酸镁溶液的最优加入量。以加入纳米金胶500 μL,含DES的鸭肉提取液(8 mg/L) 5 μL,硫酸镁溶液(0.1 mol/L)70 μL,经反应时间0,1,5,10,15,20 min后,来确定最优反应时间。
1.3.6 光谱测量与数据分析方法 将500 μL纳米金胶、5 μL 含DES的鸭肉提取液和70 μL硫酸镁溶液依次加入到2 mL石英瓶中进行振荡以充分混合,1 min后将其放入样品池中进行拉曼光谱的采集。相关仪器参数设置如下:500 mW 的激光器的激光发射功率,分辨率6 cm-1,积分时间10 s,积分平均2次,平滑度为1,并选取扫描光谱波段为400~1 800 cm-1进行研究。每个浓度做5个平行样,并以其平均拉曼光谱作为该浓度样本的拉曼光谱进行分析。根据819 cm-1处的拉曼强度,采用单因素分析法对试验条件进行优化。用819 cm-1处特征峰峰强建立预测鸭肉提取液中DES含量(0.5~13.0 mg/L)的标准曲线,并对含不同DES浓度(2.0,5.0,8.0,10.0,12.0 mg/L)的鸭肉提取液样本进行回收率试验。
2 结果与分析
2.1 鸭肉中DES的SERS分析
图1中的曲线a~e分别表示纳米金胶+硫酸镁(0.1 mol/L)、甲醇、鸭肉提取液、DES标准品(8 mg/L)和含DES的鸭肉提取液(8 mg/L)的SERS光谱。由曲线c与曲线e对比可知,在曲线e中585,819,895,1 073,1 091 cm-1处出现比较明显的特征峰,而在曲线b上,585,895 cm-1处出现比较弱的峰,由此考虑将819,1 073,1 091 cm-1处特征峰定为DES的拉曼特征峰,可能是鸭肉提取液中成分较复杂,影响了DES标准品溶液的一些分子基团性质,使585,895 cm-1处特征峰被覆盖。为进一步确定DES拉曼特征峰位置,将曲线d与曲线b进行对比,在DES标准品SERS曲线d中,上述3个拉曼位移(819,1 073,1 091 cm-1)处也能得到与曲线e相同的特征峰,并且同在819 cm-1拉曼位移处特征峰峰值最高,因此本研究将819 cm-1处的峰作为后续检测鸭肉中DES残留量的最佳拉曼特征峰。将曲线d和曲线a对比可知,纳米金胶和硫酸镁作为增强基底,测得的DES标准品的拉曼光谱,具有特征峰数量增多,峰值强度提高的特点,证明纳米金胶和硫酸镁增强基底对DES标准品的拉曼峰有着不错的增强效果。
2.2 不同粒径纳米金胶对拉曼光谱的影响
不同柠檬酸三钠还原剂的加入量可以制得不同粒径的纳米金胶,进而对拉曼光谱的增强效果产生影响[12]。以不同粒径纳米金胶制备所需的柠檬酸三钠加入量为横坐标,特征峰819 cm-1处的峰值强度为纵坐标绘制图2。可看出随着柠檬酸三钠加入量的增加,819 cm-1处的峰值强度呈先上升后下降的趋势,在其加入量为0.9 mL时,对应的峰值强度最高,证明了不同粒径纳米金胶对DES的鸭肉提取液的拉曼光谱有着紧密的关系。因柠檬酸三钠加入量为0.9 mL时峰值最强,所以,在后续试验中均采用柠檬酸三钠还原剂加入量为0.9 mL制备金胶。
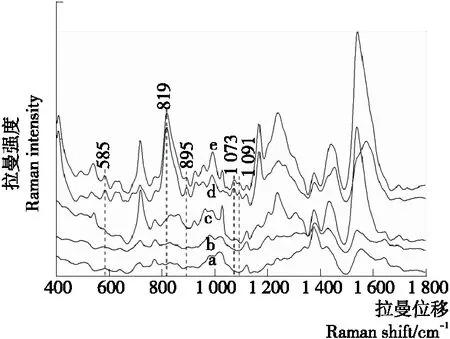
a. 纳米金胶+硫酸镁 b. 甲醇 c. 鸭肉提取液 d. DES标准品(8 mg/L) e. 含DES的鸭肉提取液(8 mg/L)
图1 不同样品的SERS光谱
Figure 1 SERS spectra of different samples

图2 柠檬酸三钠加入量对含DES的鸭肉提取液(8 mg/L)的SERS强度的影响
Figure 2 Effect of the amount of the sodium citrate on SERS intensities of duck meat extract containing DES (8 mg/L)
2.3 纳米金胶加入量对SERS信号的影响
本研究中自制的纳米金胶是鸭肉中DES能产生SERS效应的必需条件。因此,有必要考察金胶的加入量对SERS信号强度的影响。图3为加入不同量纳米金胶时,在819 cm-1拉曼位移处的SERS信号强度随金胶加入量变化的趋势图。从图3可看出,拉曼散射强度随着纳米金胶加入量的增大,呈先增后减再增最后减的趋势,但在纳米金胶加入量为500 μL时拉曼散射强度达到最高。因此,在后续试验纳米金胶加入量都建立在500 μL的基础上进行分析。纳米金胶加入量为900 μL时的拉曼强度比纳米金胶加入量为700 μL时增加的原因可能是鸭肉提取溶液中的DES分子和其他成分分子与纳米金胶颗粒发生竞争性吸附,此时有更多的DES分子吸附在纳米金胶颗粒表面。
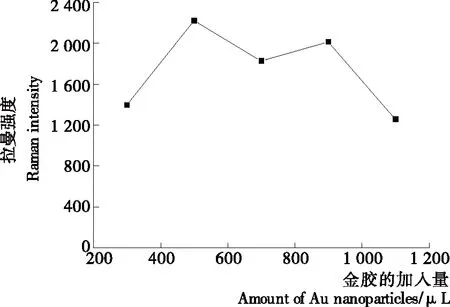
图3 金胶加入量对含DES的鸭肉提取液(8 mg/L)的SERS强度的影响
Figure 3 Effect of the addition amount of the Au nanoparticles on SERS intensities of duck meat extract containing DES (8 mg/L)
2.4 待测液加入量对SERS信号的影响
在入射光照条件下,金胶纳米粒子中电子与鸭肉提取液中的分子产生等离子体共振进而产生SERS效应[12-13]。由图4可以发现,819 cm-1处的拉曼特征峰峰强与含DES的鸭肉提取液加入量存在密切关系,其峰强在含DES的鸭肉提取液加入量为3~5 μL时呈上升趋势,可能是待测液的增加,导致DES分子数量增多,从而增大了DES分子吸附在纳米金胶活性位置上的概率。在加入量超过5 μL时拉曼特征峰强度下降到较低值,可能是过量的含DES的鸭肉提取液会导致纳米金胶、含DES的鸭肉提取液和硫酸镁溶液的混合液中一些蛋白质和脂肪杂质的增多,影响了DES分子与纳米金胶的吸附。故最佳待测液的加入量为5 μL。
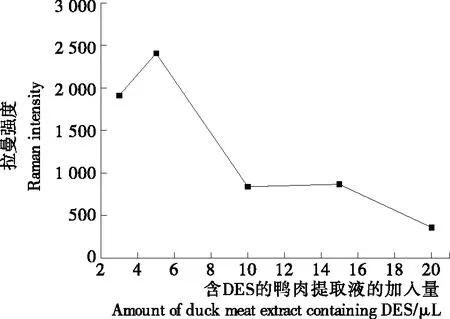
图4 含DES的鸭肉提取液加入量对含DES的鸭肉提取液(8 mg/L)的SERS强度的影响
Figure 4 Effect of the addition amount of the duck meat extract containing DES on SERS intensities of duck meat extract containing DES (8 mg/L)
2.5 硫酸镁溶液加入量对SERS信号的影响
鸭肉提取液中的DES分子如仅仅在本研究中金纳米颗粒的吸附作用下,产生的拉曼信号非常弱,必须在活化剂存在的条件下才能够得到明显的增强,可能是活化剂分子对金纳米颗粒有诱导和活化效果,可增强鸭肉提取液中分子与基底之间的凝聚程度,进而影响电磁场的增强,从而增强鸭肉提取液中分子的SERS[13]。本研究以硫酸镁溶液为活化剂,来改变金纳米粒子的凝聚状态。图5为硫酸镁加入量对819 cm-1处特征峰峰强的影响。根据图5可发现,当硫酸镁溶液的体积<70 μL时,819 cm-1处的拉曼强度逐渐升高。这可能是少量的硫酸
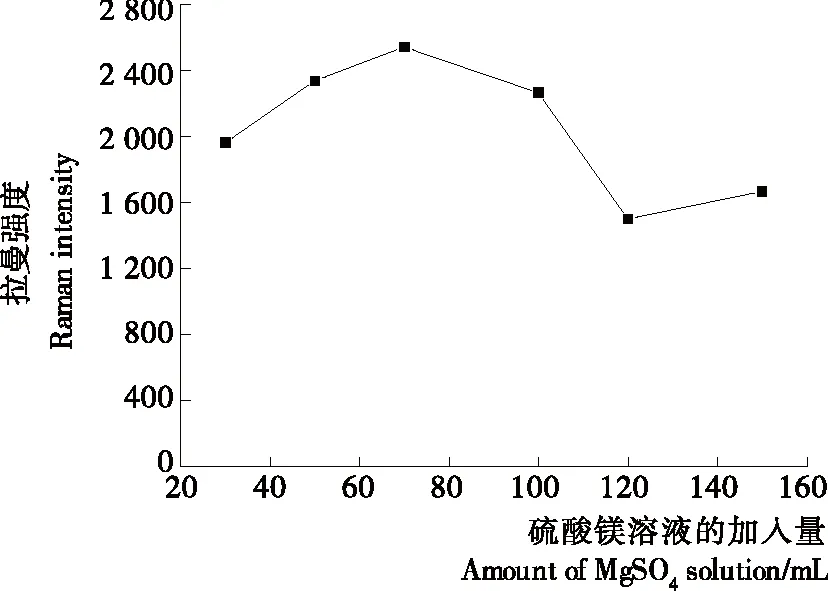
图5 硫酸镁溶液加入量对含DES的鸭肉提取液(8 mg/L)的SERS强度的影响
Figure 5 Effect of the addition amount of the MgSO4solution on SERS intensities of duck meat extract containing DES (8 mg/L)
镁溶液可增强鸭肉提取液中的DES分子与金纳米颗粒的凝聚状态,从而增强DES分子在819 cm-1处的拉曼信号强度。当硫酸镁溶液的体积>70 μL且≤150 μL时,过量的硫酸镁分子可能引起了金纳米颗粒的聚沉,反而降低了DES分子在819 cm-1处的拉曼信号强度。150 μL时的拉曼强度比120 μL时的增加可能是由竞争性吸附效应引起的,此时有更多的DES分子吸附在纳米金胶颗粒表面。基于此,将硫酸镁溶液(0.1 mol/L)的最佳加入量定为70 μL。
2.6 反应时间对SERS信号的影响
研究[14]发现在表面增强拉曼散射中,会出现一些纳米粒子聚集点(称为“热点”),能使吸附在上面的样品分子或官能团的光散射强度得到最高可达106倍的增强;过长的吸附反应时间,可能会使金纳米粒子产生聚沉,减少热点数目,降低拉曼光谱强度。对所采集数据进行air-PLS处理,再以吸附时间为横坐标,819 cm-1处特征峰峰强为纵坐标建立关系曲线。如图6所示,随着时间的延长,拉曼特征峰强度先急剧下降后缓慢降低,虽然吸附0 min 时的特征峰强度最高,但因0 min的吸附反应时间操作较困难,例如,纳米金胶、含丙酸睾酮的鸭肉提取液和硫酸镁溶液需多人同时且快速加入同一2 mL石英进样瓶中,易引起操作误差,故在试验中均选择1 min采集拉曼光谱。
2.7 鸭肉中DES的SERS定量分析
对采集到的鸭肉提取液中含不同DES 浓度(0.5,1.0,3.0,4.0,6.0,7.0,9.0,11.0,13.0 mg/L)的样本SERS光谱进行分析,发现随着DES浓度的增加,819 cm-1拉曼位移处的特征峰峰强也在随之增高。因此,将819 cm-1拉曼位移处的特征峰强度为依据对鸭肉中DES的含量进行定量分析。
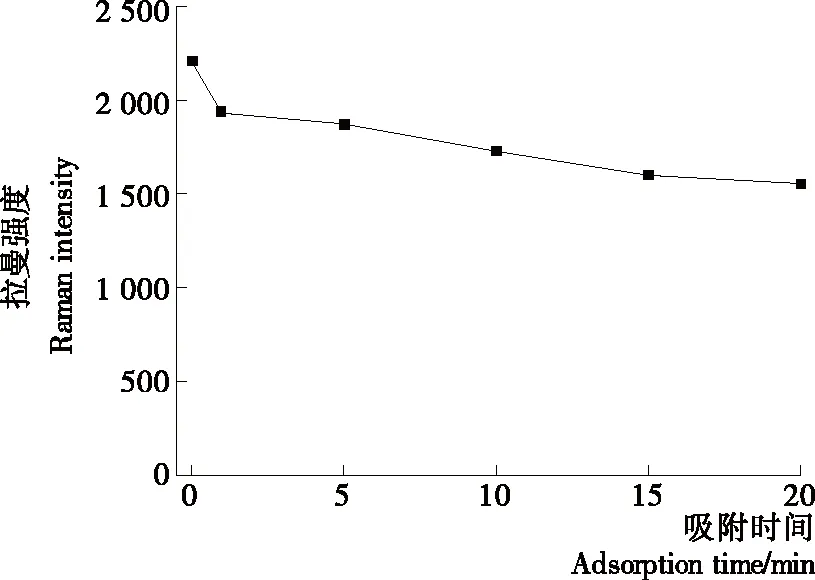
图6 吸附时间对含DES的鸭肉提取液(8 mg/L)的SERS强度的影响
Figure 6 Effect of the adsorption time on SERS intensities of duck meat extract containing DES (8 mg/L)
分析含不同DES浓度(0.5~13.0 mg/L)的鸭肉提取液样本的拉曼光谱强度,绘制出鸭肉提取液中DES浓度与各DES浓度在819 cm-1处特征峰峰强的关系曲线如图7(a)所示,横坐标为鸭肉提取液中DES残留的浓度,纵坐标为819 cm-1拉曼位移处的特征峰强度。由图7可知,鸭肉提取液中DES浓度在0.5~13.0 mg/L时,与819 cm-1处特征峰强度呈现良好的线性关系,其线性方程为:y=185.81x+1 260,决定系数(R2)为0.942 4。为进一步做预测分析,验证该方法的可靠性,对含不同DES浓度(2,5,8,10,12 mg/L)的鸭肉提取液样本进行回收率试验。图7(b)给出了预测集样本中DES含量的实际值与预测值之间的关系,它们之间的R2为0.969 0,预测均方根误差(RMSEP)为0.728 1 mg/L。对预测样本进行回收率试验,样本回收率为83%~133% (表1)。试验结果表明,基于本研究自制增强基底的SERS技术应用于快速检测鸭肉中DES残留量是可行的,在现场检测中有较好的推广使用价值。
3 结论
本研究建立了一种鸭肉中DES残留的拉曼光谱快速检测方法。对检测鸭肉中DES残留的最优检测条件进行了分析,得到纳米金胶、含DES的鸭肉提取液、硫酸镁溶液的最优加入量分别为500,5,70 μL,较优的测试时间为1 min。在此研究基础上,以鸭肉提取液中DES浓度与819 cm-1处特征峰峰强建立的标准曲线方程呈现良好的线性关系,最低检测浓度可达到0.5 mg/L。进一步做预测分析,预测集R2为0.969 0,RMSEP为0.728 1 mg/L,平均回收率为83%~133%。本方法的样本前处理简单快速,较好地满足了鸭肉中DES残留快速检测要求,有较好的应用前景。但本方法只能检测鸭肉中的一种抗生素DES残留,在后期的研究中,可探索不同种纳米增强胶体或样本前处理方法对鸭肉中多种抗生素残留进行SERS多残留检测的可能性。
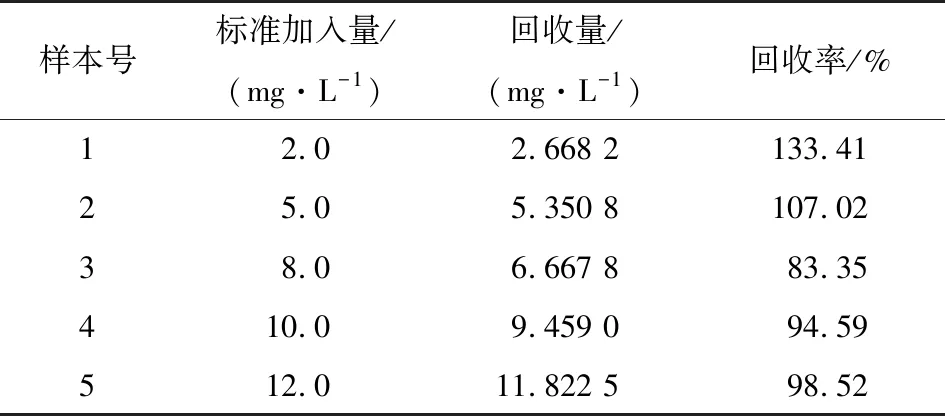
表1 含DES的鸭肉提取液加标样本回收率

图7 鸭肉中DES的SERS定量分析结果
Figure 7 SERS quantitative analysis results for samples of duck meat extract containing DES

