二轮复习中与用量有关离子反应的定量思考
2019-04-24 07:38四川唐金能
教学考试(高考化学) 2019年1期
四川 唐金能
离子反应是历年高考的重要考点,与用量有关的离子方程式的书写和正误判断更是考试中的难点,该类试题虽然难度不大,但却是许多学生的失分点。下面笔者就高考前的二轮复习,立足于高中学生化学的理论水平基础,谈谈与用量有关的离子反应在复习中如何进行定量思考。
学生通过高中化学的学习与一轮复习,应该能认识到离子反应之所以能发生,是因为这些离子共存时能发生反应导致离子浓度减小,而与用量有关的离子反应,为什么用量不同,离子方程式就不同?下面举例说明。
这样的离子反应,所给出的反应物相互反应时,涉及的不是一个离子反应,而是多个,所给的量始终不能同时满足两个或多个离子反应同时完全进行,所以就和用量有关了!
例1.Ca(HCO3)2溶液与NaOH溶液反应。为表达方便,令n(NaOH)∶n[Ca(HCO3)2]=k,在平时的教学和复习中,许多老师们主要给学生讲解的是这样两种情况:

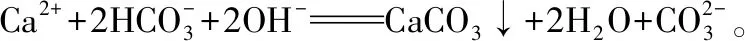

例2.连续用量的离子反应,如CO2逐渐缓慢通入含有1 mol NaOH溶液中,令n(NaOH)∶n(CO2)=k,平时简单理解为两种情况:

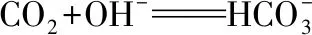



例4.氧化还原反应类型与用量有关的离子反应,如Fe与稀HNO3溶液反应,重点介绍了以下两种情况:

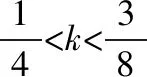
又如:将Fe(NO3)3溶液与HI混合反应,令n[Fe(NO3)3]∶n(HI)=k,
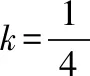


其他例子:Cl2通入一定量的FeBr2溶液中、Cl2通入一定量的FeI2和FeBr2的混合溶液中、SO2通入Ca(ClO)2溶液的反应等。

猜你喜欢
中学生数理化·中考版(2021年10期)2021-11-22
食品安全导刊(2021年21期)2021-08-30
世界科学技术-中医药现代化(2020年2期)2020-07-25
小哥白尼(趣味科学)(2020年5期)2020-05-22
中国外汇(2019年22期)2019-05-21
妈妈宝宝(2018年9期)2018-12-05
人间(2015年11期)2016-01-09
青少年科技博览(中学版)(2015年4期)2015-07-18
漫画月刊·哈版(2009年8期)2009-03-26
中学生数理化·高一版(2008年1期)2008-11-15

