低温胁迫下外源ABA对开花期水稻叶鞘激素含量及抗寒生理的影响
项洪涛,齐德强,李琬,郑殿峰,王月溪,王彤彤,王立志,曾宪楠,杨纯杰,周行,赵海东
(1.黑龙江省农业科学院博士后工作站,黑龙江 哈尔滨 150086;2.黑龙江省农业科学院耕作栽培研究所,黑龙江 哈尔滨 150086;3.黑龙江八一农垦大学农学院,黑龙江 大庆163319)
水稻(Oryzasativa)是全球第二大作物,也是中国最主要的粮食作物之一,中国有60%以上的人口以稻米作为主要口粮食用,同时稻米也是全球半数以上人口的主粮[1-2]。水稻起源于热带地区,是喜温植物,目前水稻种植范围较广,从热带、亚热带到温带、甚至是寒冷地区都有种植[2]。水稻生长对水分、光照等气象条件具有一定的要求,尤其对温度条件非常敏感[3]。在全球气候变暖的背景下,极端天气事件出现的频率发生变化,呈增多增强的趋势[4],近年来我国东北地区夏季频繁发生低温,对农业生产造成很大影响。与其他禾本科作物不同,水稻更容易受到低温伤害,营养生长阶段遭受低温可推迟后续各生育时期并延迟抽穗[5],生殖生长过程中能引起花粉不育、降低结实率并严重减产[6],低温对水稻生产的影响一直是水稻气象研究的重点问题[4]。
低温对水稻生长发育的影响是复杂的生理生化过程,同时水稻抵御冷害也是多系统协调参与的理化反应过程。低温发生后,植物细胞的结构和内含物会发生一系列的适应性变化,以维持正常生长[7]。近年来,国内外学者对水稻障碍型冷害开展了有关研究,指出水稻对低温的应答主要体现在细胞膜系统受到不可逆的损害、渗透调节物质含量提高、保护酶系统发生变化等方面。施大伟等[8]指出水稻抽穗期低温导致活性氧的产生和清除失衡,O2-·迅速积累,膜脂过氧化加剧,细胞膜发生损伤。邓化冰等[9]指出耐冷水稻品种的H2O2和丙二醛(MDA)含量显著低于冷敏品种,这可能与耐冷品种活性氧的产生和清除相对较为均衡有关。Xiang等[10]指出在一定时间内,低温能够使SOD、POD等保护酶活性得到提高,项洪涛等[2]的研究也表明低温促进水稻可溶性物质含量增加。低温对水稻生产最大的影响就是降低产量,主要原因是花药缩小,花药内不育花粉数量增加,结实率下降,进而影响水稻产量[11-12]。
脱落酸(ABA)是一种倍半萜植物激素,具有控制植物生长、抑制种子萌发及促进衰老等生理作用,参与植物响应干旱、盐碱、低温等逆境胁迫的反应[13]。内源ABA含量在抗寒性不同的品种间具有比较明显的差别,一般抗寒性强的品种其内源ABA含量较高。低温条件下,植物生长减慢,内源激素水平发生变化,ABA增加,生长素(IAA)、赤霉素(GA)等减少[14]。外施ABA可以增强植物的抗冷性[13],这在很多植物上已得到证实,如邓凤飞等[15]研究表明,外源ABA在低温胁迫下能够促进作物体内脯氨酸的积累,黄杏等[16]报道低温胁迫下外源ABA可以改变作物内源激素水平,使内源ABA含量增加,GA含量降低,提高作物抗寒性。方彦等[17]指出外源ABA具有提高作物抗寒性的诱导效应,能提高作物氧化酶活性,同时减缓膜脂过氧化产物MDA的积累,这与孙哲等[18]报道的逆境胁迫下外源ABA能够提高作物抗氧化防护系统,降低MDA含量,促进可溶性物质的积累,提高作物抗逆性的研究结果一致。
目前,我国对水稻障碍型冷害的研究较多,但主要集中在孕穗期,对开花期低温的相关研究较少,尤其是开花期低温导致叶鞘生理机能的变化、外源ABA对低温缓控效应的研究更少。因此本试验于开花期对水稻进行低温处理,开展低温胁迫下外源ABA对水稻叶鞘的影响,旨在分析外源ABA抵御低温的作用,丰富寒地水稻的抗冷技术工程体系,为水稻保产稳产提供理论支持。
1 材料与方法
1.1 试验材料
选用龙稻5(LD5)和龙粳11(LJ11)为试验品种。LD5为耐冷品种,LJ11为冷敏品种。供试材料由黑龙江省寒地作物生理重点实验室提供。
1.2 试验设计与处理
试验于2015和2016年在黑龙江省农业科学院耕作栽培研究所盆栽场及人工气候室内进行,由于两年规律一致,本研究选用2016年数据。采用盆栽方式,单苗栽插,每盆保苗3株,盆高30 cm、直径25 cm。试验用土取自哈尔滨市道外区民主乡,土壤类型为草甸黑土。供试土壤的理化性质:土壤容重约为1.67 g·cm-3,最大田间持水量约为26.88%,有机质含量2.92%、全氮1.35 g·kg-1、全磷0.64 g·kg-1、缓效钾341.5 mg·kg-1、碱解氮151.6 mg·kg-1、速效磷49.97 mg·kg-1、速效钾149.6 mg·kg-1、土壤pH 6.77。将试验用土晾晒后,筛除杂质,每盆称取7.5 kg装盆待用。4月26日进行种子处理,4月30日播种,5月25日进行移栽,每品种分别插秧150盆,选取长势均匀的样本进行试验。待植株生长至开花期(7月12日)喷施ABA并进行低温处理。处理当天上午10:00点,对正在开花的稻穗挂签标识,采取叶面喷施方式施用外源ABA,ABA浓度分别为20 (T1)和40 mg·L-1(T2),折合每hm2用液量为225 L,以喷施清水为对照(CK)。喷施完毕后放入人工气候室内进行低温处理,处理温度为恒定15 ℃,持续时间分别是1,2,3,4,5 d。
1.3 测定项目及方法
1.3.1取样方法 处理期间,连续取样5次,每天上午10:30取样一次,对挂签标记蘖的叶鞘进行取样,取样后立即放入液氮中,而后置于-80 ℃冰箱中保存,供测定生理指标使用。低温处理后每天移至室外12盆,直至成熟,供结实率调查使用。
1.3.2测定方法 取有代表性的挂签标识稻穗的颖花6朵,每个颖花取3个花药,将花药用I2-KI溶液染色后,观察3个视野的染色情况,计算花粉活力;结实率采用人工调查法;按照李合生等[19]的方法测定SOD、POD、CAT的酶活性及MDA含量;采用考马斯亮蓝G-250染色法测定可溶性蛋白含量[19];采用硫酸蒽酮比色法测定可溶性糖含量[20];采用茚三酮比色法测定脯氨酸含量[20];按照张宪政[20]的方法测定相对电导率;采用酶联免疫吸附(Enzyme-Linked Immuno Sorbent Assay,简称ELISA)法测定激素含量[21]。
1.4 数据处理
采用Excel 2010进行数据处理和作图,使用DPS软件进行统计分析。
2 结果与分析
2.1 开花期低温胁迫下外源ABA对水稻生殖生长的影响
2.1.1对花粉活力的影响 由表1可知,开花期低温处理后,水稻的花粉活力明显下降,随着处理时间的延长,花粉活力越来越低。外源ABA能够有效抑制花粉活力的迅速降低。方差分析结果表明:LJ11低温处理1~2 d,ABA处理与CK之间没有明显差异;处理3~4 d,显著或极显著高于CK;处理第5天,T1极显著高于CK,T2处理与CK之间差异不显著。对LD5而言,T1处理2、3和5 d,显著或极显著高于CK;T2处理在第2天显著高于CK,其他时间与CK差异不显著。低温条件下,LD5的花粉活力高于LJ11,外源ABA处理后,T1的效果好于T2。
2.1.2对结实率的影响 由表2可知,开花期低温处理后,水稻结实率随着处理时间的延长越来越低。在一定的时间范围内,外源ABA能够缓解水稻结实率的下降速率。经过方差分析可知:对LJ11来说,T1处理1~4 d,显著或极显著高于CK;处理第5天,T1与CK之间没有显著性差异,T2处理仅在第2天结实率极显著高于CK,其他时间与CK之间没有显著差异。对LD5而言,T1处理仅在第4天显著高于CK;T2处理与CK差异不显著。低温条件下,耐冷品种LD5的结实率高于冷敏品种LJ11,T1处理结实率高于T2,外源ABA对冷敏品种LJ11的处理效果更好。
2.2 开花期低温胁迫下外源ABA对水稻叶鞘内源激素的影响
2.2.1对叶鞘内源激素含量的影响 由表3可知,低温处理后内源ABA含量呈逐步上升的趋势,GA和IAA含量呈逐步下降的趋势。LJ11在处理4 d后,内源ABA含量上升速率较缓,而LD5的上升幅度均高于LJ11,同时LD5在各时期的含量均高于LJ11。内源IAA含量随着低温处理时间的延长变得越来越低,耐冷品种LD5下降的速率高于冷敏品种L11,处理第1天,两个品种IAA含量较为接近,处理2~4 d,LD5的含量低于LJ11,处理第5天时,两品种内源IAA含量又降低到接近的水平。低温导致叶鞘内GA含量逐渐降低,冷敏品种LJ11下降的速率和幅度都高于耐冷品种LD5,同时LJ11在各时期的含量均高于LD5。
叶喷外源ABA能够有效促进水稻叶鞘内源激素含量的正向变化,其促进了内源ABA含量的增加,尤其是T2处理,其显著提高了LD5处理1 d时的含量,极显著提高了处理2~5 d的内源ABA含量,T2处理极显著地提高了LJ11处理后3~5 d的内源ABA含量。同时,外源ABA能够有效促进叶鞘内源IAA和GA含量的降低,方差分析结果表明,其显著或极显著降低了供试品种的GA含量,其中以T1处理效果更好;IAA含量也有变化,从处理2 d开始,外源ABA能显著或极显著降低叶鞘内IAA含量,但是主要以T1处理的效果为好,T2处理的效果不明显。

表1 开花期低温条件下外源ABA对水稻花粉活力的影响 Table 1 Effect of exogenous ABA on pollen viability of rice during flowering stage under low temperature stress (%)
注:平均数后的误差为标准差。采用新复极差法进行多重比较,同列不同小写字母表示在P<0.05水平差异显著,不同大写字母表示在P<0.01水平差异显著,下同。
Note: Error followed the mean is standard error. Treatment means were separated using Duncan’s multiple range test. Different small and capital letters indicate significant differences atP<0.05 andP<0.01 levels of probability within the same column, respectively. The same below.
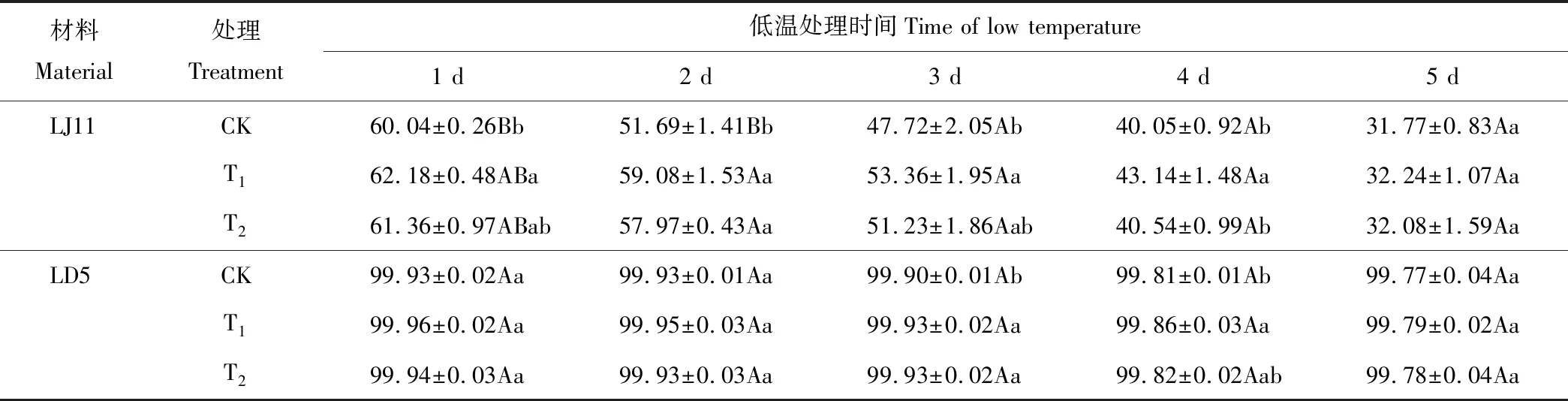
表2 开花期低温条件下外源ABA对水稻结实率的影响 Table 2 Effect of exogenous ABA on seed-setting of rice during flowering stage under low temperature stress (%)
2.2.2对叶鞘内源激素比值的影响 由表4可知,随着低温处理时间的延长,2个水稻品种叶鞘内ABA/GA、ABA/IAA都呈上升的变化趋势。外源ABA处理水稻叶鞘内的ABA/GA、ABA/IAA都高于CK。LJ11低温处理2~5 d,CK的ABA/GA、ABA/IAA的增幅分别为14.31%~40.12%和12.30%~59.86%,T1处理的增幅是24.93%~77.47%和21.80%~90.82%,T2处理的增幅是15.87%~42.41%和13.63%~63.23%;LD5低温处理2~5 d,CK的ABA/GA、ABA/IAA的增幅分别为16.08%~60.70%和18.78%~74.17%,T1处理的增幅是24.52%~89.55%和37.69%~141.02%,T2处理的增幅是18.26%~73.60%和25.21%~89.75%。耐冷品种的ABA/GA、ABA/IAA高于冷敏品种,T2处理的效果好于T1处理。
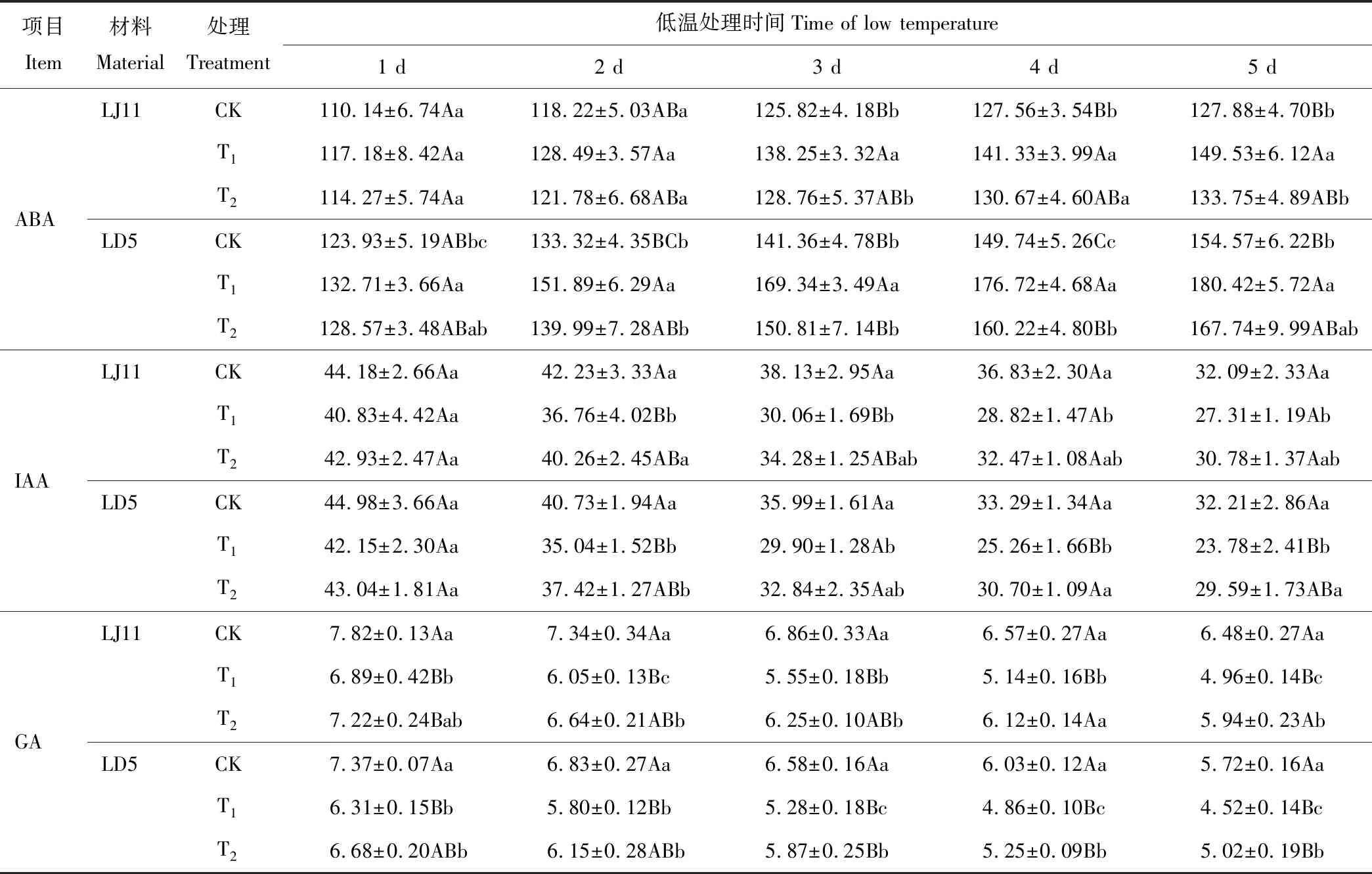
表3 开花期低温条件下外源ABA对水稻叶鞘内源激素含量的影响Table 3 Effect of exogenous ABA on endogenous hormones contents in leaf sheath of rice during flowering stage under low temperature stress (ng·g-1)
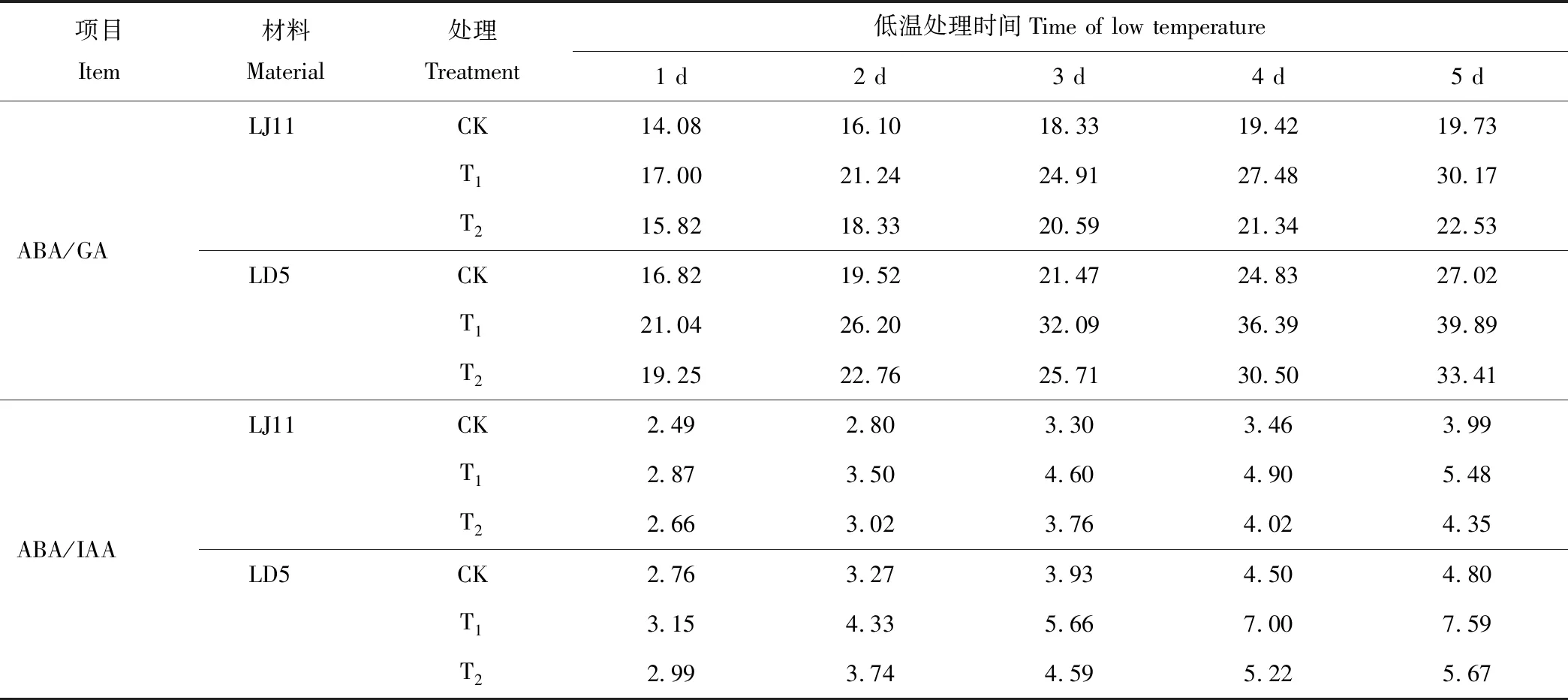
表4 开花期低温条件下外源ABA对水稻叶鞘ABA/GA、ABA/IAA的影响Table 4 Effect of exogenous ABA on the ratios of ABA/GA、ABA/IAA in leaf sheath of rice during flowering stage
2.3 开花期低温胁迫下外源ABA对水稻叶鞘抗寒生理指标的影响
2.3.1对叶鞘膜透性的影响 由图1可知,开花期低温导致水稻叶鞘中脯氨酸含量呈上升趋势,LD5上升幅度高于LJ11。外源ABA能够促进叶鞘内脯氨酸含量增加,方差分析结果表明,经低温处理1 d,T1、T2处理与CK之间的脯氨酸含量差异不显著,低温处理2~5 d,T1处理极显著高于CK。T2处理对不同品种的调控效果不完全相同,LJ11处理1~3 d时,T2与CK差异不显著,处理4~5 d时,两者之间差异显著;LD5处理第5天,T2显著高于CK,其他时期T2处理与CK之间差异不显著。低温条件下,耐冷品种LD5的脯氨酸含量高于冷敏品种LJ11,外源ABA具有提高叶鞘内脯氨酸的调控效能。
由图2可知,开花期低温处理后,水稻叶鞘内MDA含量呈增加的变化趋势,冷敏品种LJ11的MDA含量高于耐冷品种LD5,同时其增量也高于LD5,低温处理5 d,LJ11的MDA含量较处理1 d相比,增加了0.22 μmol·g-1,增幅为63.73%,而LD5增加了0.19 μmol·g-1,增幅为74.67%。外源ABA能够明显控制MDA含量的增加,尤其是T1处理效果更为明显。方差分析结果表明:LJ11低温处理1~2 d,ABA处理与CK之间没有明显差异;处理3 d时,T1显著低于CK,T2与CK之间没有显著性差异;处理第5天,T1和T2极显著低于CK。LD5低温处理1 d时,T1显著高于CK,T2与CK之间没有显著性差异;低温处理3和5 d时,T1和T2极显著高于CK,其他时间处理和CK之间都没有显著差异。

图1 开花期低温条件下外源ABA对水稻叶鞘脯氨酸含量的影响Fig.1 Effect of exogenous ABA on proline content in leaf sheath of rice during flowering stage under low temperature stress
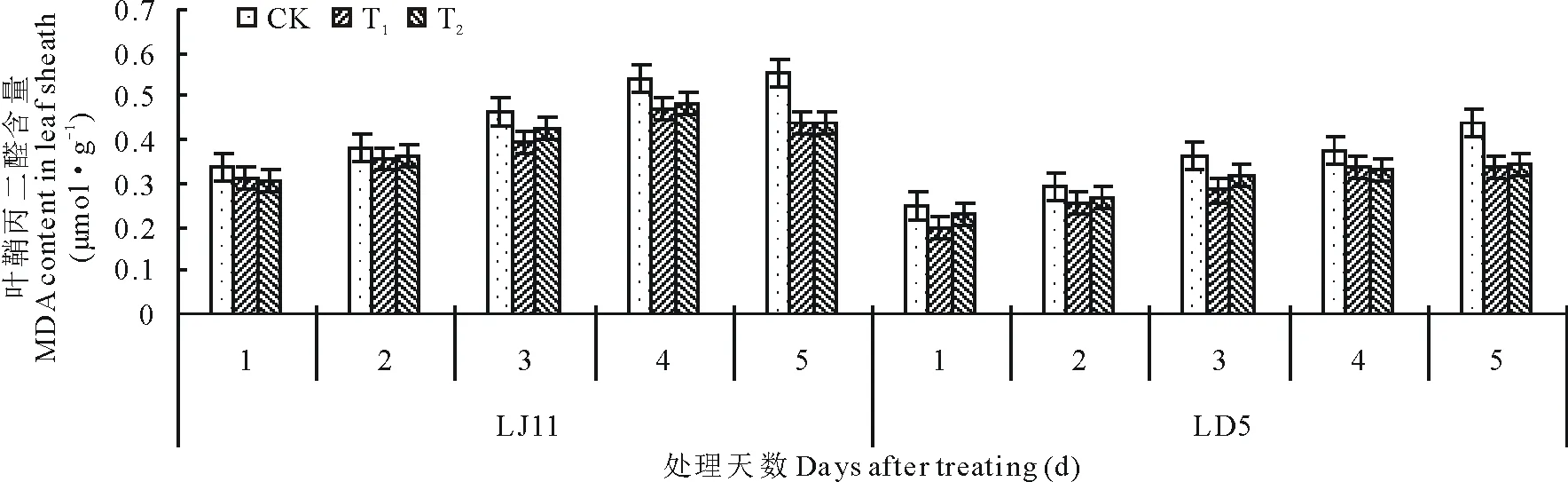
图2 开花期低温条件下外源ABA对水稻叶鞘丙二醛含量的影响Fig.2 Effect of exogenous ABA on MDA content in leaf sheath of rice during flowering stage under low temperature stress under low temperature stress

图3 开花期低温条件下外源ABA对水稻叶鞘相对电导率的影响Fig.3 Effect of exogenous ABA on relative conductivity in leaf sheath of rice during flowering stage under low temperature stress
由图3可知,开花期低温处理导致水稻叶鞘相对电导率提高,耐冷品种LD5上升的幅度不大,而冷敏品种LJ11的上升趋势明显。外源ABA能够有效抑制叶鞘相对电导率的增加,不同浓度处理之间效果不同。经过方差分析可知:LJ11低温处理1~3 d,T1处理与CK之间没有明显差异;处理4和5 d,显著、极显著低于CK;T2处理与CK之间无明显差异。外源ABA处理能降低LD5叶鞘的相对电导率,但与CK差异不显著。低温条件下,耐冷品种LD5的相对电导率低于冷敏品种LJ11,外源ABA处理对冷敏品种LJ11的调控效果较好,以T1的处理效果为佳。
2.3.2对叶鞘可溶性物质含量的影响 由图4可知,开花期低温处理后,水稻叶鞘可溶性糖含量呈先上升后下降的变化趋势。LJ11的可溶性糖含量在处理3 d时达最大值,较处理1 d时增加了25.01%,处理第4天开始降低,第4和5天的含量接近。LD5在处理2~4 d可溶性糖含量接近,为17.05~17.22 mg·g-1,第5天开始降低。外源ABA能够有效促进水稻叶鞘内可溶性糖含量,T2处理的作用不大,仅LJ11处理第3天时,其含量显著高于CK,其他处理均与CK之间无明显差异。T1处理作用较好,LD5低温处理3和4 d时,T1处理的可溶性糖含量显著高于CK,LJ11低温处理5 d内,T1处理均促进可溶性糖含量的增加;方差分析结果表明,T1显著提高了处理1 d时的可溶性糖含量,极显著增加了第2和3天的可溶性糖含量,其他时间与CK差异不显著。低温条件下,耐冷品种LD5的可溶性糖含量高于冷敏品种LJ11,外源ABA处理可促进可溶性糖含量的提高。
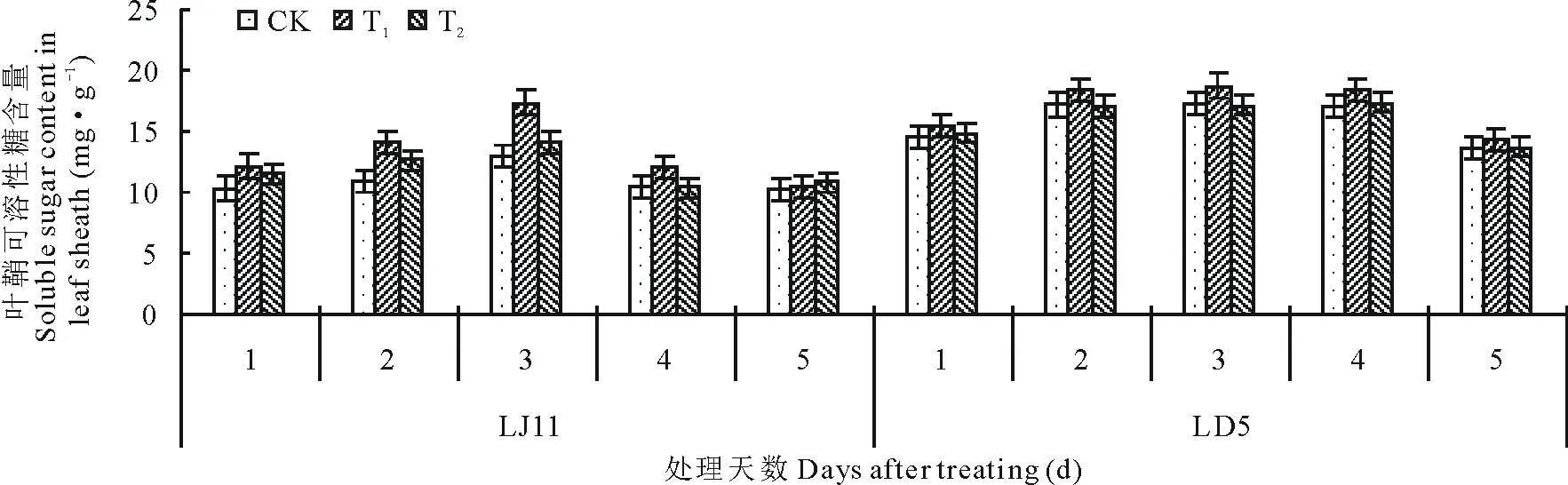
图4 开花期低温条件下外源ABA对水稻叶鞘可溶性糖含量的影响Fig.4 Effect of exogenous ABA on soluble sugar content in leaf sheath of rice during flowering stage under low temperature stress
图5表明,开花期低温可导致水稻叶鞘可溶性蛋白含量增加。低温处理5 d与处理1 d相比,LJ11的CK可溶性蛋白含量增幅为20.05%,LD5的CK可溶性蛋白含量增幅为22.76%。外源ABA能加速水稻叶鞘内可溶性蛋白含量的累积,经过方差分析可知:T1显著提高了LJ11处理1 d时的可溶性糖含量,极显著增加了处理第2~5天的可溶性糖含量,T2处理仅在处理第2天时显著提高了可溶性蛋白的含量,其他时间与CK之间差异不显著。低温处理1~2 d时,外源ABA对LD5叶鞘可溶性糖含量的影响差异不显著,处理3~5 d,T1处理极显著或显著提高可溶性糖含量,T2处理显著提高了处理后第3和5天水稻叶鞘内可溶性蛋白含量。
2.3.3对水稻叶鞘抗氧化酶活性的影响 由图6可知,随着开花期低温处理时间的延长,水稻叶鞘SOD活性呈先升后降的变化趋势。LJ11低温后第4天达到最高值,而LD5是在低温后第3天就达到最高值,但LD5的SOD活性整体高于LJ11。外源ABA处理能明显提高水稻叶鞘内SOD的活性,方差分析结果表明:LJ11低温处理1~2 d,ABA处理与CK之间没有明显差异;处理3~5 d,T1处理显著高于CK; T2处理与CK之间差异不显著。对LD5而言,T1极显著提高各取样时间SOD活性;除处理第2天,T2都显著高于CK。低温条件下,耐冷品种LD5的SOD活性高于冷敏品种LJ11,外源ABA可提高SOD活性。
从图7可以看出,开花期低温处理后,水稻叶鞘POD活性先升高后降低,LD5和LJ11都是在低温处理3 d时达到最高。低温条件下,外源ABA能促进POD活性增加,方差分析结果表明:LJ11低温处理1~2 d,ABA处理与CK之间没有显著差异;处理3~5 d,T1显著或极显著高于CK;T2处理4 d显著高于CK,处理5 d极显著高于CK。对LD5而言,T1处理2~5 d,显著或极显著高于CK;T2处理在第2、4和5天时,显著或极显著高于CK,其他时间与CK差异不显著。低温条件下,耐冷品种LD5叶鞘的POD活性高于冷敏品种LJ11,外源ABA对叶鞘内POD活性具有促进增加的功能。

图5 开花期低温条件下外源ABA对水稻可溶性蛋白质的影响Fig.5 Effect of exogenous ABA on soluble protein content in leaf sheath of rice during flowering stage under low temperature stress

图6 开花期低温条件下外源ABA对水稻叶鞘SOD活性的影响Fig.6 Effect of exogenous ABA on SOD activity in leaf sheath of rice during flowering stage under low temperature stress
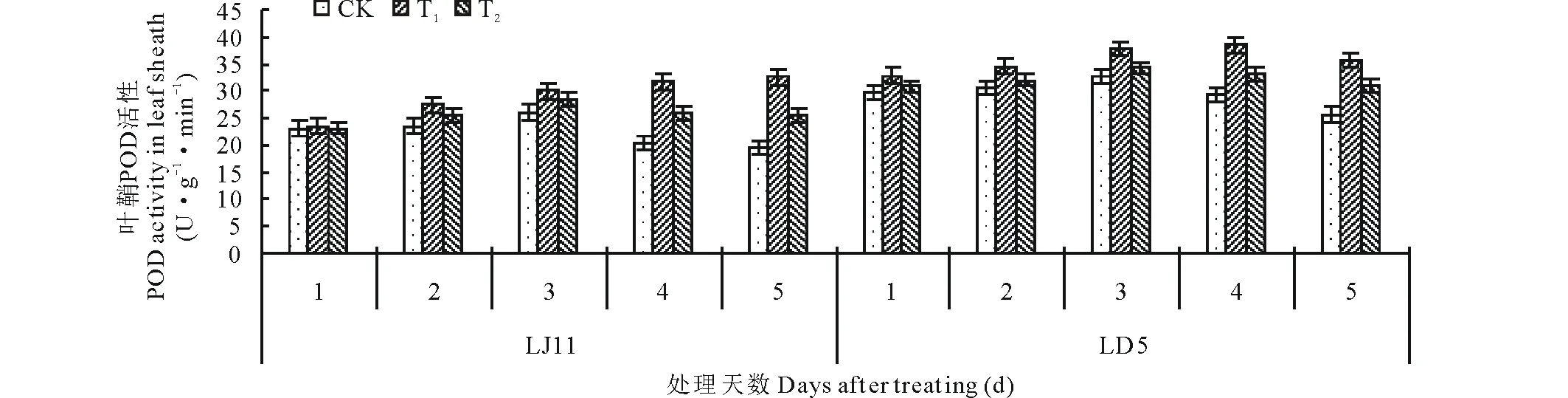
图7 开花期低温条件下外源ABA对水稻叶鞘POD活性的影响Fig.7 Effect of exogenous ABA on POD activity in leaf sheath of rice during flowering stage under low temperature stress
由图8可知,开花期低温处理后,水稻叶鞘内CAT活性整体呈先升后降的变化规律,但变幅不大。耐冷品种LD5的CAT活性高于冷敏品种LJ11。外源ABA能够促进CAT活性的提高,尤其是T1对LD5效果最为明显,方差分析结果表明:LJ11低温处理1~2 d,ABA处理与CK之间没有明显差异;处理3 d时T1显著高于CK,处理4~5 d时T1极显著高于CK,T2仅在处理4 d时显著高于CK;其他时间T2处理与CK之间差异不显著。对LD5而言,低温胁迫开始,T1处理的CAT活性就一直极显著高于CK;T2处理在第4天显著高于CK,第5天极显著高于CK。低温条件下外源ABA处理能促进水稻叶鞘CAT活性。

图8 开花期低温条件下外源ABA对水稻CAT活性的影响Fig.8 Effect of exogenous ABA on CAT activity in leaf sheath of rice during flowering stage under low temperature stress
3 讨论
温度是影响水稻生长发育的重要气象因素之一[22],生育期遭受低温会引起植物体内生理代谢发生明显变化[23]。相同作物的不同品种之间对低温的应答存在很大区别,不同低温持续时间对同一品种的影响也完全不同[12]。曲辉辉等[24]表明低温抑制稻穗正常发育,连续低温导致花粉母细胞发育受阻,颖花退化,出现空瘪粒。李健陵等[25]指出低温导致颖花受精率和可育率下降,使水稻结实率下降。赵国珍等[26]表明低温诱导水稻结实率降低,造成减产。
ABA是一种重要的植物激素,在植物对胁迫耐受性和抗性中发挥着重要作用[27]。逆境条件可诱导ABA合成,有报道称ABA本身也可以诱导表达ABA合成途径中的酶,从而促使ABA的进一步合成,合成的ABA通过正向反馈机制进一步激活了ABA的大量合成,增强了ABA信号转导途径,使植物更好适应胁迫环境[27]。外源激素通过改变内源激素水平调节植物生理代谢[28],低温胁迫下外源ABA能够促进植物体内ABA的合成和运输,降低细胞膜的损伤,提高保护酶活性,增加可溶性糖、可溶性蛋白等渗透调节物质的含量,促进某些酶的重新合成,进而增加植物的抗寒性[28]。
3.1 开花期低温胁迫下外源ABA与水稻生殖生长的关系
水稻生殖生长过程中遇到低温,可引起障碍型冷害,导致幼穗分化机能紊乱,生殖活动受阻,结实率降低。孕穗期低温导致花药缩小,不育花粉数量增加,结实率降低[29];开花期低温使得水稻代谢过程遭到破坏,花粉的生活力和可育性降低,导致花粉的萌发率显著下降,最终造成结实率下降[9]。在一定的低温范围内,外源ABA能够诱导作物抵御低温[30],水稻遭受低温后内源ABA激活水稻适应逆境的机制,增加抗冷性[2]。本研究结果表明,外源ABA能在一定程度上缓解低温对水稻结实率的影响,这是因为外源ABA影响了水稻内源激素的合成,形成了新的动态平衡,以适应新的生育环境。
3.2 开花期低温胁迫下外源ABA调控水稻内源激素含量
激素是植物生长发育的重要调节物质,广泛参与作物生理过程的调节[31],前人研究表明不同种类的激素之间存在着相互促进和相互拮抗的生理效应,植物激素间的动态平衡对植物生长发育的调节作用更为重要[32],段娜等[33]指出内源激素在植物生长发育中发挥重要的作用,其含量变化在植物响应非生物胁迫中扮演关键角色。逆境条件下,作物产生相应的激素信号分子以抵御逆境胁迫[31],ABA是低温逆境下的重要信号因子,对细胞的微管结构具有保护功能,低温条件下植物体内大量快速积累ABA,发挥保护功能[31]。GA是一类能促进作物生长的植物激素,被认为与作物的抗寒性有关,但是作用效果不如ABA明显[34]。IAA是促进类的生长激素,由植株生育顶端合成,所以在植株遭遇逆境时,生长受到抑制,IAA合成量会随之减少。王兴等[35]指出随着气温降低,植物生活力下降,其内源激素发生明显变化,主要表现为ABA大量增多,IAA和GA含量减少。有报道指出植物体内ABA/GA比ABA含量更能代表植株抗寒性的强弱[36],这也说明了植株体内多种激素以不同的配比和平衡来调节植物的抗寒性[37]。
低温条件下外源ABA能有效地改变植物体内的激素平衡关系,李馨园等[31]指出低温胁迫下作物内源ABA含量增加,而外施ABA处理能进一步加强内源ABA的合成,使得内源ABA达到更高的含量水平,黄杏等[16]指出低温条件下外源ABA能有效降低甘蔗(Saccharumspp.)体内GA含量,提高ABA含量,Xiang等[10]的研究表明低温条件下外源ABA能提高水稻叶片内ABA含量,相同的结果在小麦(Triticumaestivum)[38]、柑橘(Citrusreticulata)[39]等作物的研究中也得到证实,本研究结果与此类似,外源ABA在低温条件下能够提高作物体内ABA的含量。外源ABA施用后,发挥了抵御低温的调节效应,主要原因是其进一步增加了内源ABA含量,诱导作物自身保护系统的启动,同时降低了IAA和GA的含量,提高了ABA/GA和ABA/IAA,抑制作物生长发育、降低损耗,各激素之间协同作用抵御低温胁迫。
3.3 开花期低温胁迫下外源ABA影响水稻叶鞘逆境生理
多数研究表明低温影响作物逆境生理指标,比如可溶性物质含量[10]、活性氧类物质含量[40],膜透性物质含量[2]、抗氧化酶系统[41]等。逆境条件下,植物为了减缓由胁迫造成的生理代谢不平衡,细胞大量积累一些小分子有机化合物,通过渗透调节来降低水势,以维持较高的渗透压,保证细胞的正常生理功能[42]。可溶性糖和可溶性蛋白质是低温诱导的小分子溶质,这些物质可以参与渗透调节,并可能在维持植物蛋白质稳定方面起到重要作用[42]。低温胁迫下可溶性糖和可溶性蛋白在植物体内会大量积累,可溶性糖通过某些糖代谢途径形成保护性物质,提高植物抵抗低温的能力[2]。植物在低温等逆境条件下,细胞内自由基代谢平衡被破坏而使自由基不断增加,引发或加剧膜脂过氧化[43]。MDA是细胞膜过氧化的产物,能够抑制细胞保护酶活性,加剧膜脂过氧化,同时其本身也是具有细胞毒性的物质,其含量的高低可作为质膜受损的重要指标[44-45],胁迫强度越大,MDA含量越多,MDA含量与植物耐寒性之间呈负相关[46]。植物体内脯氨酸是蛋白质的组成成分之一,并以游离态广泛存在于植物体中[47]。当水稻处于低温等逆境条件下时,其体内就会积累大量的脯氨酸[7]。大量脯氨酸可提高渗透能力,对降低细胞酸度、稳定生物大分子结构具有良好作用[7],同时积累的脯氨酸也能够充当能量库来协调细胞氧化还原势的生理生化作用[7,48]。低温条件下,植物体内的脯氨酸含量大量增加,被认为是植物对低温的适应性反应[49]。保护酶是指植物体内存在的一系列可以防止自由基对植物造成毒害的具有清除活性氧自由基功能的酶[7]。植物细胞可以产生O2-·、OH-、H2O2等自由基,同时细胞自身还存在一套清除这些自由基的保护酶类[7],如SOD、POD、CAT等。正常情况下,植物能够自动氧化体内不断产生的活性氧类物质,这些物质的产生和清除处于一种动态平衡的状态,所以植物不会受到伤害[13]。但在逆境条件下,植物细胞内的这种动态平衡会被打破,产生大量的具有强氧化性的活性氧类物质[2],可造成细胞膜脂过氧化反应,进而导致膜系统受到损伤使作物受到伤害[50]。植物通过SOD、POD和CAT三者协同作用,使体内的氧自由基维持在较低水平,可以在一定程度上减缓或防御低温胁迫。
低温条件下外源ABA能有效地改变植物体内的抗逆生理指标,蒲高斌等[13]指出低温胁迫下外源ABA能有效提高西瓜(Citrulluslanatus)幼苗叶片中SOD和CAT活性、降低MDA的积累,维持膜的完整性,同时促进渗透保护物质脯氨酸和可溶性糖的增加,增强植株的抗寒性,同时其也表明这是外源ABA有效提高西瓜幼苗抗冷性、减轻低温对西瓜苗伤害的主要生理基础。孙哲等[18]指出逆境条件下外源ABA能有效提高作物体内的SOD、POD活性,有效增加脯氨酸含量,减少MDA的积累,提高作物抗逆性。Xiang等[10]的研究表明低温条件下外源ABA能提高水稻叶片内脯氨酸、可溶性糖和可溶性蛋白含量,有效提高SOD、POD和CAT活性,增强水稻的抗冷性。本研究结果与上述报道类似,低温条件下施用外源ABA后,SOD、POD和CAT活性明显提高,可溶性物质含量提高,降低了MDA的积累,提高了作物的抗冷性。
4 结论
1)开花期低温导致水稻花粉活力下降,结实率降低。外源ABA能够缓解低温伤害,一定时间范围内能控制水稻结实率的降低,使用浓度20 mg·L-1的效果较好。
2)开花期低温导致水稻叶鞘内源ABA含量增加,IAA和GA含量下降。外源ABA可显著促进内源ABA含量的增加,显著降低IAA和GA含量,同时促进ABA/GA、ABA/IAA增高,以20 mg·L-1的使用浓度效果最佳。
3)开花期低温导致水稻叶鞘逆境生理指标发生变化,低温促进SOD、POD和CAT活性的提高,促进可溶性糖、可溶性蛋白、脯氨酸和MDA含量的提高,同时提高了相对电导率。外源ABA具有抵御低温、保护作物、降低伤害的作用,其能有效增加可溶性物质、脯氨酸含量,降低MDA含量和相对电导率,同时也能相应的提高保护酶活性。

